烟曲霉无性产孢的调控机制研究
桑红 张彩云(南京大学医学院临床学院南京军区南京总医院皮肤科,南京210002)
烟曲霉无性产孢的调控机制研究
桑红 张彩云
(南京大学医学院临床学院南京军区南京总医院皮肤科,南京210002)
【摘要】烟曲霉是侵袭性曲霉菌病的重要病原菌之一,它通过产生无性分生孢子进行感染。孢子的生存能力极强,能在多种微生物培养基上和环境条件下生长。现对烟曲霉无性产孢的基因调控机制的研究进展作一阐述。
【关键词】烟曲霉;无性产孢;基因调控
[Chin J Mycol,2015,10(5):257⁃260]
烟曲霉(Aspergillus fumigatus)是一种腐生性条件致病性丝状真菌,生存能力极强。它产生能在空气中传播的分生孢子,广泛分布于自然界中。孢子既是烟曲霉自身的传播和存活方式,也是接种感染人类或其他动物的根源。烟曲霉孢子的直径只有2~3 μm,经呼吸进入肺部后则有可能进入肺泡,进而膨胀、出芽,产生菌丝侵入肺实质,甚至穿透血管壁迁移到其他器官[1⁃2]。根据宿主免疫状态和肺部结构特点,烟曲霉能引起不同的感染或过敏性疾病。其中,侵袭性曲霉菌病(invasive aspergil⁃losis,IA)是最严重的一种感染形式,主要发生于机体免疫力降低的人群,如长期使用广谱抗生素、糖皮质激素以及免疫抑制剂者,其死亡率可高达50% ~95%[3]。导致IA的经典的危险因素是中性粒细胞缺乏(粒缺),但是,近年来非粒缺者发生IA的数量逐渐上升,甚至免疫力正常的人暴露于孢子浓度较高的环境中也可能发生IA[4⁃6]。然而,临床上我们课题组成功诊治产孢产黑发生异常的烟曲霉菌株所致肺部感染1例,且研究发现其致病性也有特殊[7]。因此,探究烟曲霉分生孢子形成的分子机制,进而针对可能的靶点设计药物,对曲霉菌病的预防和治疗具有重要意义。
既往认为烟曲霉只有无性生殖方式,近年来有研究者发现它在特定的条件下也能进行有性繁殖[8]。通常,烟曲霉一次无性产孢能释放出大量的单核分生孢子[9](见图1)。在合适的条件下,孢子萌发出菌丝,菌丝不断延长、长出分支;菌丝上的一部分细胞特化形成厚壁而膨大的足细胞(foot cell);在与足细胞垂直的方向上生出直立的分生孢子梗(conidiophore),一般不分支,多数不分隔;分生孢子梗顶端膨大形成顶囊(vesicle),呈烧瓶形;顶囊表面的顶端生出单层产孢细胞,称为瓶梗(phialide);瓶梗成熟后在其顶端形成单核分生孢子(conidia)并逐个外推,最后形成不分支的一串分生孢子链。由顶囊、产孢细胞和分生孢子链组成的结构称为分生孢子头(conidial head),在烟曲霉表现为绿色柱形头;最后,分生孢子链通过不断的有丝分裂释放出单核分生孢子[10]。
无性产孢的基因调节通路在模式真菌构巢曲霉(Aspergillus nidulans)中已经得到了广泛而深入的研究[11]。构巢曲霉中,3个下游基因(brlA、abaA、wetA)与6个上游基因(fluG、flbA、flbB、fl⁃bC、flbD、flbE)协调作用,共同控制产孢特异的基因表达,以及决定在分生孢子发生发展和成熟过程中的基因激活顺序[9,12⁃13]。目前,通过比较基因组学的研究已经在烟曲霉中鉴定出一些构巢曲霉的产孢相关调控蛋白的同源蛋白,并对其功能进行了探究[11,14⁃15]。然而,烟曲霉的产孢调控机制较构巢曲霉更为复杂而多样,以下将对烟曲霉无性产孢的基因调控机制的研究现状作一阐述(见图2)。
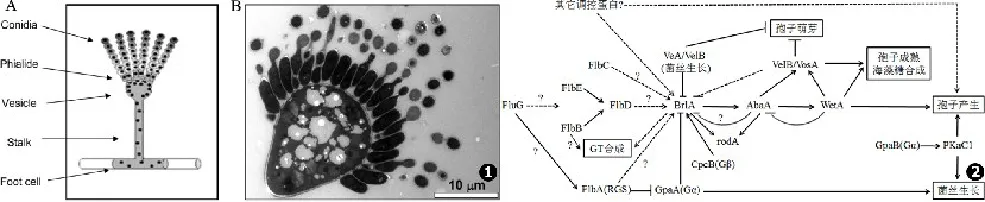
图1 烟曲霉产孢结构图:A.模式图,B.透射电镜图[9] 图2 烟曲霉生长发育调控模型Fig.1 The conidiophore of Aspergillus fumigatus.A.Simplified illustration;B.Transmissionelectron micrograph Fig.2 Growth and development con⁃trol in Aspergillus fumigatus
1 下游调控机制
brlA⁃abaA⁃wetA是烟曲霉和构巢曲霉共同的下游中心调节通路[11⁃13,16]。其中,brlA在分生孢子梗发育的早期开始表达,是启动无性产孢的关键基因。BrlA蛋白是一个C2H2锌指结构的转录因子,介导极性生长的菌丝向顶囊形成[11]。在烟曲霉中,无论是液体还是固体培养条件下,brlA的转录本均在无性发育时显著积累;而brlA敲除菌则完全废除无性发育过程和胶霉毒素(GT)的产生,导致菌落中狭长的气生菌丝形成和菌丝量增加[11,17]。
接下来,brlA依次激活中心调节通路brlA⁃abaA⁃wetA的另外两个下游基因abaA和wetA,二者分别在瓶梗分化和孢子成熟方面发挥作用[13]。abaA基因敲除菌的分生孢子梗形态基本正常,但产生圆柱状的终末细胞,不能形成正常的分生孢子链,因而无分生孢子产生[13,16]。wetA在AbaA的激活下于无性产孢后期表达,对孢子的成熟尤其是细胞壁的完整性至关重要[13,16]。缺失wetA的菌株将产生细胞壁有缺陷的无色素分生孢子,这样的孢子胞浆减少、生存能力降低[13,16]。此外,wetA敲除菌中brlA和abaA基因的mRNA水平上升,表明WetA对上游两个基因的表达发挥了负反馈调节的作用[13]。
除了下游中心调节通路,还有一些基因对烟曲霉孢子的完整性起着不可或缺的作用。其中,rodA 和vosA基因的转录也受到brlA的上游调控[13]。RodA是一种低分子量的、分泌型疏水多肽,它形成孢子最表面的rodlet疏水层。Tao和Yu等[13]研究者提出,rodA基因是由BrlA在AbaA的协助下激活的。VosA与另外3个蛋白,VeA、VelB和VelC有高度的同源性,四者合称为“velvet”调节蛋白,它们是真菌特有的一个蛋白家族[18⁃19]。在烟曲霉中,velvet蛋白似乎是通过相互作用以复合物(VosA⁃VelB复合物,VeA⁃VelB⁃LaeA三聚体等)的形式,在生长发育过程中对(负)调控产孢和brlA表达发挥作用[20]。无论是烟曲霉还是构巢曲霉,在无性生长和孢子产生过程中,VelB和VeA一起作为产孢和brlA表达的关键负调节蛋白,而WetA和VosA⁃VelB复合物协同调控孢子成熟的完成、海藻糖的生物合成和产孢的反馈调节[9,20⁃22]。Tao和Yu等[13]的研究表明,vosA(也许还有veA、velB和velC)主要由AbaA在WetA的协助下于产孢后期激活。
2 上游调控机制
相对于下游调控机制而言,烟曲霉的产孢上游调控是复杂多样的。在烟曲霉的生命周期中,flbE是持续表达的,敲除flbE基因会导致产孢量减少以及brlA和vosA的延迟表达。另外,flbE对烟曲霉在液体培养时盐诱导条件下的生长发育是必需的[15]。与构巢曲霉中的flbB不同,烟曲霉的flbB产生两个转录本,预示着编码了两个碱性亮氨酸链状结构域(bZIP)多肽:FlbBα(420 aa)和FlbBβ(390 aa)[17]。FlbBα和FlbBβ对于烟曲霉的合适的无性生长发育都是必需的。flbB基因敲除将导致产孢的延迟和减少,细胞过早死亡,液体培养条件下分生孢子梗的发育缺如,改变brlA和abaA的表达,以及GT产生的缺失或减少[17]。在烟曲霉中,Northern blot分析显示,flbB和flbE对flbD基因的表达是必需的,但是flbB和flbE的表达相互之间无影响。此外,flbC的表达与flbB或flbE之间是独立的[17]。fluG基因的转录本水平在烟曲霉整个生命周期中是相对恒定的,而且fluG敲除株与野生株相比,在固体培养基上生长的形态相似,即产孢正常,但是液体培养时产孢缺失[11]。这说明FluG对烟曲霉在液体条件下的产孢过程发挥特殊的作用,而接触空气可能激活了其他产孢替代途径。
在构巢曲霉中,tmpA基因能够独立于fluG通路调控产孢,该基因可能参与了另一种不同的生长发育信号分子的合成[23]。tmpA基因敲除会导致brlA表达降低以及暴露于空气中的菌落产孢减少。如果将tmpA敲除菌接种于野生株或者fluG敲除菌的菌落旁边,即使菌丝之间不直接接触,tmpA敲除所导致的缺陷也能被弥补。这种现象表明,TmpA 和FluG通过不同的通路调控构巢曲霉的无性产孢[23]。但是,关于TmpA在烟曲霉中的同源蛋白的功能目前尚无研究报道。
cAMP⁃PKA信号转导通路在烟曲霉产孢和生长发育中也发挥着重要的作用,GpaA是G蛋白异源三聚体的一个α亚单位(Gα),它是FlbA (G蛋白信号通路的调节蛋白,RGS)的主要作用靶点,GpaA信号通路刺激烟曲霉的菌丝生长而抑制无性产孢[11]。在烟曲霉中,FlbA和GpaA组成了重要的G蛋白信号通路元件(Gα⁃RGS对),从而协调菌丝生长和无性发育两个生物学过程[11]。FlbA对于产孢并不是必需的,烟曲霉能够克服因缺少FlbA而引起的生长发育缺陷,但是它能促进合适的无性产孢进程和孢子色素合成[11]。GpaB是另一个基因编码的Gα,它在激活腺苷酸环化酶(AcyA)方面发挥作用,因此也能够调控烟曲霉的生长发育过程,gpaB敲除菌产孢减少[14]。Burghard Liebmann等[24]研究发现,PkaC1在GpaB的下游起作用。CpcB(交叉通路调节B)蛋白是Gpa1⁃cAMP信号通路中的一个典型的G蛋白异源三聚体β亚单位(Gβ),它能直接启动和推进产孢过程中brlA和abaA的适当表达,从而正调控孢子萌发、菌丝生长以及产孢结构形成等生物学过程,该过程可能是独立于GpaA和GpaB信号通路的[25⁃26]。
fluG和flbA(至少部分地)通过影响brlA的表达作用于产孢过程,但是它们对于激活brlA的表达或者产孢并不是必需的,有研究发现,它们的敲除菌株只是延迟了brlA转录本的峰值时间(从6 h 到12 h)[11]。在构巢曲霉中,FluG依赖的生长发育的启动开始于新合成的Zn(Ⅱ)2Cys6结构域蛋白SfgA的负性调控作用的去除[27]。然而,烟曲霉中是否存在SfgA的同源蛋白尚未可知。
3 总 结
根据在模式真菌构巢曲霉中取得的关于生长发育调控的丰富成果,以及众多研究者们基于此对烟曲霉中同源蛋白和其他相关蛋白的研究结果,我们总结了如图2所示的烟曲霉生长发育调控网络图(实线代表直接作用,虚线代表间接作用,问号代表机制尚不明确)。其中,FluG和BrlA在两株菌中均分别是产孢过程上下游调节通路的关键激活蛋白,brlA⁃abaA⁃wetA则是它们共同的下游中心调节通路[11]。而烟曲霉的上游调控机制较构巢曲霉更为复杂,它有多条途径可以激活brlA的表达,因此相对于构巢曲霉,烟曲霉的无性产孢有一些独特而有力的代偿方法。
目前,烟曲霉无性产孢基因调控的相关研究结果可谓硕果累累,但也有一些调节过程的具体机制尚不明确,还需要进一步的完善和整合。对于我们课题组发现的一株完全不能产孢的白色烟曲霉临床分离株的研究显示,该菌产孢产黑相关基因的表达量较标准株普遍下调,但是具体的上游调控机制还有待下一步的探究[7]。在这样的情况下,传统的研究方法已经略显局限,借助新兴生物技术如高通量测序等方法也许会有新的突破,从而找到合适的抑制孢子合成的靶点,早日实现从源头上控制烟曲霉感染的目标。
参考文献
[1] Latge JP.Aspergillus fumigatus and aspergillosis[J].Clin Micro⁃biol Rev,1999,12(2):310⁃350.
[2] Dagenais TR,Keller NP.Pathogenesis of Aspergillus fumigatus in invasive aspergillosis[J].Clin Microbiol Rev,2009,22(3):447⁃465.
[3] Maschmeyer G,Haas A,Cornely O.Invasive aspergillosis:epide⁃miology,diagnosis and management in immunocompromised pa⁃tients[J].Drugs,2007,67(11):1567⁃1601.
[4] Arendrup MC,O'Driscoll BR,Petersen E,et al.Acute pulmonary aspergillosis in immunocompetent subjects after exposure to bark chippings[J].Scand J Infect Dis,2006,38(10):945⁃949.
[5] Butler L,Brockley T,Denning D,et al.Acute Aspergillus pneumo⁃nia associated with mouldy tree bark⁃chippings,complicated by anti⁃glomerular basement membrane disease causing permanent renal failure[J].Med Mycol Case Rep,2013,2:125⁃127.
[6] Ratermann KL,Ereshefsky BJ,Fleishaker EL,et al.Fulminant in⁃vasive pulmonary aspergillosis after a near⁃drowning accident in an immunocompetent patient[J].Ann Pharmacother,2014,48 (9):1225⁃1229.
[7] Zhang C,Kong Q,Cai Z,et al.The newly nonsporulated charac⁃terization of an Aspergillus fumigatus isolate from an immunocom⁃petent patient and its clinic indication[J].Fungal genetics and biology,Mar 14,2015.pii:S1087⁃1845(15)00037⁃7.doi:10.1016/j.fgb.2015.03.001.
[8] O'Gorman CM,Fuller HT,Dyer PS.Discovery of a sexual cycle in the opportunistic fungal pathogen Aspergillus fumigatus[J].Nature,2009,457(7228):471⁃474.
[9] Yu JH.Regulation of Development in Aspergillus nidulans and As⁃pergillus fumigatus[J].Mycobiology,2010,38(4):229⁃237.
[10] 王端礼.医学真菌学———实验室检查指南[M].北京:人民卫生出版社,2005.
[11] Mah JH,Yu JH.Upstream and downstream regulation of asexual development in Aspergillus fumigatus[J].Eukaryot Cell,2006,5 (10):1585⁃1595.
[12] Adams TH,Boylan MT,Timberlake WE.brlA is necessary and sufficient to direct conidiophore development in Aspergillus nidu⁃lans[J].Cell,1988,54(3):353⁃362.
[13] Tao L,Yu JH.AbaA and WetA govern distinct stages of Aspergil⁃lus fumigatus development[J].Microbiology,2011,157(Pt 2):313⁃326.
[14] Liebmann B,Gattung S,Jahn B,et al.cAMP signaling in Asper⁃gillus fumigatus is involved in the regulation of the virulence gene pksP and in defense against killing by macrophages[J].Mol Genet Genomics,2003,269(3):420⁃435.
[15] Kwon NJ,Shin KS,Yu JH.Characterization of the developmental regulator FlbE in Aspergillus fumigatus and Aspergillus nidulans [J].Fungal Genet Biol,2010,47(12):981⁃993.
[16] Andrianopoulos A,Timberlake WE.The Aspergillus nidulans abaA gene encodes a transcriptional activator that acts as a ge⁃netic switch to control development[J].Mol Cell Biol,1994,14 (4):2503⁃2515.
[17] Xiao P,Shin KS,Wang T,Yu JH.Aspergillus fumigatus flbB en⁃codes two basic leucine zipper domain(bZIP)proteins required for proper asexual development and gliotoxin production[J].Eu⁃karyot Cell,2010,9(11):1711⁃1723.
[18] Alkhayyat F,Chang Kim S,Yu JH.Genetic control of asexual de⁃velopment in Aspergillus fumigatus[J].Adv Appl Microbiol.2015,90:93⁃107.
[19] Ni M,Yu JH.A novel regulator couples sporogenesis and treha⁃lose biogenesis in Aspergillus nidulans[J].PLoS One,2007,2 (10):e970.
[20] Park HS,Bayram O,Braus GH,et al.Characterization of the vel⁃vet regulators in Aspergillus fumigatus[J].Mol Microbiol,2012,86(4):937⁃953.
[21] Bayram O,Krappmann S,Ni M,et al.VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism[J].Science,2008,320(5882):1504⁃1506.
[22] Park HS,Ni M,Jeong KC,et al.The role,interaction and regula⁃tion of the velvet regulator VelB in Aspergillus nidulans[J].PLoS One,2012,7(9):e45935.
[23] Soid⁃Raggi G,Sanchez O,Aguirre J.TmpA,a member of a novel family of putative membrane flavoproteins,regulates asexual de⁃velopment in Aspergillus nidulans[J].Mol Microbiol,2006,59 (3):854⁃869.
[24] Liebmann B,Muller M,Braun A,et al.The cyclic AMP⁃depend⁃ent protein kinase a network regulates development and viru⁃lence in Aspergillus fumigatus[J].Infect Immun,2004,72(9):5193⁃5203.
[25] Kong Q,Wang L,Liu Z,et al.Gbeta⁃like CpcB plays a crucial role for growth and development of Aspergillus nidulans and As⁃pergillus fumigatus[J].PloS One,2013,8(7):e70355.
[26] 刘增然,张光一,YU Jae⁃Hyuk.致病菌烟曲霉新基因Afu4g13170生孢致毒相关性初步研究[J].微生物学通报,2012,39(1):68⁃74.
[27] Yu JH,Mah JH,Seo JA.Growth and developmental control in the model and pathogenic aspergilli[J].Eukaryotic Cell,2006,5 (10):1577⁃1584.
[本文编辑] 顾菊林
·论著·Genetic regulation of conidiation in Aspergillus fumigatus:an updateSANG Hong,ZHANG Cai⁃yun
(Department of Dermatology,Jinling Hospital,School of Medicine,Nanjing University,Nanjing 210002)
【Abstract】Aspergillus fumigatus is one of the most important human pathogen,causing invasive aspergillosis by releasing numer⁃ous asexual spores(conidia).Conidia can grow on almost every microbiological culture medium under various environmental condi⁃tions.In this paper,the recent research progress in the genetic regulatory system which dictates conidiation in Aspergillus fumigatus was discussed.
【Key words】Aspergillus fumigatus;asexual development;genetic regulation
[收稿日期]2015⁃06⁃29
【文章编号】1673⁃3827(2015)10⁃0257⁃04
【文献标识码】A
【中图分类号】R 379.6
作者简介:桑红,女(汉族),博士,主任医师.E⁃mail:shzwqzsl@163.com

