花生热激蛋白AhHSP70与热激因子AhHSF基因的克隆及表达分析
李翠+侯蕾+任丽+张烨+郑奕雄+王兴军


摘要:热激蛋白(heat shock proteins,HSPs)和热激转录因子(heat shock factors.HSFs)在植物热胁迫信号转导和耐热性的产生过程中发挥了重要作用。本研究从花生转录组文库中筛选到HSP70、HSF的eDNA片段,通过序列比对在花生全基因组序列中获得这两个基因的基因组序列,根据序列信息设计引物,以花生叶片eDNA为模板扩增全长ORF并进行生物信息学分析结果显示,AhHSP70基因的ORF全为1 962 bp,编码653个氨基酸,分子质量为72.45 kD,理论等电点pl为4.93;AhHSF基因的ORF全长为1 212 bp,编码403个氨基酸,分子质量为46.03 kD,理论等电点pl为4.85。AhHSP70与AhHSF均不具有信号肽,为可溶性蛋白,二级结构中有大量无规则卷曲。利用这两个基因的氨基酸序列分别与来源于其他物种HSP70、HSF的氨基酸序列进行同源比对,并构建进化树进行亲缘关系分析,结果表明,AhHSP70与大豆GmHSP70亲缘关系较近,与番茄SlHSP70亲缘关系比较远;AhHSF与菜豆PaHSF亲缘关系较近,而与蒺藜苜蓿MtHSF的亲缘关系较远。利用实时荧光定量PCR对AhHSP70和AhHSF在热胁迫情况下的表达进行分析,结果表明这两个基因在42℃高温条件下表达量显著升高,AhHSP70在高温胁迫3 h后表达明显升高,热处理24 h和48 h后,表达量为对照的 50倍和135倍;转录因子AhHSP在高温胁迫3 h后表达明显升高,高温处理6 h后达到最高,随后下降。本研究初步验证了花生热激蛋白和热激因子基因在花生响应高温胁迫中的作用。
关键词:花生;热激蛋白;热激因子;基因克隆;序列分析;基因表达
中图分类号:S565.203.2 文献标识号:A 文章编号:1001-4942(2015)04-0001-07
收稿日期:2015-01-30
基金项目:国家自然科学基金项目(21376281);国家“863”计划项目(2013AA102602);山东省生物资源创新项目;济南市科技创新项目(20l102033);山东省自主创新成果转化专项(2012ZHZXIA0418)
热激蛋白(heat shock proteins,HSPs)是一类进化保守的多肽,在机体受到高低温、干旱、盐渍、缺氧、机械损伤等多种环境胁迫时诱导合成[1],其中高温足诱导HSPs合成的主要因素[2],故又称应激蛋白或热休克蛋白。HSPs作为一种分子伴侣,能够及时将受热损伤的蛋白聚集,协助其肽链的折叠,促使其复性从而恢复体内正常蛋白的功能[3]。张建国等[4]研究发现,HSPs的积累水平与生物的耐热性呈显著正相关。热激因子(heat shock factors,HSFs)是生物体内调节热激应答的一类转录因子,主要存在于细胞核内,能激活或抑制基因的转录,在植物热胁迫信号转导和耐热性的产生过程中发挥了重要的作用[5]。
HSPs作为一类逆境胁迫蛋白,可以被多种逆境所诱导,并能够减轻胁迫引起的伤害,Lurie等[6]还发现HSPs蛋白具有交叉保护的功能。Tissieres等[7]首次在黑腹果蝇中发现热激蛋白HSPs,随后发现动物、植物、微生物都能合成HSPs。在生物体内热激蛋白有多种形式,例如泛索(ubiquitin)是一类组成型表达的热激蛋白,蛋白质二硫键异构酶(protein disulphide - isomerase,PID))也被认为是一种热激蛋白[8]。根据分子量大小的不同,可将HSPs分为5个家族,即HSP110、HSP90、HSP70、HSP60和小分子HSP[9]。其中HSP90具有调节作用,可作用于激素受体,保证受体呈无活性状态[10]。HSP70是HSPs家族中最为保守也是最重要的一类蛋白[11],是目前研究最深入的一类蛋白,在依赖ATP的蛋白质折叠和装配中起作用。HSP70结构包括N端ATPase结合区以及C端多肽结合区,N端序列高度保守,具有结合并水解ATP的活性[12,13]。HSP60最早被称为分子伴侣,线粒体HSP60主要参与了核编码的线粒体蛋白质的加工、定位和装配,小分子HSP在热激及其恢复时,在细胞质、细胞核以及细胞器之间运动,保护细胞免受高温伤害,修补被损伤的蛋白。小分子热激蛋白N端序列在不同物种中差异较大,C端则高度保守[14]。植物热激蛋白可以在不同的器官中被诱导,可在根、茎、叶、种子以及幼苗中产生,也可在体外单个细胞中产生,此外,它们也可定位于不同的细胞器中。
典型的热激转录因子结构包括N端的DNA结合域(DBD)、寡聚化结构域(OD)、核定位信号(NLS)、核输出信号(NES)和C端转录激活结构域。植物热激转录因子可通过形成回文发卡结构,特异结合热激蛋白基因启动子中高度保守的热激元件,控制热激蛋白基因的表达[4]。如热胁迫条件下,拟南芥中的HSF可调节HSP110、HSP70和小分子HSP的表达[15]。根据表达特性不同,热激转录因子可分为组成型和诱导型两种,一般参与胁迫应答的主要是诱导型热激转录因子。最早的热激转录因子是在酵母中被克隆得到的,随后在果蝇和哺乳动物中发现并克隆[17]。在植物中,道德是在番茄中克隆[18],目前在拟南芥、水稻、玉米、大豆等植物中均开始了对该基因家族的研究[16,19,20]。
本试验从花生叶片中克隆了AhHSP70和AhHSF的全长编码序列,分别对其进行生物信息学分析,并利用实时定量PCR技术在mRNA水平检测了高温胁迫对花生AhHSP70和AhHSF表达的影响,了解热激蛋白在花生抗逆胁迫中的作用,为探讨花生响应高温的分子机理、选育耐高温的花生新品种奠定基础。
1 材料与方法
1.1 材料与试剂
供试材料为花生耐旱品种仲恺花1号,由仲恺农业工程学院种子科学与工程研究所提供。大肠杆菌(Escherichia coli)菌种DH5α为山东省农业科学院生物技术研究中心保存。琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司;T4 DNA连接酶、Tap DNA聚合酶购自Fermentas公司;pMD18-T载体、反转录试剂盒、DNA酶、实时荧光定量PCR试剂盒FastStart Universal SYBR Green Master(Rox)购自罗氏试剂公司,LA Taq DNA聚合酶购自宝生物工程(大连)有限公司。PCR引物合成由上海生工生物工程股份有限公司完成。endprint
1.2 试验方法
1.2.1 42℃高温处理 将仲恺花1号在温室中培养,待其幼苗长出2周左右,选取18株长势基本一致的花生幼苗,每3株作为一个重复,进行42℃持续高温处理,分别于处理0、3、6、12、24、48 h对叶片进行取样,迅速置于液氮并于-80℃保存备用。
1.2.2 总RNA的提取与eDNA的合成 高温处理不同时间的花生叶片总RNA的提取采用CTAB-LiCl法,用CTAB提取液裂解研磨好的植物组织,氯仿/饱和酚抽提,去除蛋白质等杂质,LiCl、无水乙醇沉淀RNA,随后进行DNA消化,获得总RNA。用紫外可见分光光度计测定RNA的浓度,上样2 μg琼脂糖凝胶电泳检测所提取的RNA,在Alpha Imager PE型凝胶成像系统上观察拍照。按照TaKaRa反转录试剂盒(PrimeScriptTM Ⅱ 1st Strand eDNA Synthesis Kit)说明进行反转录获得eDNA。
1.2.3 AhHSP70和AhHSF基因eDNA全长序列的克隆 从花生转录组序列中筛选到HSP70和HSF基因的eDNA片段,通过同源查找花生全基因组序列(未发表数据)获得两个基因的基因组序列,根据基因组序列中预测的编码区设计引物,以花生叶片eDNA为模板克隆两个基因的ORF全长,分别命名为AhHSP70和AhHSF。
PCR扩增基因全长的反应体系(50 μl):1 μL的eDNA模板,5 U/μL Pfu高保真DNA聚合酶0.5 μL,5×Buffer 5 μl,2.5 mmol/L dNTP 4 μL,正反向引物各2 μL以及ddH2O 35.5μL。
PCR反应程序:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸2 min,35个循环;72℃延伸10 min,保存温度为4℃。
反应结束后进行1%琼脂糖凝胶电泳,目的片段回收纯化后平末端加A,加A产物与pMD18-T载体连接,转入DH5α大肠杆菌感受态细胞,后经菌液PCR检测,挑取含有目的片段的菌液在山东省农业科学院生物技术中心测序中心进行测序,得到HSP70和HSF的ORF序列。所使用的引物序列见表1。
1.2.4 AhHSP70和AhHSF序列的生物信息学分析 利用DNAStar软件将测得的序列翻译成氨基酸序列,用DNAMAN软件分析其氨基酸序列的二级结构、亲水性/疏水性以及跨膜结构;用MEGA5.0软件分别对其氨基酸构建进化树,进行进化分析;在线软件Protparatam工具(http://web.expasy.org/protparam/)分析其理化性质;在线工具PSORT(http://psort.nibb.ae.jp/form.html)预测其亚细胞定位;Signal P 3.0在线软件预测其信号肽;SMART和InterPro在线软件对蛋白质结构域进行分析预测.
1.2.5 AhHSP70和AhHSF基因的表达分析 利用qRT-PCR分析花生经过高温处理O、3、6、l2、24、48 h后基因的表达。以组成型表达的花生Actin基因作为内参,实时定量PCR引物为AhHSP70realF、AhHSP70realR和AhHSFrealF、AhHSFrealR(表1)。采用FastStart Universal SYBR Green Master(Rox)按说明书进行操作。用ABI PRISM 7900HT实时定量PCR仪进行反应,反应程序为:95℃预变性10 s;95℃ 15 s,60℃ 1 min,40个循环;溶解曲线分析:95℃ 15 s,60℃ 1 min,95℃ 30 s,60℃ 15 s。重复试验3次。根据溶解曲线检测PCR产物的特异性。基因表达差异通过2-△△CT方法计算。
2 结果与分析
2.1 AhHSP70和AhHSF基因克隆及进化树分析
以花生叶片eDNA为模板扩增AhHSP70和AhHSF开放读码框,扩增产物经1%琼脂糖凝胶电泳分析。由图可见,扩增条带的长度分别为2 000 bp和1 500 bp左右。同收目的片段末端加A后与pMD18-T载体连接,转化大肠杆菌DH5α,选取阳性菌落进行测序,经正反向拼接,AhHSP70基因的全长ORF为1 962 bp,编码含653个氨基酸的肽链;AhHSF基因的全长ORF为1 212 bp,编码含403个氨基酸的肽链。
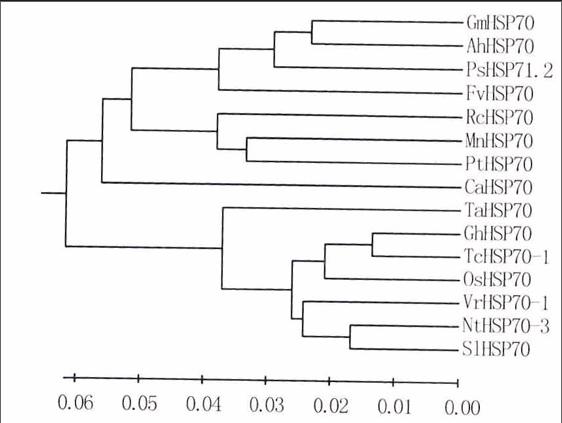
从GenBank获得大豆、水稻、豌豆等植物的热激蛋白HSP70和HSF序列,利用DNAMAN软件分别对不同植物来源的HSP70和HSF进行同源性分析,并利用MEGA5.0软件构建进化树(图2a、b)。结果表明,AhHSP70与大豆和豌豆的HSP70亲缘关系较近,处于同—分支,而与小麦、棉花、番茄等的HSP70亲缘关系较远;AhHSF与菜豆和紫苜蓿的HSF亲缘关系比较近,而与蒺藜苜蓿和大豆等的HSF亲缘关系较远
2.2 AhHSP70和AhHSF蛋白的理化性质、细胞定位分析
使用Protparatam在线工具分析AhHSP70和AhHSF蛋白的理化性质,结果显示AhHSP70蛋白的分子质量为71.45 kD,理论等电点pI为4.93。在氨基酸构成中,相对含量较多的是Ala、Glu、Gly和Lys,分别占9.2%、8.6%、8.90%和8.3%。总的带负电荷的残基(Asp+Glu)有102个,带正电荷的残基(Arg+Lys)有86个。AhHSF分子质量为46.03 kD,理论等电点pI为4.85。在氨基酸构成中,含量较多的是Ser、Glu、Leu和Asp,分别占12.2%、9.7%、7.7%和6.7%。总的带负电荷的残基(Asp+Glu)有66个,带正电倚的残基(Arg+Lys)有40个。
通过DNAMAN软件分别对AhHSP70、AhHSF两个蛋白序列疏水性/亲水性以及它们的跨膜结构域进行预测和分析,结果表明,AhHSP70与AhHSF肽链中亲水氨基酸分布都比较均匀,并且数量大于疏水氨基酸(图3),且两者均不含跨膜结构域。可以推断AhHSP70和AhHSF均为可溶性蛋白。endprint
亚细胞定位预测结果显示,AhHSP70和AhHSF蛋白在细胞核定位的概率均可达0.76,因此,推测AhHSP70和AhHSF定位于细胞核的可能性比较大。运用Signal P 3.0在线软件对AhHSP70和AhHSF蛋白序列信号肽进行预测分析,结果显示这两个蛋白均无信号肽。
2.3 AhHSP70和AhHSF二级结构和蛋白结构域的预测及分析
用DNAMAN软件对花生AhHSP70和AhHSF蛋白序列的二级结构进行预测 结果显示,AhHSP70和AhHSF蛋白序列中,均有α-螺旋、无则卷曲、β-折叠三种二级结构,其中无规则卷曲是AhHSP70和AhHSF蛋白中最大量的二级结构,α-螺旋和β-折叠分布于整个蛋白质分子中。通过SMART和InterPro工具在线软件预测分析表明,AhHSP70蛋白C端391~548 aa处为底物结合位点区域.637~646 aa处是一段低复杂性区段(Lowe-complexity region,LCR)。AhHSF蛋白质结构中,N端10~103 aa处具有典型的DBD结构域,内部存在一个螺旋-转角-螺旋的疏水结构,该疏水结构可以精确定位并识别启动子区热激元件(HSE),在HSP基因转录时DBD区域可与HSE结合,从而调控热激蛋白基因的表达[21]。C端有一段保守的的卷曲螺旋区域(coiled coil region)以及LCR。
2.4 AhHSP70和AhHSF基因的表达分析
实时荧光定量PCR分析结果表明,花生在42℃高温胁迫条件下,AhHSP70和AhHSF两个基因表达量均显著增加。基中AhHSP70高温处理3 h时表达量开始升高,24 h时表达量大幅度升高,48 h后仍继续升高,表达量达到处理前的135倍,说明AhHSP70在高温胁迫下表达显著升高,响应热胁迫长时间诱导。AhHSF在高温胁迫3 h表达显著升高,在高温胁迫6 h表达量达到最高,为处理前的624倍,随后下降,但到48 h表达量仍高达处理前的23倍(图4)。
3 讨论
植物在生长发育过程中会受到各种逆境胁迫的影响,体内会产生一系列复杂的防御机制来进行自我保护,如在高温等胁迫条件下,生物体内热激蛋白合成发生变化,降低生物体在胁迫中受到的伤害,是一种有效的防御措施。目前已有很多植物的热激蛋白和热激转录因子基因被克隆,并研究了它们在植物抵御逆境胁迫中的作用。
本研究利用花生转录组和全基因组序列结果,从花生叶片中克隆获得AhHSP70和AhHSF的完整ORF,通过氨基酸序列同源性比对分析表明,AhHSP70与豆科植物大豆GmHSP70亲缘关系较近,AhHSF与豆科植物菜豆PaHSF序列相似性较高。亚细胞定位分析显示高温处理情况下AhHSP70和AhHSF主要定位于细胞核中,推测热激蛋白AjHSP70可能参与核内蛋白质的转运、折叠及解折叠的作用,而热胁迫条件下热激转录因子AhHSF进入细胞核从而调控下游基因表达对AhHSP70和AhHSF蛋白结构域的预测分析表明,AhHSP70 C端具有底物结合位点,可能参与蛋白质的折叠、转运、跨膜运输以及蛋白质降解调控等过程,与行使分子伴侣的功能有关;AhHSF蛋白结构的N端具有DNA结合区域,与调控下游基因的转录有关。
HSPs作为一种分子伴侣型的应激蛋白,能够对外界环境刺激做出应答反应,减少高温对生物体的伤害,有效地提高生物体对恶劣环境的适应能力[22,23]。此外,HSPs能够提高细胞的应激能力,具有保护细胞或机体免受损伤的作用。近年来的研究表明,除高温之外,其他环境胁迫如干旱、低温等也会诱导HSPs的产生。另外,正常情况下生物体内也会有HSPs的存在。本研究利用qRT-PCR对AhHSP70和AhHSF基因的表达分析显示,在受到42℃热胁迫条件下花生叶片中AhHSP70在3 h表达量开始升高,24 h以后表达量持续大幅度升高。大豆中的研究结果显示,热处理3~5 min就可以检测到大豆幼苗中热激蛋白mRNA的积累,l~2 h达到高峰,6 h后mRNA水平显著下降,12 h表达量几乎为零[24]。拟南芥中对HSP70家族多个基因表达分析的结果显示,除了mtHsc70-1(属于拟南芥中线粒体HSP70家族)和cpHsc70-1(属于拟南芥中叶绿体HSP70家族)两个基因,其他基因在40℃热处理后表达上调,多数基因在处理30 min表达量就上升到最大,之后缓慢下降,如HSP70-2基因,少数基因在60 min时表达量最高,之后下降,如HSP70基因[25]。玉米中也有类似的情况.热激蛋白的诱导合成只持续4 h,随后下降。而本试验中,AhHSP70在高温处理48 h仍持续高表达,且受诱导时间周期延长。因此,热激蛋白在不同植物体内的表达模式有所差异,花生中AhHSP70可能在持续高温下对调控植物的生长起到重要作用。对热激因子的表达在植物中也有研究,其响应热激胁迫的周期普遍较短。陈先知等[26]发现对一黄瓜进行2 h热处理后,全基因组中的热激转录因子表达水平存在很大差异,大部分转录因子表达量显著上升。拟南芥中AtHsfA2在正常条件下基本检测不到表达,37℃热处理0.5 h到1 h表达量最高,随后明显降低,处理12 h表达量降低为零[6]。本试验中,AhHSF在高温胁迫3 h时表达量显著升高,到6 h时达到最高,随后表达量显著下降,可能是由于在高温初期,AhHSF的表达上调激活下游相关热激蛋白的表达,随着热处理时间延长,热激蛋白的高表达可能会对其表达具有抑制作用,因此,表达量有所下降.这与宫本贺等[27]在麝香百合中的研究结果相似,但麝香百合热激转录因子表达量下降后又出现上升趋势,可以看出AhHSF在不同植物中表达模式也是有差异的根据以上结果推测AhHSF在花生感受高温胁迫的初期行使调控作用,表明AhHSF是一个受高温诱导且在高温环境中起调节作用的热激转录因子。
4 结论
本研究克隆到花生热激蛋白AhHSP70和热激因子AhHSF的基因全长ORF,通过实时荧光定量PCR分析高温处理不同时间AhHSP70与AhHSF的表达,结果显示,AhHSP70对热刺激初期不敏感,长时间高温诱导后上调剧烈;在高温条件下AhHSF表达水平快速上调,随后快速下调。该结果为进一步研究热激蛋白与转录因子的基因功能奠定了基础,为阐明其在花生适应逆境胁迫的作用机理具有重要作用。endprint

