燃煤催化剂对煤炭燃烧性能的影响
曹丽琼(山西大学资源与环境工程研究所,山西 太原 030006)
我国是世界上产煤和烧煤最多的国家,原煤产量10亿多吨,占能源总产量的70%以上,以煤为主的能源结构在一个较长的时期内不会发生变化。在煤的燃烧利用中存在两大问题:一是煤炭燃烧不充分,煤耗大,热效率低,煤炭资源严重浪费;二是在煤燃烧过程中产生大量烟尘、二氧化硫、一氧化碳等有害气体物质,污染大气。因此,发展“洁净煤技术”提高煤炭的资源利用率对国家长期发展战略具有重要的意义。提高煤炭的资源利用率,传统的方法是改进设备和操作工艺,投资巨大,工艺复杂,无法从根本上克服出渣量大,可燃物含量高,煤炭资源浪费严重等缺点,实现这个目标的另一有效措施是使用燃煤催化剂,它不仅可以提高煤的挥发分析出速率,降低煤的着火温度,缩短点火延迟时间,加快碳的燃尽速率,并具有脱硫脱氮的作用。加入催化剂后,锅炉燃烧趋于完全,煤耗量降低,汽煤比相对提高,改善锅炉燃烧工况,提高了锅炉热效率,还可以强化高灰劣质煤的燃烧利用,降低污染物的排放,而且在钢铁工业用炉(如高炉喷吹煤粉)上也适用,因此具有较强的经济适用性,具有巨大的经济效益和环境效益。常见的燃煤催化剂有:碱金属、碱土金属和过渡元素的氧化物、氢氧化物及其盐类,除此之外,几种常见的生活垃圾和工业废弃物如煤灰、草木灰、造纸黑液、碱厂废液、铁矿石粉等也可用作燃煤催化剂,促进煤炭的燃烧。本文在添加氧化剂KMnO4(在加热条件下KMnO4会分解释放出氧气,增大了煤炭的孔隙率,使煤炭粒子能够与空气中的氧气充分接触,提高了煤炭中挥发份的析出速率,从而促进了煤炭的燃烧,起到助燃的作用)的基础上,把不同量的钢铁厂的废渣(约含20%左右的Fe2O3和少量的V2O5)添加到煤块中,探讨其对煤炭燃烧的催化作用以及对煤炭燃烧过程中硫释放的影响。
1 实验部分
1.1 实验原料、仪器
原煤:实验所用的煤为挥发份较高的烟煤,取自山西省阳泉烟煤,其工业分析,已在山西煤化所做了工业分析。
仪器:多用热量测定仪(型号:CT5000A)、微机汉显快速测硫仪(型号:WDL-9)、马弗炉(型号:CTM300)
试剂:KMnO4(试剂)、Fe2O3废渣(太原钢铁集团)、纯Fe2O3
1.2 实验流程及方法
先对原煤进行筛分,选用筛下煤样,粒径为3mm以下;称取300g该煤样,与一定量的燃煤催化剂机械混合,再称量30g/份,并在压力为20MP下压制成煤块,后将煤块置于105℃烘箱中烘干1.5h,密封保存(排除水分的影响)备用;将制备好的煤块放入马弗炉,从室温开始逐渐升温;记录煤块表面开始变红时的温度,记录煤块形成火焰时的温度;
1.2.1 煤块着火后,调温至560℃,分别燃烧 0.5h、1h、1.5h、2h、2.5h;
1.2.2 燃烧结束后,取出煤块,冷却到室温,称量渣重,测试渣中的含硫量和残余的热值,计算燃烧不同时间下的烧失率、热值释放率(热值消耗量/原煤快热值)和硫释放率(硫释放量/原煤块含硫量);
其中:
烧失率(%)=(M0-M1)/M0·100%
式中:M0——起始煤重,g;
M1——燃烧后煤重,g.
热值释放率(%)=(M0·C0-M1·C1)/M0·C0·100%
式中:C0——燃烧前煤中所含热值,Cal/g;
C1——燃烧后渣中所含热值,Cal/g.
硫释放率(%)=(M0·S0-M1·S1)/M0·S0·100%
式中:S0——燃烧前煤中含硫量,%;
S1——燃烧后渣中含硫量,%.
2 结果与讨论
2.1 原煤的工业分析结果

表1 原煤的工业分析结果
2.2 Fe2O3的催化作用
研究Fe2O3废渣的催化燃烧效果的实验:第一组为原煤,第二组只添加了1%KMnO4,第三组添加了1%KMnO4和0.4%Fe2O3废渣。对原煤、添加1%KMnO4、添加1%KMnO4和0.4%Fe2O3废渣的煤块做不同燃烧时间的燃烧试验,实验数据绘得的烧失率和热值释放率随时间的变化曲线如下图1和图2所示。
由图1、图2可知,在不加入任何添加剂的情况下,燃烧不同时间(0.5h、1.0h、1.5h、2.0h、
2.5 h)后渣中的热值分别为3737 cal/g、3539cal/g、3116 cal/g、2754 cal/g、2389cal/g,其热值释放率分别为26.76%、36.07%、47.19%、55.13%、63.84%,可见,煤块的燃烧不充分,渣中仍含有大量的热值有待于利用。添加了KMnO4以及同时添加KMnO4和Fe2O3的煤块燃烧情况和原煤相比,烧失率和热值释放率都有明显的提高,均优于原煤的燃烧,而且添加了催化剂Fe2O3废渣的煤的烧失率和热值释放率又要明显高于单添加氧化剂的煤的燃烧,可见氧化铁在煤炭燃烧的过程中可以起到明显的催化助燃作用。

图1 烧失率随燃烧时间的变化趋势

图2 热值释放率随燃烧时间的变化趋势
2.3 不同量的Fe2O3对煤炭燃烧的催化作用
研究不同量的Fe2O3废渣的催化燃烧效果的实验:第一组为原煤,第二组添加了1%KMnO4和0.2%)Fe2O3废渣,第三组添加了1%KMnO4和0.4%Fe2O3废渣,第四组添加了1%KMnO4和1.0%Fe2O3废渣。分别进行不同燃烧时间的燃烧试验,实验数据绘得的烧失率和热值释放率随时间的变化曲线如下图3和图4所示。
由图3图4可知,添加了氧化铁的煤块燃烧的烧失率和热值释放率要明显高于原煤,烧失率提高了大约31%,热值释放率提高了大约21%,可见氧化铁对煤炭的燃烧具有明显的催化作用;但提高氧化铁废渣的添加量对煤炭的燃烧性能基本没有影响,烧失率和热值释放率曲线交替上升,没有明显的趋势,因为氧化铁废渣中含有其他杂质,这些杂质不具有热值,过量添加必定会影响煤炭的燃烧,同时煤粒有可能被杂质包裹使得氧气无法直接与煤粒接触燃烧,也阻碍了燃烧后生成气体的释放,最终导致煤炭的燃烧效率降低,所以添加剂的加入量要适量而且要少量。
2.4 Fe2O3在煤燃烧过程中对硫释放的影响
研究Fe2O3在煤燃烧过程中对硫释放影响的实验:第一组为原煤,第二组添加了1%(3.0g)KMnO4,第三组添加了1%(3.0g)KMnO4、1%(3.0g)Fe2O3。分别进行不同燃烧时间的燃烧试验,实验数据绘得的硫释放率随时间的变化曲线如下图5所示:

图3 烧失率随燃烧时间的变化趋势

图4 热值释放率随燃烧时间的变化趋势

图5 硫释放率随燃烧时间的变化趋势
由上图可知,同时添加氧化剂和催化剂与只添加氧化剂对煤炭的燃烧影响相比,提高了硫的释放率,提高了大约16.6%,与原煤相比提高了大约64.8%,因为他们在促进煤炭燃烧的同时也促进了硫的释放,因此要想起到固硫效果,需在加入催化剂的同时加入固硫剂成分(如MgO、CaO等)。
2.5 Fe2O3废渣和纯氧化铁对煤炭催化作用的比较
比较Fe2O3废渣和纯氧化铁对煤炭燃烧催化作用的实验:第一组添加了1%(3.0g)KMnO4和1%(3.0g)Fe2O3废渣,第二组添加了1%(3.0g)KMnO4和1%(3.0g)纯Fe2O3。分别进行不同燃烧时间的燃烧试验,实验数据绘得的烧失率和热值释放率随时间的变化曲线如下图6和图7所示。
由图6图7可知,添加了Fe2O3废渣的煤炭烧失率和热值释放率整体趋势要好于添加纯的Fe2O3,说明Fe2O3废渣的催化燃烧效果要略好于纯的Fe2O3,分析其原因可能是由于实验选择的Fe2O3废渣为工业废渣,其成分中除了含有大约20%的Fe2O3之外,还主要含有一些碱土金属和过度金属,如矾、铜、铬等,这些金属大都以金属氧化物的形式存在,这些成分都是可以作为催化煤炭燃烧的良好催化剂,并且其催化活性都要大于金属铁,所以氧化铁废渣是一种很好的燃煤催化剂。
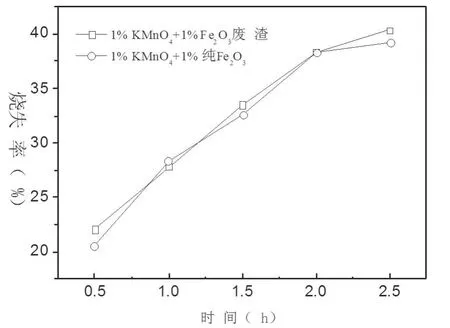
图6 烧失率随燃烧时间的变化趋势

图7 热值释放率随燃烧时间的变化趋势
2.6 燃烧机理分析
对碱金属、碱土金属和过渡元素的氧化物、氢氧化物及其盐类的燃煤催化作用,目前已有的研究结果可以归结为两种观点,即氧传递学说和电子转移学说。
氧传递学说认为:在加热条件下催化剂首先被还原成金属(或低价金属氧化物),然后依靠金属(或低价金属氧化物)吸附氧气,使金属(或低价金属氧化物)氧化得到金属氧化物(或高价金属氧化物),紧接着碳再次还原金属氧化物(或高价金属氧化物),就这样金属(或低价金属氧化物)一直处于氧化——还原循环中,在金属(或低价金属氧化物)和氧化物(或高价金属氧化物)两种状态来回变动。从宏观上,氧原子不断从金属(或低价金属氧化物)向碳原子传递,加快氧气扩散速度,使煤燃烧反应易于进行。
电子转移学说认为:催化剂中的金属离子在加热过程中能够被活化,从而其自身的电子发生转移,成为电子给予体。结果,金属离子将形成空穴,而碳表面的电子构型也将发生变化,这种电荷的迁移将加速某些反应,从而提高了整个反应的速度,使碳燃烧得更完全。
3 结论
3.1 在煤炭中添加燃煤催化剂Fe2O3废渣可以促进煤炭的燃烧,提高煤炭的燃尽率,在燃烧的整个过程中都有明显的催化作用。
3.2 催化剂量的加入应该适量并且少量。
3.3 催化剂Fe2O3废渣在促进煤炭燃烧的同时也促进了煤炭中硫的释放,因此还应添加适量的固硫剂(如MgO、CaO等)成分。
3.4 Fe2O3废渣是一种很好的燃煤催化剂,其对煤炭燃烧的催化效果要好于纯的Fe2O3。
[1]李华,林器.碱金属、碱土金属和过渡金属对煤的催化氧化作用.大连理工夫学学报,1989,29(3):289-294.
[2]蒋军衍,张鹤声.煤的催化燃烧.能源技术,1993,(3):30-33.
[3]陈海峰,沙兴中.催化剂对煤着火特性的影响Ⅲ.关于氧分压,高灰煤及添加纸浆黑液影响的研究.燃料化学学报,1993,21(3):288-292.
[4]徐万仁.催化剂对煤粉燃烧特性的影响.燃料化学学报,1995,23(3):272-277.
[5]陈海峰,沙兴中,徐依青等,燃料化学学报,1993,21(2):180.

