构树叶中黄酮提取分离工艺的优化
楚芳冰,吴小燕,丁来欣
(1.北京林业大学材料学院,北京 100083;2.北京林业大学理学院,北京 100083)
构树[Broussonetia papyrifera(L.)Vetn.]原名楮,为灌木类桑科植物,其叶、茎、根、皮、果实均可入药,在中国历版药典中均有收藏[1]。构树耐瘠薄、干冷、湿热,根系发达生长迅速,适应于各种类型的土壤,病虫害少,在我国分布广、资源丰富。构树除了有药用价值外,其果实营养丰富可以做果醋[2],种子含有大量不饱和脂肪酸,可开发利用[3];构树叶亦称为楮桃叶,蛋白质含量高,经提取纯化后能广泛用于食品加工,但目前只有少量用于猪饲料[4-5]。
构树叶性甘、凉,治疗吐血、外伤出血、水肿、痢疾、癣疮等[1],近代药理研究证明构树叶具有抗菌抑菌、降血脂、降血压、抗氧化、抑制肿瘤的作用,可保护肝脏,防治心血管疾病、治疗皮肤病等[6-9]。目前,对构树的化学成分研究发现其中含有大量黄酮类物质,是主要活性成分[10-13],其中构树叶中黄酮类物质含量较高,主要有牡荆素、大波斯菊、槲皮素、芹菜素、木犀草素、甘草素等[10-11,14],极具开发价值。但目前对构树叶中黄酮物质的提取工艺研究较少[15-16],对提取物进行纯化的工艺研究极少,对构树叶中黄酮的含量测定结果各不相同[7,17-18],因此研究有效提取并分离纯化构树叶中的黄酮物质,充分利用这一廉价易得的天然资源,对于开发构树叶在医药和保健品方面的应用有重要意义。该研究采用超声波辅助溶剂法提取构树叶中的黄酮,用单因素试验和正交试验法优化提取工艺,采用萃取法分离纯化提取物,以期为有效地开发利用构树叶中黄酮提供试验依据。
1 材料与方法
1.1 材料 构树[Broussonetia papyrifera(L.)Vetn.]叶,于2013年9月底采于北京市海淀区,在室内自然干燥至恒重后,于冰箱冷冻层保存备用。
1.2 试剂 芦丁对照品(国药集团化学试剂有限公司);95%乙醇、石油醚、盐酸、乙酸乙酯、亚硝酸钠、硝酸铝、氢氧化钠,上述试剂均为国产分析纯。
1.3 仪器与设备 SPECORD 210PLU8紫外可见分光光度计(德国耶拿);RE-200型旋转蒸发仪(上海凯美特功能陶瓷公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);FA2004B电子天平(上海越平科学仪器有限公司);FW100高速万能粉碎机(天津泰斯特仪器有限公司)。
1.4 方法
1.4.1 对照品溶液的制备和标准曲线制作。准确称取芦丁对照品0.020 8 g,用60%乙醇完全溶解后转入100 ml容量瓶中,用60%乙醇定容,配成0.208 mg/ml的芦丁标准溶液。分别吸取芦丁标准液 0、1.0、2.0、3.0、4.0、5.0 ml于 10 ml容量瓶中,分别加入5%NaNO2溶液0.5 ml,放置 6 min后,加入 10%Al(NO3)3溶液 0.5 ml,摇匀后放置 6 min,再加入4%NaOH溶液4 ml,用60%乙醇稀释至刻度,摇匀后放置12 min,配制不同浓度的络合物[18]。以不加芦丁的溶液做空白,进行紫外可见光谱扫描,确定芦丁最大吸收波长。在最大吸收波长处分别测定不同浓度芦丁的吸光度,以吸光度为纵坐标(y)、芦丁浓度为横坐标(x)作回归方程绘制标准曲线。
1.4.2 样品溶液的制备和黄酮含量的测定。取干燥的构树叶样品,用粉碎机粉碎成粉末状,每次取3 g粉碎的干构树叶放入锥形瓶中,加入一定质量比的乙醇溶液,采用不同的工艺条件在超声波清洗器中超声提取[19],进行工艺条件选择,抽滤后得到提取液,用紫外分光光度法测定提取液中黄酮含量[16-17]。每个工艺条件平行做2个样,最后取结果的平均值。用薄层色谱(TLC)分离鉴定提取液,以芦丁作为黄酮标准物对照,固定相为硅胶GF254,展开剂为正丁醇∶冰酸酸∶水=4∶1∶1,紫外灯下检测分离结果,结果作为选择提取工艺条件以及纯化条件的依据之一。
1.4.3 单因素试验。
1.4.3.1 乙醇浓度对提取黄酮的影响。根据文献[16],乙醇对黄酮的提取率较高,所以分别以30%、40%、50%、60%、70%乙醇为溶剂,构树叶与乙醇的料液比为1∶15(g∶ml),温度40℃,超声提取15 min,抽滤除去滤渣,量取滤液体积,再将滤液离心分离,取 0.3 ml转入10 ml容量瓶中,按照“1.4.1”的方法加入显色剂,用 60%乙醇定容,摇匀后在已知最大吸收波长下分别测定黄酮的吸光度。
1.4.3.2 不同提取温度对提取黄酮的影响。以50%乙醇为溶剂,料液比为 1∶15(g∶ml),提取温度分别为 40、50、60、70、80 ℃,提取时间为 15 min,然后按照“1.4.3.1”的方法处理并分别测定吸光度。
1.4.3.3 不同料液比对提取黄酮的影响。以50%乙醇为溶剂,按料液比分别为 1∶8、1∶12、1∶16、1∶20、1∶24、1∶30(g∶ml),提取温度为40℃,超声提取时间为15 min。抽滤除去滤渣,滤液再进行离心分离,用50%乙醇分别稀释滤液至相同体积,混匀后取 0.3 ml转入 10 ml容量瓶,按照“1.4.3.1”的方法分别测定吸光度。
1.4.3.4 不同提取时间对提取黄酮的影响。以50%乙醇为溶剂,按照料液比为1∶12(g∶ml),提取温度为40℃,提取时间分别为 10、25、40、55、70 min,抽滤除去滤渣,后处理及测定步骤同“1.4.3.1”。
1.4.4 正交试验。根据单因素试验结果,选取乙醇浓度、料液比、提取时间、提取温度4个因素为主要考察因素,以黄酮提取率作为考察指标,采用L9(34)表进行正交试验并进行结果分析。
1.4.5 样品黄酮提取率的计算。根据标准曲线制备项下方法测定得样品溶液吸光度值,由标准曲线得到样品溶液质量浓度,按下式计算构树叶样品黄酮的提取率:黄酮类化合物提取率(%)=C· V·10-3/W,式中,C为样品溶液质量浓度(mg/ml);V为样品溶液体积(ml);W为样品质量(g)。
1.4.6 样品的分离纯化与工艺流程。根据正交试验结果,采用最佳提取工艺条件提取干构树叶中的黄酮,滤液用旋转蒸发仪回收溶剂,蒸发至原体积的一半左右,将浓缩液用等量石油醚萃取,除去叶绿素和脂溶性杂质,得到水相,在水相中加入6 mol/L的盐酸处理,使之pH在2左右,然后用等量乙酸乙酯萃取2次[20-21],分离去水相,将乙酸乙酯相减压蒸干,得到黄酮提取产物。准确称取一定量的产物,用60%乙醇溶解,然后用“1.4.1”的方法测定其黄酮含量。提取分离黄酮的工艺流程为:干构树叶→粉碎→加入乙醇溶剂→超声提取→抽滤→滤液→回收乙醇→石油醚脱色→水层酸化pH=2→乙酸乙酯萃取2次→回收乙酸乙酯→得到提取产物→测定黄酮含量。
2 结果与分析
2.1 对照品溶液紫外可见光谱扫描和标准曲线制作 由对照品溶液紫外可见光谱扫描得知,最大吸收波长为506 nm。从芦丁对照品标准曲线(图1)可看出,回归方程为y=9.15x+0.007 2(r2=0.996 5)。
2.2 单因素试验
2.2.1 乙醇浓度对构树叶黄酮提取率的影响。从图2可看到,当提取剂乙醇浓度在40% ~50%时提取率较大,随着乙醇浓度增加,提取率逐步下降。其原因是随着乙醇浓度增加,脂溶性物质溶出较多,黄酮溶出量下降导致提取率下降,因此选择40%~50%浓度的乙醇为最佳溶剂。
2.2.2 超声提取温度对构树叶黄酮提取率的影响。由图3可见,随着温度的升高,提取率呈上升趋势。因为温度升高加快了分子的扩散能力,从而使构树叶黄酮的溶出速度增加,提取率升高,在60℃下提取率最大。但温度进一步提高,可能引起黄酮的分解,导致黄酮提取率下降。因此提取温度以60℃左右为宜。
2.2.3 料液比对构树叶黄酮提取率的影响。由图4可知,随着提取液比例的增加,构树叶黄酮提取率也随之增加。一般情况下,提取液用量越多越利于构树叶黄酮的溶解,但在1∶20(g∶ml)以后提取率增加速度减缓。过高的料液比也会浪费溶剂和能源。所以选择最佳的料液比为1∶20~1∶30。
2.2.4 超声提取时间对构树叶黄酮提取率的影响。从图5可看出,随着超声时间的增加,构树叶黄酮的提取率也逐渐增加,当超声时间为40 min时,构树叶黄酮提取率达最大,继续延长超声时间,构树叶黄酮提取率呈下降趋势。可能超声时间过长,破坏了构树叶黄酮中的有效成分,因此选取最佳超声提取时间为40 min。
2.3 正交试验结果 根据单因素试验结果设计了各因素水平表(表1),并建立了L9(34)正交试验表(表2)。由表2可知,通过极差分析,4个影响超声波辅助提取构树叶中黄酮的因素大小顺序为D(料液比)>B(提取时间)>A(乙醇浓度)>C(提取温度),超声波提取构树叶中黄酮的最佳工艺为A2B1C2D3,即乙醇浓度40%、提取时间30 min、提取温度60℃、料液比为1∶30(g∶ml),在此条件下,提取率为4.16%。
2.4 样品的提取分离纯化 根据正交试验结果进行构树叶中黄酮的提取,用萃取法分离纯化提取液。经过试验证明采用A3B2C1D3的工艺条件提取的黄酮提取液,在后处理步骤能有效地萃取分离黄酮,是最佳提取条件。称取每份4.00 g干燥粉碎的构树叶样品,共6份,按照最佳提取工艺条件,在超声波清洗机中超声提取,合并滤液,按照“1.4.6”的方法进行后处理和萃取分离,得到的固体产物质量为1.426 g,产物得率为5.94%。称取0.261 5 g固体产物,按照“1.4.2”的方法测定黄酮含量,测得固体产物中黄酮的含量为35.36%。
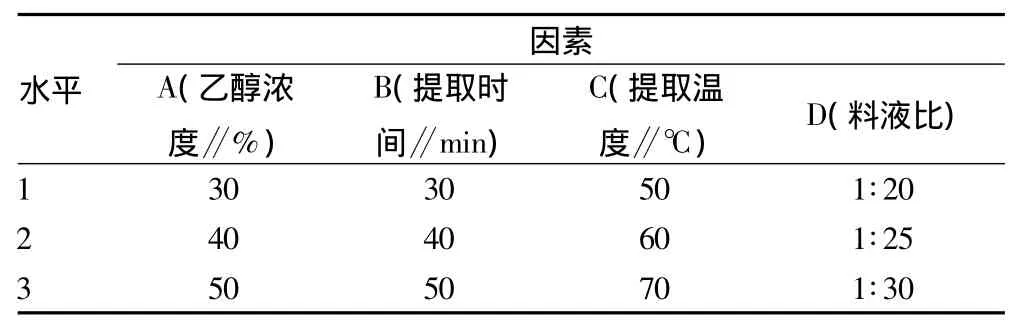
表1 超声波提取黄酮工艺正交试验因素和水平表
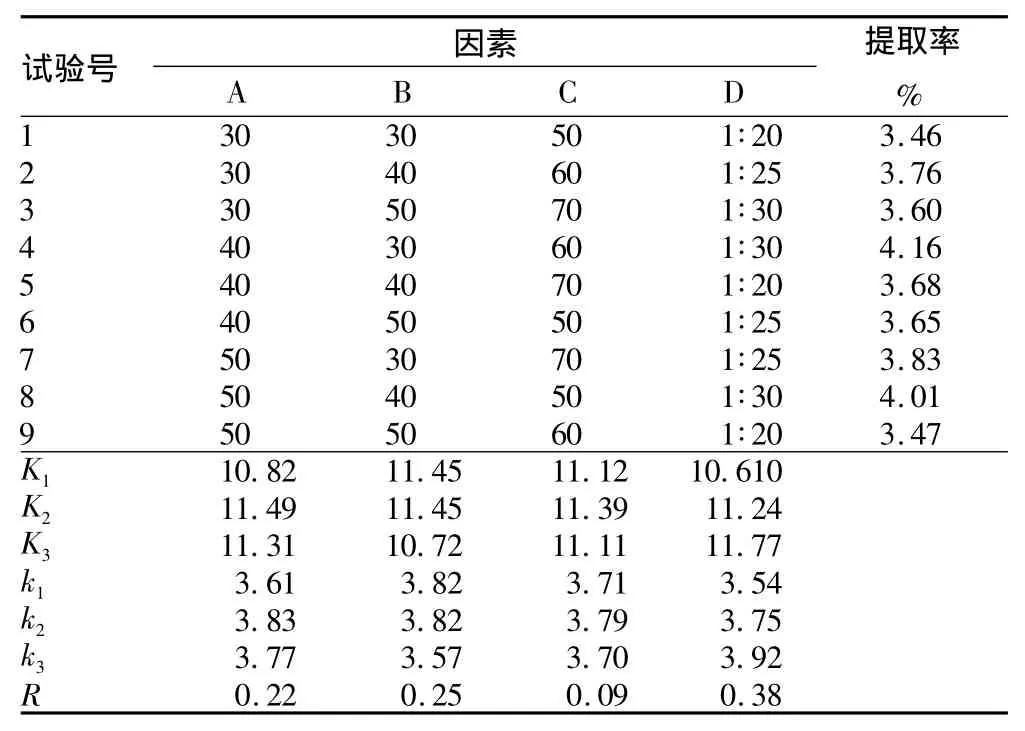
表2 超声波提取黄酮正交试验L9(34)设计及结果
3 结论
该试验以廉价易得的天然产物构树叶为原料,采用超声波辅助乙醇溶剂法提取其中的有效成分黄酮,在单因素试验基础上进行正交试验,得到最佳提取工艺条件。结合分离纯化的工艺条件,得出了最优提取纯化构树叶中黄酮的工艺是:以50%乙醇为溶剂,料液比为1∶30(g∶ml),在50℃下超声提取40 min,过滤后得到提取液。提取液浓缩至约1/2体积后,用等量石油醚萃取除去叶绿素等脂溶性杂质,用盐酸酸化水相至pH=2,再用等量乙酸乙酯萃取水相2次,黄酮从水相转移到乙酸乙酯相,经薄层色谱分离鉴定,乙酸乙酯相中主要成分为黄酮;分离酯层并回收乙酸乙酯,真空干燥得到了黄酮提取物,提取物得率为5.94%,其中黄酮含量达35.36%。
目前尚未见到用超声波辅助溶剂法从构树叶中提取黄酮的工艺研究,并用乙酸乙酯萃取提纯产物的报道。该工艺可得到含量较高的黄酮提取物,操作简单、溶剂可回收、提取成本低、提取分离效率高,提取产物可以用其他方法进一步提纯。该研究为开发利用构树叶中的黄酮并使其能应用于医药及保健品提供了可靠试验依据。
[1]江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,1977:2288-2291.
[2]周文美,徐子婷.楮桃和番茄的复合型果醋生产工艺的研究[J].中国酿造,2011(4):173 -175.
[3]林文群,陈忠,李萍.构树聚花果及其果实原汁营养成分的研究[J].天然产物研究与开发,2001,13(3):45 -47.
[4]李梦琳,王亚东,林梦,等.构树叶蛋白质的提取研究[J].资源开发与市场,2012,28(12):1057 -1059.
[5]张玉霞,陈国豪.构树经济价值研究初探[C]//第十四届中国科协年会第6分会场:林业新兴产业科技创新与绿色增长学术研讨会论文集,2012.
[6]刘晓军,刘铀,陈绍红.构树叶提取物抑菌活性的初步观察[J].中国实验方剂学杂志,2013,19(19):283 -286.
[7]贾东辉,杨雪莹.构树叶中黄酮成分分析和抗氧化活性的测定[J].职业与健康,2006,22(17):1352 -1353.
[8]渠桂荣,张倩,李彩丽.构树的药理与临床作用研究述略[J].中医药学刊,2003,21(11):1810 -1811.
[9]吴世成.构树的药理作用综述[J].科技信息,2010(11):447,459.
[10]殷志琦,巢剑非,张雷红,等.构树化学成分研究[J].天然产物研究与开发,2006(18):420 -422,425.
[11]徐小花,钱士辉,卞美广,等.构树叶的化学成分[J].中国天然产物,2007,5(3):190 -192.
[12]冯卫生,李红伟,郑晓珂.构树化学成分的研究进展[J].中国新药杂志,2008,17(4):272 -278.
[13]李莹莹,窦德强,熊伟.构树叶化学成分的研究[J].中国现代中药,2012,14(4):7 -9.
[14]MA Y M,ZHANG Z W,FENG C L.Flavonoids of Broussonetia papyrifera[J].Chemistry of Natural Compounds,2009,45(6):881 -882.
[15]熊燕飞,赵元昊,杨亚宁,等.构树黄酮的提取及体外抗氧化作用[J].林业科技开发,2009,23(1):42 -45.
[16]ZHU K M,GU S J,YAO L M.Research on the extraction technology of total flavonoids from Broussonetia papyrifera by microwave-assisted method[J].Medicinal Plant,2012,3(5):26 -29.
[17]徐颖,郭增军,谭林,等.构树不同部位黄酮含量的季节性变化研究[J].现代中药研究与实践,2009,23(4):16 -17.
[18]迟玉新,窦德强.楮实子与构树叶中黄酮含量测定[J].中国现代中药,2008,10(11):16 -17.
[19]王建安,付英杰,李艳芝.超声法优化金叶女贞叶中黄酮的提取[J].南京师大学报:自然科学版,2014,37(3):106 -110.
[20]罗悠,陈莉华,梁玄,等,金银花叶茎藤中黄酮与绿原酸同时提取分离工艺[J].吉首大学学报:自然科学版,2012,32(5):92 -93.
[21]路博琼,王自波,谢晓婷,等.杜仲叶中绿原酸和黄酮同时提取分离方法的研究[J].安徽农业科学,2013,41(19):8214 -8217.

