一起猪高致病性蓝耳病的病例报告
于青海 (山东省动物疫病预防与控制中心 山东 济南 250000)
一起猪高致病性蓝耳病的病例报告
于青海 (山东省动物疫病预防与控制中心 山东 济南 250000)
猪高致病性蓝耳病又称猪繁殖与呼吸综合征(PRRS),是以母猪流产及仔猪呼吸系统障碍为主要病征的传染病,病原为猪繁殖与呼吸综合征病毒(PRRSV)。该病毒传染性强,而且感染机体后致免疫抑制及各种并发症,给养猪业造成巨大危害和经济损失。本研究通过山东某猪场送检病料,通过临床症状、剖检变化及实验室诊断,经PCR病原学鉴定确定是猪蓝耳病。
猪繁殖与呼吸综合征(PRRS),是由猪繁殖与呼吸综合征病毒(PRRSV)引起的,主要以引起母猪发热、厌食和流产、早产、木乃伊胎及弱仔等繁殖障碍及仔猪和生长猪出现呼吸系统疾病和高度死亡率为特征的一种高度接触性传染病。该病在临床上还表现为耳部皮肤发绀,因此又被称为“蓝耳病”。除此之外,临床上还表现在部分康复母猪发情不典型,以及屡配不孕等症状。该病于1987年首次发生在美国的北卡罗来纳、衣阿华等州的猪群中,当时被称为“猪神秘病”,很快该病广泛流行于欧洲、美洲等养猪国家和地区,亚洲的日本、韩国、菲律宾、中国和中国台湾省亦相继报道了该病。PRRSV具有嗜巨噬细胞性、持续感染性以及抗体依赖性增强作用等特征。根据资料显示,不同PRRSV毒株在毒力性、抗原性以及遗传性方面均有很大的差异。根据基因序列以及抗原性差异,将PRRSV分为两种独特的基因型,LV是在欧洲分离的大部分欧洲株原型(European, I型);而在北美洲用建立的细胞株分离到类似的病毒,它们称为VR-2332,VR-2332是北美洲大多数PRRSV原型(North American,Ⅱ型)。在核酸水平,这两种基因型仅有约60%的同源性,但是,在临床上都引起相似的症状。1991年,荷兰学者Wensvoort等从Lelystad 镇的猪肺泡巨噬细胞内首次分离到该病病原,称之为Lelystad病毒(Lelystad virus, LV)。 1992年,美国也分离到该病的病原体,称之为猪不育与呼吸综合征病毒(SIRSV)。1992年,世界动物卫生组织(OIE)正式将该病毒命名为猪繁殖与呼吸综合征病毒(PRRSV)。并将该病列为B类传染病,但是近年来该病给养猪业带来的巨大损失已经远远超过了某些A类传染病。我国于1996年,由郭宝清首次在国内某猪场分离到了PRRSV,并命名为CH-1a株。2006年下半年,我国南方地区爆发了“无名高热”疫情。以高热、厌食、嗜睡、呕吐、拉稀、便秘、呼吸困难咳嗽及全身皮肤发红为主要临床症状的急性传染性疾病,任何年龄段的猪都可发病。最后确诊结果表明,高热病的主要致病原为高致病性PRRSV(Highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV。到目前为止,在我国境内大多数省份均有PRRS疫情出现过。
初次发生时,临床表现一般比较严重。一次流行过后,通常可能转入亚临床感染或持续感染状态,随后呈地方流行性发生。常与细菌、支原体、圆环病毒、猪瘟病毒、伪狂犬病毒、猪流感病毒、猪呼吸道冠状病毒等混合感染使临床表现形式复杂化。尽管世界各养猪大国对PRRS给予了足够的重视,但是目前为止人们对PRRSV结构蛋白及非结构蛋白的功能、病毒的致病机制、病毒的持续感染机制、机体对病毒的免疫机制等缺乏深入的认识而难于防治,而且一旦猪场发生PRRS后,需要花很大的费用和时间才能净群,所以目前PRRS还是威胁各国猪业的主要疾病之一。
1 发病情况
山东省某猪场自2015年5月上旬开始,猪群中陆续有病猪出现,病猪体温在40.0~40.5℃之间,除发热外,别无其他症状,生猪饮食正常,精神尚可。该场兽医认为积热所致,并无大碍,只在饲料中添加助消化药。至5月20日上午,饲养员喂猪时发现38头2月龄的猪发病,病猪躺卧在角落,精神不振,不进食,结膜充血,呼吸急促,,大便十硬,测量体温高达41.5℃。该场兽医凭经验诊断为猪传染性胸膜肺炎,先后使用青霉素、链霉素、排疫肽等药物,但不能退其热,并且症状日益加重。至22日上午发现14头生猪死亡。
2 临床症状
临诊检查发现病猪精神沉郁,食欲不振或废绝,口渴但不欲饮.部分病猪出现后躯无力、不能站立或共济失调等神经症状,呼吸用难、喘气,严重出现腹式呼吸,吸频率在35~40次/min.脉搏90~l20次/min,体温在4l~42.5℃之间.皮肤干燥发红变紫,少数毛孔有出血点.尤其以腹下、四肢末梢和耳根等处皮肤更明显,斑块呈紫红色,手压不褪色,眼睛发红,分泌物增多,呈胶黄状,甚至出现结膜炎症状,无尿或少尿.尿色深黄,粪便硬,病期较长者体型消瘦,被毛粗乱,出现贫血症状。
3 剖检变化
主要病变为弥漫性间质性肺炎,肺肿大。间质增宽,个别病例肺脏体积缩小。表面有散在隆起的橡皮状硬块,肺脏表面有点状出血或瘀血,气管内有泡沫状分泌物,胸腔及腹腔有浑浊的黄色积液,全身淋巴结旱不同程度的肿大或水肿,淋巴结颜色暗紫,切面呈大理石样出血,特别以腹股沟淋巴结和肺门淋巴结尤为明显,会咽部严重充血。脾脏肿大,边缘有紫黑色的坏死和梗死。肾脏肿大,颜色变深,呈褐色或土黄色,质地较脆,有针尖大出血点或瘀血现象。胃、大肠、小肠发现仃面积大小不一的溃疡灶或出血点。肝脏肿胀,呈土黄色,上面有浅灰色坏死灶或溃疡点。

图1 PRRS病例肺脏病理变化A.间质性肺炎,肺脏心、尖叶实变 B.肺脏大量出血点 C.肺脏气管和支气管中大量粘液
4 组织学检查
病理组织学技术是病理解剖学中最基础、最重要的研究手段之一,包括病理切片技术和显微镜下的识片。
4.1 常规石蜡切片器材
切片机、切片刀、磨刀具、熔蜡及包埋工具。
4.2 石蜡切片方法
4.2.1 取材 采集大小0.5×0.5×0.5cm3的组织块。
4.2.2 固定 采集的组织块立即投入固定液中,常用的固定液是10%中性福尔马林,固定24h即可。
4.2.3 脱水 已固定好的组织块进行适当修整后先经流水冲水12~14h,然后用梯度酒精使组织块充分脱水,脱水常用的酒精梯度和所需时间是:70%酒精(过夜)→80%酒精(2h)→95%酒精I(30min)→95%酒精Ⅱ(30min)→100%酒精I(20min)→100%酒精Ⅱ(20min)。
4.2.4 透明 脱水的组织块需用二甲苯透明,其目的在于将组织块中的无水酒精置换出来,为浸蜡做准备。透明分两次进行,在二甲苯Ⅰ中停留10min,二甲苯Ⅱ中停留10min。
4.2.5 浸蜡 将透明好的组织块浸入石蜡内(已熔化的石蜡分别装在2~3个蜡杯中),每个蜡杯中停留时间约为30min。以上步骤均须在石蜡熔化状态下进行。
4.2.6 包埋 将浸好石蜡的组织块放入盛有熔化石蜡的包埋框内,使组织块埋于石蜡中。待蜡块冷却后进行适当修整,并将其粘附与台木上。
4.2.7 切片 将制成的组织蜡块用切片机3um切成薄片。4.2.8 展片和贴片 将切下的切片用于毛笔托起放入展片槽内的水面,让其自然伸展(水温要求40~45℃,温度过低不易于伸展,过高则可将切片熔化)。切片展平,取一洁净载玻片在切片附近垂直插入水中,缓缓上提,切片可自动贴附于载玻片上,然后将其置温箱中烘干。
4.2.9 脱蜡、进水、染色及封藏 组织切片→二甲苯Ⅰ(10min)→二甲苯Ⅱ(10min)→无水酒精(2min)→90%酒精(2min)→80%酒精(2min)→70%酒精(2min)→蒸馏水(3min)→苏木素染液(5min)→常水冲洗至不脱色为止→1%盐酸酒精分化(迅速)→自来水蓝化(15min)→85%酒精(迅速)→1%伊红染液(迅速)→95%酒精I(迅速)→95%酒精Ⅱ(2min)→无水酒精I(2min)→无水酒精Ⅱ(2min)→二甲苯Ⅰ(5min)→二甲苯Ⅱ(5min)→滴加中性树胶→盖上玻片→镜检。
4.3 镜检结果
(1)肺脏病程稍短者,肺泡壁增厚,肺泡内无炎性分泌物病,叶间静脉和肺泡壁毛细血管内充满红细胞。病程加长,病变也越严重,肺泡壁明显增宽,肺泡壁及支气管周围的间质中有大量的炎性细胞浸润,且肺泡腔内有大量脱落的上皮细胞和炎性细胞。(2)淋巴结皮质内淋巴小结变性坏死,固有结构遭受破坏,淋巴结皮髓质界限不清楚,细胞排列松散,靠近被膜的皮质区组织间大量红细胞蓄积。髓质内毛细血管淤血充血。(3)脾脏小梁尚可分辨,脾小体轮廓不清,但淋巴细胞和网状细胞崩解、碎裂,鞘动脉上皮细胞变性坏死,脾索细胞肿胀、变性、坏死、崩解,脾脏中可见大量红细胞,其中一头发病死亡猪的脾脏内可见淋巴小结中心坏死,巨噬细胞和大量网状细胞增生。(4)肝脏肝细胞颗粒变性,细胞核浓缩,肝索排列紊乱,中央静脉和肝窦状隙扩张可见大量红细胞、少量淋巴细胞。(5)肾脏皮质和髓质充血、出血,肾小球毛细血管充血,肾小球扩张,肾小球周围间质血管充血,肾小管上皮细胞发生水泡变性,不同程度坏死脱落。(6)肠道显微镜下可见黏膜上皮细胞变性,坏死,甚至脱落进肠腔。黏膜层有少量红细胞,黏膜下层毛细血管充血,少量淋巴细胞渗出。(7)大脑表现为非化脓性脑炎的病变,神经细胞变性坏死,血管内大量红细胞蓄积,血管周围2~3层淋巴细胞环绕呈现袖套现象,胶质细胞增生。(8)心肌眼观无明显病变,显微镜下可见心肌纤维颗粒变性。

图2 PRRS病例肺、脑病理变化A.间质性肺炎 B.脑袖套现象
5 病原学检测
无菌采集病猪脑、淋巴结、肺、血清各5份,经猪蓝耳病病毒RT—PCR ORF5基因扩增检测均为阳性(PCR扩增产物经琼脂糖凝胶板电泳,在紫外灯下观察,结果为:在818 pb处出现亮带,并与Mark和阳性对照亮带相符合)。
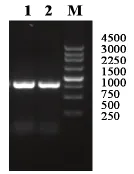
图3 猪蓝耳病毒基因扩增结果PRRSV ORF5 RT-PCR 产物 1-PRRSV ORF5 RT-PCR 产物 2-阳性对照M-4500bp的Mark
根据临床症状、剖检变化和实验室诊断,确诊该猪场发生的疫病为猪蓝耳病。
6 防治措施
(1)对猪舍和用具用氯制剂、甲醛等消毒剂进行彻底消毒,及时清理病死猪、死胎及胎衣,清除猪舍内外废弃物。(2)对发病猪立即隔离,果断淘汰无治疗价值的病猪,做无害化处理,以预防和控制本病的蔓延。(3)对没有临床症状的猪采用蓝耳病活疫苗进行紧急免疫,根据猪只大小,分别使用不同剂量。免疫结果表明该疫苗免疫效果好,保护率高。(4)对处于发热期的病猪肌肉注射退热药,同时应用抗菌消炎、抗病毒药物,并结合补液胃管投药等多种治疗方法。
[1] 殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社, 1997.
[2] 金光明, 杨倩. 猪繁殖与呼吸综合症免疫学研究进展[J]. 安徽农业科学, 2003, 31(l): 111-114, 116.
[3] Spilman M S, Welbon C, Nelson E, et al. Cryoelectrontomography of porcine reproductive and respiratory syndrome virus: organization of the nucleocapsid[J]. J Gen Virol, 2009, 90(3): 527-535.
[4]Mengeling W L,Lager K M, Vorwald A C. The effect of porcine parvovirus and porcine reproductive and respiratory syndrome virus on porcine reproductive performance[J]. Animal Reproduction Science,2000,(60-61):199-210.
[5] Keffabern K K. Reproductive failure of unkown etiology[J].Am Asso SWine Pract Neuwsletter,1989,l(2): 1-9.
[6] 高云英, 贺玉胜, 刘秀琴等. 猪繁殖呼吸道综合症研究进展[J]. 甘肃农业大学学报, 2002, 37(6): 139-144.
[7] 陈希文, 尹苗, 程安春. 猪繁殖与呼吸综合症免疫学研究进展[J].养猪, 2005(l): 29-33.
[8] 王珍芹, 曲志娜. 猪繁殖与呼吸道综合症免疫预防进展[J]. 中国动物检疫, 2005(12): 49-50.
[9] 谢印乾, 沈志强, 王桂花等. 猪繁殖与呼吸综合症免疫学研究进展[J]. 动物医学进展, 2006, 27(6): 6-10.
[10] 王国强, 文利新, 袁志航等. 猪蓝耳病疫苗免疫及其免疫应激研究进展[J]. 养猪, 2007(6): 41-44.
[11] 冉红志, 赵宝, 朱永周等. 猪繁殖与呼吸障碍综合征病原学及免疫学特征性研究进展[J]. 动物医学进展, 2011, 32(6): 148-151.
[12] 孙凌志, 陈庆勋, 徐品等. 对河南南阳猪高致病性蓝耳病的病例防制[J]. 兽医临床, 2007, 5.
[13] 李涛, 冉隆仲, 乐正中等. 贵州省野猪蓝耳病病例报告[J]. 贵州畜牧兽医, 2008, 32(2): 14.
[14] 李继东, 许立华, 王玲. 猪繁殖与呼吸障碍综合征诊断方法与防治技术研究进展[J]. 宁夏农学院学报. 2004, 25(3): 68-70,75.
[15] 靳明武, 张洋龙, 孙晓雨等. 猪蓝耳病和传染性胸膜肺炎混合感染的病例报告[J]. 黑龙江八一农垦大学学报, 2012, 24(5): 32-35.
S858.28
B
1007-1733(2015)11-0057-03
2015-08-20)

