口服不同剂量胆碱在肉鸡血液中的代谢动力学研究
王斯佳 蔡辉益 刘国华 闫海洁
(中国农业科学院饲料研究所,家禽营养与饲料研究室,北京 100081)
胆碱(choline)是一种水溶性季铵盐,具有强碱性。自发现以来,已有一百五六十年的历史。早在80年前,胆碱的营养作用就已确立。营养学中将其归为B族维生素类,但机体对胆碱的需要量远远高于其他维生素。胆碱是机体内许多生理功能所必需的营养物质。胆碱及其代谢产物对于维持细胞结构完整性、甲基化反应、神经递质传导、膜信号转导及脂质胆固醇的运输和代谢都至关重要[1]。当胆碱不足或者缺乏时,将诱发脂肪肝,机体生长明显减慢,饲料的利用效率明显下降。在畜禽生产中,胆碱最主要的功能即作为甲基供体。胆碱被氧化过程中释放出来的甲基基团,是合成蛋氨酸、磷脂、肌酸、肉碱、肾上腺素、核糖核酸(RNA)和脱氧核糖核酸(DNA)等具有重要生理作用的物质所必需的,在神经系统、泌尿系统、心血管系统和免疫系统中所起的作用不容忽视[2]。通常认为,生长期和成年期动物都需要提供甲基。但肉仔鸡一般对胆碱的需求量较高,体内甲基的合成量非常有限,利用蛋氨酸和甜菜碱来合成胆碱的能力很弱,必须通过外源性添加才能满足其生长需要。
氯化胆碱(2-羟乙基-三甲胺)是胆碱的中性化合物,易溶于水和乙醇,溶液呈弱酸性,热稳定性好[3]。在饲料工业生产上,胆碱通常是以氯化胆碱的形式以水溶液直接添加或以载体吸附添加于饲料中。氯化胆碱被认为是胆碱最经济有效的来源。虽然氯化胆碱在包括人类在内的所有动物中已被允许作为添加剂使用,但由于饲粮结构的不稳定性和试验数据有限,目前仍未规定最大添加剂量。但是,胆碱过量造成动物生产性能受阻的报道屡见不鲜,过量的氯化胆碱也会导致人产生头晕恶心的症状。欧洲食品安全机构(EFSA)2011年发表声明:当前认为商业饲料中氯化胆碱的使用量对于动物来说是安全的,但与使用量相比,家禽的安全范围较小[4]。在集约化的生产条件下,在追求利益最大化的今天,氯化胆碱被大量甚至过量添加,这不仅会带来生产成本的浪费,也势必增加了动物机体的负担。如果缺乏对肉鸡体内胆碱吸收代谢规律的认识,就无法实现胆碱的安全有效利用。目前,关于胆碱在肉鸡体内吸收、分布和代谢的研究鲜有报道。本试验采用药代动力学的方法,通过研究胆碱在肉鸡血液中的代谢和分布,旨在探讨饲粮中胆碱添加量与动物机体吸收利用的关系,以期为胆碱的合理使用提供理论依据,并为研究营养物质代谢提供新思路。
1 材料与方法
1.1 试验材料
1.1.1 试验药物及仪器
ICS-3000离子色谱系统(美国 Dionex公司),电导检测器;自动进样器及Chromeleon色谱数据处理工作站;MiliQ-Element纯水机(法国Millipore);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);冷冻干燥机(FD-1B-50,北京博医康公司);电热恒温水浴锅(北京长安科学仪器厂);0.22μm尼龙滤膜。
胆碱酒石酸氢盐(纯度98.0%,日本TCI试剂);MiliQ-Element超纯水;盐酸(优级纯,北京化工厂);曲拉通X-100(化学纯,西陇化工股份有限公司);甲烷磺酸(色谱纯,Sigma公司)。
1.1.2 试验动物及饲养
12只经正常免疫程序后的9周龄健康爱拔益加(AA)肉公鸡,体重为(4.0±0.57)kg。试验鸡随机分为3组,每组4只。控制温度为24℃,相对湿度为55% ~70%。试验前常规饲养1周,饲喂缺乏胆碱的纯合饲粮,基础饲粮组成及营养水平见表1。试验鸡自由采食和饮水。口服标准氯化胆碱前禁食48 h,正常饮水。灌药前停止饮水,灌药后2 h进水,药代试验期间全程饥饿。
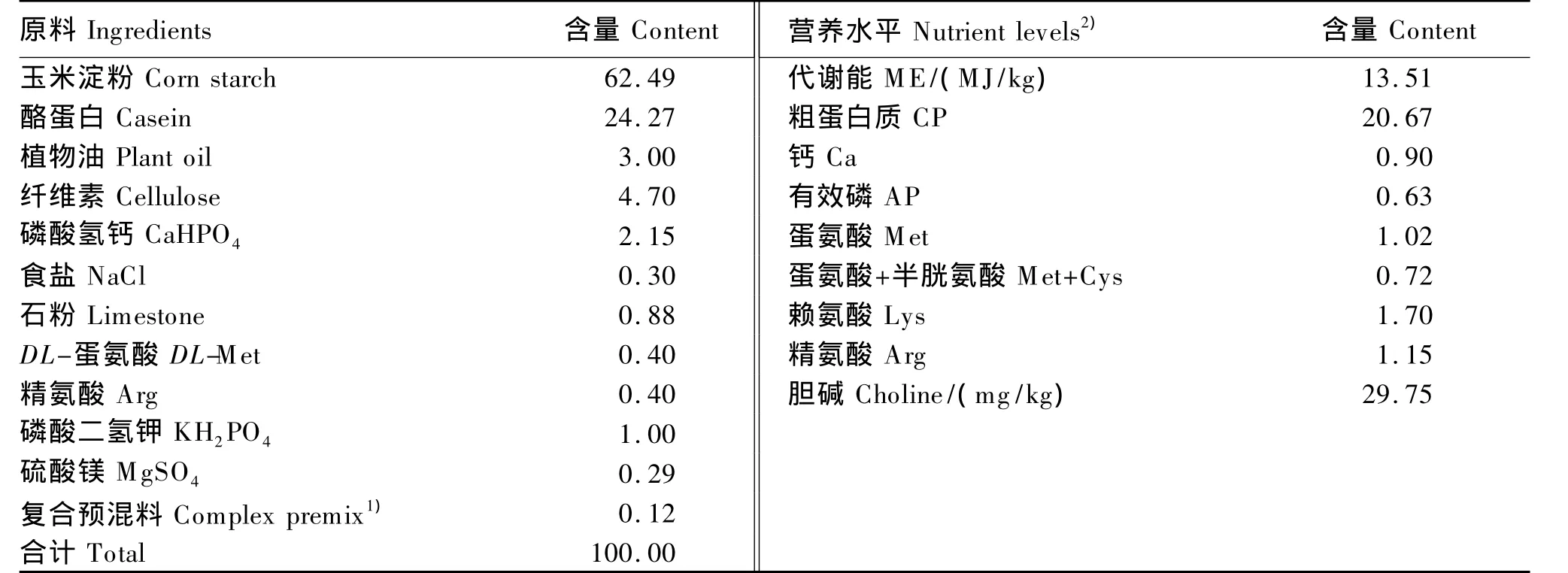
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验方法
1.2.1 分组及给药
12只试验鸡分为 A、B、C 3组,每组4只,A组为空白对照组,B为200 mg/kg剂量组,C组为400 mg/kg剂量组(剂量均以胆碱计)。给药前空腹称重。根据试验鸡体重,分别按目标胆碱剂量换算为氯化胆碱量后,准确称取氯化胆碱标准品,均匀混入40 g无胆碱饲粮中,一次性灌喂。空白对照组灌喂相应质量的无胆碱饲粮。口服剂量的确定方法如下:参见NRC(1994)肉鸡后期需要量为750 mg/kg,以9周龄肉公鸡每只每日采食饲粮0.25 kg 计,750 mg/kg×0.25 kg=187.5 mg≈200 mg。普遍认为鸡的胆碱最大耐受限量为需要量的2倍[5],故本试验设定了一个正常剂量组和一个最大耐受剂量组进行研究。
1.2.2 采样
试验鸡仰卧并人工保定,固定一侧翅膀,拔去翼下羽毛,消毒皮肤,从翼下静脉采血。于给药前采 1 次血,给药后分别于 1、2、3、4、8、12、24、36 和48 h采血于肝素抗凝管中,每次采血1.5~2.0 mL,-20℃冰箱保存。
1.2.3 样品处理
样品于-96℃冷冻干燥72 h并回潮,研钵研磨制样。准确称取约0.2 g冻干样品于50 mL具塞玻璃锥形瓶中,加入27.5 mL 1.0%的曲拉通-X100溶液,超声15 min,再加入1.5 mL盐酸,加盖,混匀。将锥形瓶放入70℃水浴3 h,每小时摇1次。将水解产物冷却至室温,用水冲洗锥形瓶,所得溶液过滤至容量瓶中,将滤液定容至100 mL,此滤液可以在4℃下保存3 d。分析前用水继续稀释此滤液10倍后,过0.22μm尼龙滤膜。同时准备试剂空白。
1.2.4 色谱条件
色谱柱:阳离子交换分离柱,包括IonPac CS12分析柱(250 mm×4 mm)和CG12保护柱(50 mm×4 mm);淋洗液:甲烷磺酸(16 mmol/L);抑制器:CSRS 300 4 mm,外接水。进样体积:100 uL。
1.2.5 标准曲线制作
依照样品制备的方法配制不同浓度的标准参照品,按上述色谱条件进行检测。胆碱标准品的测定结果见表2和图1。以电导率(y)对胆碱浓度(x)进行线性回归,方程为y=0.138 8x,相关系数(R2)=0.999 4。

表2 胆碱标准品浓度与电导率的关系Table 2 Relationship between concentration of standard choline and conductivity

图1 胆碱标准品浓度与电导率的关系Fig.1 Relationship between concentration of standard choline and conductivity
1.2.6 精密度和回收率检测
选择胆碱含量较低的2个全血样品进行了2个水平加标回收试验(n=6),结果见表3。实际样品在该检测条件下,目标化合物胆碱的周围无杂峰,能准确定量,色谱分离图见图2。同时参照GB/T 5413.20—1997《婴幼儿配方食品和乳粉 胆碱的测定》[6]的方法对血样进行检测,检测结果无显著性差异(P>0.05)。
1.3 数据处理
本试验采用非房室模型,通过在口服氯化胆碱后各取血点胆碱水平减去自身0点胆碱背景值所得胆碱浓度,达峰浓度(Cmax)和达峰时间(Tmax)均采用实测值,血药浓度-时间曲线下面积(AUC)用梯形法计算,使用Winnolin 5.2软件计算氯化胆碱的药代动力学参数[血浆浓度第一时间曲线下面积(AUMC)、表观分布容积(Vz/F)、半衰期(t1/2)、表观清除率(CL/F)、平均驻留时间(MRT)、末端相的血药浓度消除速率常数(Ke)]。使用SPSS 16.0软件单因素方差分析(one-way ANOVA)方法对各组胆碱浓度进行单因素方差分析,F检验差异显著时,采用Duncan氏法进行多重比较。结果以平均值±标准差表示。

表3 加标回收试验Table 3 Spiked recovery test(n=6)

图2 实际样品中胆碱的离子色谱分离图Fig.2 Choline analysis by ion chromatography in the actual sample
2 结果
2.1 血药浓度及药-时曲线
各组单次口服不同剂量氯化胆碱后各时间点的胆碱浓度见表4。空白对照组各采样时间点的血液中胆碱浓度差异不显著(P>0.05);试验组由于采样时间的不同,血液胆碱浓度有显著差异(P<0.05)。200 mg剂量组服药8 h的胆碱水平显著高于2、3、12 和 24 h(P<0.05),且极显著高于服药前(0 h)和服药后 1、36、48 h(P<0.01);400 mg剂量组服药8 h的胆碱水平显著高于3、4、12和24 h(P<0.05),且极显著高于其余各时间点(P<0.01)。200 mg试验组口服氯化胆碱后 3、4、8 h的血液胆碱浓度显著高于空白对照组(P<0.05),400 mg剂量组在口服后第 3、4、8、12 h的胆碱浓度显著高于空白对照组(P<0.05),但2个试验组间无显著差异(P>0.05),口服前及口服后其他时间点,各组间差异不显著(P>0.05)。
平均药-时曲线见图3。2个剂量组均在服药后8 h吸收达到最高峰,吸收相和消除相中,2个剂量组血药浓度与采样时间均呈线性相关和指数相关,且R2均达0.9以上,见图4、图5。
2.2 氯化胆碱非房室模型的药代动力学研究
肉鸡给予氯化胆碱形式的胆碱200和400 mg/kg后,非房室模型的药代动力学参数见表5。2个剂量组都在口服氯化胆碱8 h后血浆胆碱浓度达到最高水平;二者的半衰期分别为7.60和9.91 h,200 和 400 mg/kg 的 AUMC 分别为5 979.06和10 899.78 mg/(kg·h),400 mg 剂量组比200 mg剂量组提高了近1倍;对2个剂量组的各项参数进行F检验,除Vz/F和CL/F差异极显著(P<0.01)外,其余参数均无显著性差异(P>0.05)。
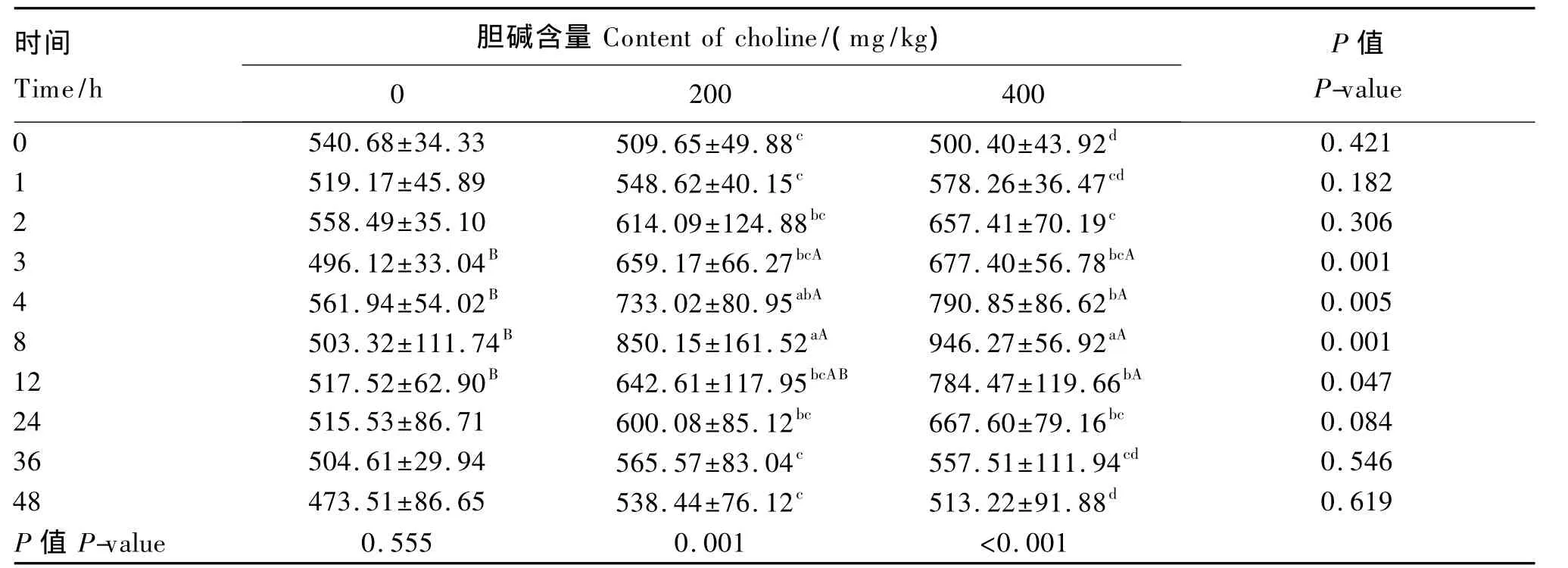
表4 胆碱缺乏饲粮饲喂肉仔鸡全血中的胆碱浓度Table 4 The content of choline in the blood of broilers fed choline-deficiency diet

图3 健康肉鸡口服200和400 mg/kg氯化胆碱后血药浓度-时间曲线Fig.3 The concentration-time curve after oral administration 200 and 400 mg/kg of choline chloride in healthy subjects(n=4)

图4 肉鸡口服不同剂量氯化胆碱吸收相血药浓度-时间曲线Fig.4 The concentration-time curve in absorption phase of different-dose choline chloride in broiler by oral administration
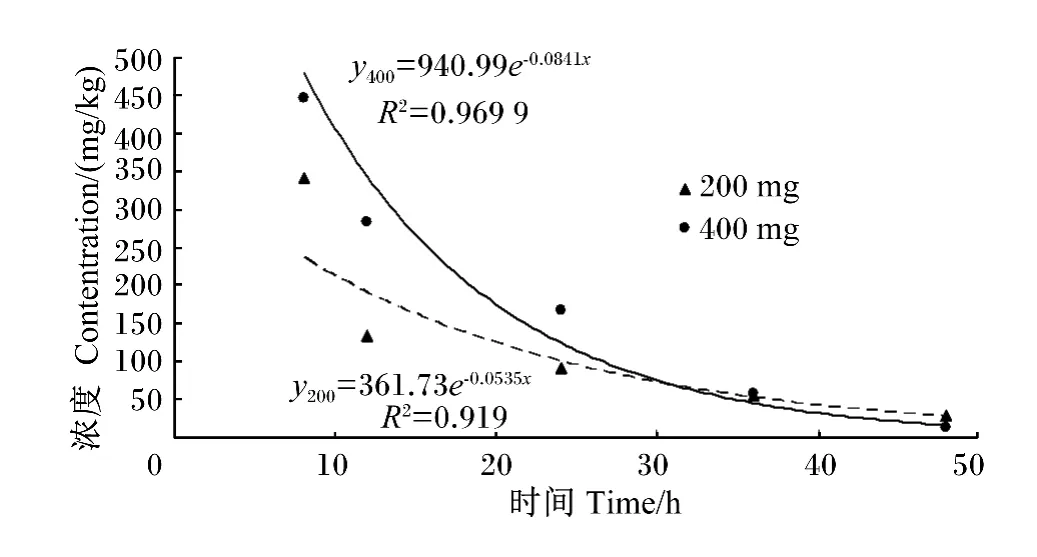
图5 肉鸡口服200和400 mg/kg氯化胆碱消除相血药浓度-时间曲线Fig.5 The concentration-time curve in elimination phase of 200 and 400 mg/kg of choline chloride in broiler by oral administration
3 讨论
3.1 离子色谱法测定血液中胆碱的可行性
胆碱是一种含氮的有机碱性化合物,在化学上的名称为(β羟乙基)三甲基氨的氢氧化物,其分子结构式为HOCH2CH2N+(CH3)3,相对分子质量121.18。由于其在水溶液中可完全电离,碱性强度类似于氢氧化钠,故可以选择离子色谱法,采用阳离子交换柱进行测定[7]。离子色谱法被认为是测定饲料和食品中胆碱含量的主要方法。关于饲料和婴儿奶粉中胆碱含量的研究方法已经比较成熟,从胆碱含量的检测到掺假的鉴别都已见文献报道[8-12]。目前预混料中氯化胆碱测定的行业标准 GB/T 17481—2008[13]和饲料级氯化胆碱测定的行业标准HG/T 2941—2004[14]中都是以离子色谱法作为仲裁法的,食品安全国家标准GB/T 5413.20—1997[6]中,测定婴幼儿食品和乳品中胆碱含量也推荐使用离子色谱法。文献中的检测对象一般为固体,前处理较为简便。而本试验中的检测对象为血液样品,其中有大量细胞悬浮,导致检测时结果不稳定。所以本试验采用冷冻干燥后研磨,并用盐酸加热后超声浸提的方法,使样品的细胞破碎,达到充分提取的效果。提取时加入的曲拉通-X100溶液可增加血液样本的表面活性,使提取的溶液更加均一稳定。经检验,本试验所采用的测定方法灵敏、快捷,效果准确、稳定,且对其他干扰离子的分离效果良好。大大提高了对血液中胆碱检测的精密度,回收率较高,可用于血液胆碱浓度测定和药代动力学研究。本试验中,从空白血液中可检测到一定量的胆碱,本方法所测得的浓度数据为内源性胆碱及给药后暴露于血液中的胆碱之和。且本试验已证明,肉鸡体内内源性胆碱的合成比较稳定,故口服氯化胆碱组的各时间点胆碱浓度减去自身0点的胆碱背景值所得胆碱水平,可反映氯化胆碱在肉鸡体内的代谢规律。
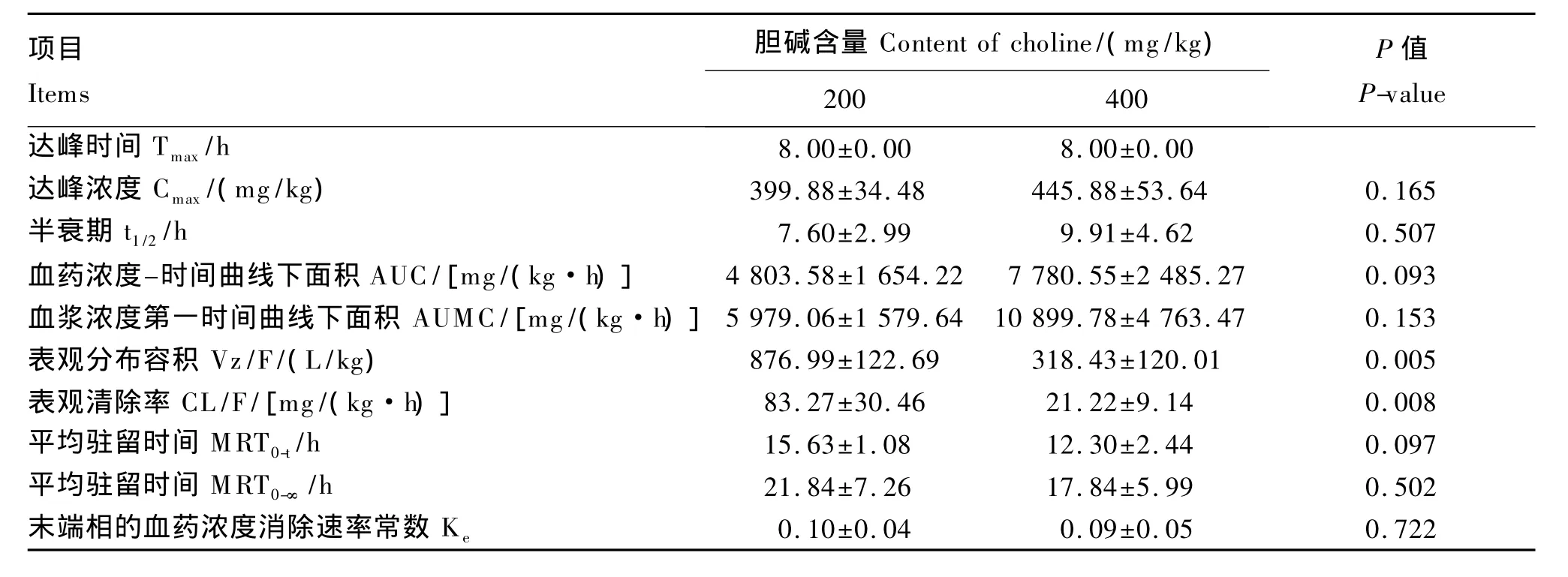
表5 健康肉鸡口服200和400 mg/kg氯化胆碱的主要药代动力学参数Table 5 The main pharmacokinetic parameters after oral administration 200 and 400 mg/kg of choline chloride in healthy subjects(n=4)
3.2 胆碱的吸收和转运对药代学参数的影响
血浆中的胆碱来源主要为:饲粮胆碱、磷脂分子的分解产物以及肝脏等器官的内源合成。肝脏是胆碱内源合成的主要场所[15-16],小脑也可以合成少量的胆碱[17]。体内的胆碱大多以磷脂酰胆碱(PC)的形式存在于细胞膜中,也有少部分以鞘磷脂(SM)和溶血磷脂酰胆碱(Lyso-PC)的形式存在,Lyso-PC再次形成PC后,吸收进入淋巴循环,并最终进入血液。胆碱是血浆的常规成分[18],红细胞有主动积累胆碱的功能,血液中的胆碱也主要集中于此[19]。在人类医学上,胆碱作为多种病理状态下的生物标志,血浆或全血中胆碱浓度的上升对于心脏疾病的预测意义重大。血浆胆碱浓度也可以作为饲粮胆碱水平的反映指标。大量研究表明,血浆游离胆碱浓度会随着饲粮中胆碱水平的变化迅速上升或下降[20-23]。本研究采用非房室模型,研究胆碱在肉鸡血液中的吸收代谢规律发现:9周龄健康肉鸡血液中内源性胆碱的合成较稳定,口服氯化胆碱可改变血液中胆碱的浓度;胆碱在肉鸡体内的吸收较为迅速,200和400 mg/kg剂量组血药浓度都在口服氯化胆碱8 h后达到峰值;t1/2分别为7.60和 9.91 h,证明胆碱在肉鸡体内代谢较快;Vz/F分别为876.99和318.43 L/kg,表明胆碱对组织穿透力强,在组织内浓度较高,在动物机体内的分布广泛,而且当胆碱浓度较低时,机体更容易利用;CL/F分别为83.27和21.22 mg/(kg·h),表明当胆碱剂量较低时,血液中的胆碱代谢更迅速,更有利于胆碱被机体利用;2 组的 Cmax分别为 399.88 和 445.88 mg/kg,虽二者之间无显著差异,但胆碱摄入量高时血中胆碱水平有升高趋势;AUMC分别为 5 979.06和10 899.78 mg/(kg·h),剂量提高 1 倍,AUMC 提高了0.82%,提示过量的胆碱进入血液后,并未完全被机体吸收。
胆碱在血液中的寿命、在体内的分布和转运入胞都是胆碱代谢途径中的关键环节[24]。饲粮胆碱在进入肠道前即被分解代谢,未被分解的游离胆碱在整个小肠都可被吸收,后随血液运送至全身[25-26]。胆碱吸收入血后,随血液分布至全身后进入代谢环节。胆碱的代谢途径主要为3种:氧化为甜菜碱、磷脂酰胆碱或乙酰胆碱的合成。在代谢过程中,通过关键酶的调节,各途径相互补偿和制约,保证了胆碱的代谢平衡[27]。当然,饲粮中胆碱的丰盈程度是动物机体胆碱代谢的重要因素。杨永明等[19]用浸提去除胆碱的饲粮饲喂大鼠发现,肝脏胆碱水平降低的同时,细胞膜的磷脂含量也明显下降。胆碱利用扩散机制穿透质膜,或借助其转运蛋白,在机体各组织器官中蓄积。胆碱的运输主要依靠3个系统实现:低亲和力的易化扩散、高亲和力的Na+依赖载体运输以及中等亲和力的Na+独立运输体系。以上3个系统分别由3种特异性蛋白完成:胆碱低亲和力有机阳离子载体(OCTs)、胆碱高亲和力载体(CHT1)和中等亲和力胆碱载体样蛋白(CTL1)。CHT1和CTL1对胆碱的转运有更高的针对性和特异性。CHT1在神经系统聚集,几乎提供所有用于乙酰胆碱合成的原料;而CTL1则是胆碱最丰富的产物——磷脂酰胆碱的主要转运载体[28]。乙酰胆碱和磷脂酰胆碱的合成是胆碱运输的限速步骤。因此,胆碱转运载体直接决定着机体胆碱的利用及分布情况,也是维持机体胆碱平衡的重要保证。有研究发现,肾小管中的胆碱载体在维持机体分泌与重吸收血浆胆碱浓度的恒定方面扮演着重要作用[29]。在本试验条件下,2个剂量组的Tmax相同,说明胆碱在机体的吸收速度与其摄入的浓度无关,也进一步佐证了胆碱运转载体对胆碱吸收速率的关键作用。在本研究中,200 mg剂量组的 Vz/F和CL/F均显著高于400 mg剂量组,证明胆碱由血液进入组织的过程并非是单纯的依靠浓度梯度扩散,而需要运输蛋白来完成,并且扩散速率受运输蛋白的制约。然而血液中高浓度的胆碱反而降低了胆碱进入组织中的量。有研究显示,胆碱过量会导致鸡生长受阻,引起猪巨细胞性贫血。从生理方面来讲,胆碱过量会引起类似副交感神经过度兴奋,血管扩张、血压下降、心跳变慢、胃肠蠕动增强等现象,妨碍畜禽正常生长[30]。前人研究中不乏有关过量胆碱对动物机体不良影响的报道,在畜禽饲粮中添加添加适量的胆碱可提高动物的生长性能,但过高剂量会使生长性能下降[31-33],研究者大多认为是过量的胆碱阻碍了机体对钙、磷等其他营养物质的吸收所致[5]。结合本试验结果,过量添加氯化胆碱降低动物生长性能的原因可能与胆碱的运输速率受抑制有关,但高浓度氯化胆碱如何抑制膜蛋白的转运尚未见报道。
氯化胆碱作为目前最常用最经济的甲基供体,经常在畜禽饲粮中超量添加以期更高的生产性能,但忽略了动物机体对胆碱的利用率以及由此造成的浪费。本次试验提示,尽管无外源补充,肉鸡体内仍可稳定持续地合成胆碱,但量非常有限,通过饲料额外添加时必要的。但并非越多越好。本试验中,虽然400 mg/kg剂量组进入血液的有效成分较多,但200 mg/kg剂量组胆碱在体内的分布较广,血液中的胆碱容易进入细胞或脂肪组织中,参试物在体内存留时间较长,消除缓慢,更利于肉鸡体内物质的生物合成。由此可见,虽然口服400 mg/kg氯化胆碱可增加进入机体循环胆碱的相对数量,但无法提高机体对胆碱的利用效率。可见,9周龄肉鸡饲粮中添加750 mg/kg胆碱时利用率较高,但添加1 500 mg/kg时对其发挥正常作用有负面影响。因此,盲目地增加氯化胆碱的添加量并非明智之举。
4 结论
本试验提示,单靠增加剂量来提高胆碱生物利用度,不仅不能达到预期目的,反而会增加机体的负担,造成资源的浪费。
[1] MICHAEL D V.Choline’s key role in poultry diet revisited:choline plays many important metabolic roles in poultry,and to maximize the bird’s growth or performance,the diet must contain choline[J].Feedstuffs,2010,82(5):1-3.
[2] BAKER D H,CZARNECKI G L.Transmethylation of homocysteine to methionine:efficiency in the rat and chick[J].Journal of Nutrition,1985,115(10):1291-1299.
[3] 李建亚.胆碱的生理功能和饲料添加[J].中国饲料,1990(2):28-30.
[4] FEEDAP.Scientific Opinion on safety and efficacy of choline chloride as a feed additive for all animal species[J].EFSA Journal,2011,9(9):2353-2367.
[5] 蔡辉益,文杰,齐广海,等.鸡的营养[M].4版.中国北京:中国农业科学技术出版社,2007:205-211.
[6] 中华人民共和国卫生部.GB/T 5413.20—1997婴幼儿配方食品和乳粉胆碱的测定[S].北京:中国标准出版社,1997.
[7] 薛静.离子色谱法和高效液相色谱法测定奶粉中胆碱含量的研究[D].硕士学位论文.长春:东北师范大学,2008:18-26.
[8] 李媛媛,薛静,李莹倩,等.离子色谱法测定婴幼儿乳粉中的胆碱含量[J].食品科技,2008,33(12):267-270.
[9] 丁永胜,牟世芬.离子色谱法测定饲料中氯化胆碱和三甲胺的含量[J].色谱,2004,22(2):174-176.
[10] 郑洪国,宁张磊,梁立娜.离子色谱法检测氯化胆碱及杂质胺/铵的含量[J].饲料工业,2009,30(5):26-28.
[11] 黄丽,刘京平,容晓文.在线渗析—离子色谱法直接测定奶粉中胆碱[J].中国卫生检验杂志,2008,18(3):444-445,457.
[12] LAIKHTMAN M,ROHRER J S.Determination of choline in infant formula by ion chromatography[J].Journal of AOAC International,1999,82(5):1156 -1162.
[13] 中华人民共和国国家质量监督检验检疫总局.GB/T17481—2008预混料中氯化胆碱的测定[S].北京:中国标准出版社,2008.
[14] 中华人民共和国国家质量监督检验检疫总局.HG/T 2941—2004饲料级氯化胆碱的测定[S].北京:中国标准出版社,2004.
[15] BREMER J,GREENBERG D M.Biosynthesis of choline in vitro[J].Biochimica et Biophysica Acta,1960,37(1):173-175.
[16] CREWS F T,HIRATA F,AXELROD J.Identification and properties of methyltransferases that synthesize phosphatidylcholine in rat brain synaptosomes[J].Journal of Neurochemistry,1980,34(6):1491-1498.
[17] BLUSZTAJN J K,ZEISEL S H,WURTMAN R J.Synthesis of lecithin (phosphatidylcholine)from phosphatidylethanolamine in bovine brain[J].Brain Research,1979,179(2):319-327.
[18] WURTMAN R J,CANSEV M,ULUS I H.Choline and its products acetylcholine and phosphatidylcholine[M]//LAJTHA A,TETTAMANTI G,GORACCI G.Handbook of Neurochemistry and Molecular Neurobiology:Neural Lipids.Berlin Heidelberg:Springer-Verlag,2010:443-501.
[19] 杨永明,卢德勋,甄玉国.胆碱及其应用[J].饲料博览,2001(3):38-41.
[20] SAVENDAHL L,MAR M H,UNDERWOOD L E,et al.Prolonged fasting in humans results in diminished plasma choline concentrations but does not cause liver dysfunction[J].The American Journal of Clinical Nutrition,1997,66(3):622-625.
[21] HIRSCH M J,GROWDON J H,WURTMAN R J.Relations between dietary choline or lecithin intake,serum choline levels,and various metabolic indices[J].Metabolism,1978,27(8):953-960.
[22] ZEISEL S H,DA COSTA K-A,FRANKLIN P D,et al.Choline,an essential nutrient for humans[J].The FASEB Journal,1991,5(7):2093-2098.
[23] KLEIN J,KÖPPEN A,LÖFFELHOLZ K.Regulation of free choline in rat brain:dietary and pharmacological manipulations[J].Neurochemistry International,1998,32(5/6):479-485.
[24] DEGANI H,ELIYAHU G,MARIL N.Choline metabolism:meaning and significance[C]//Syllabus educational course international society for magnetic resonance in medicine,[S.l.]:[s.n.],2006.
[25] DE LA HUERGA J,POPPER H.Urinary excretion of choline metabolites following choline administration in normals and patients with hepatobiliary diseases[J].The Journal of Clinical Investigation,1951,30(5):463-470.
[26] NEILL A R,GRIME D W,DAWSON R M.Conversion of choline methyl groups through trimethylamine into methane in the rumen[J].Biochemical Journal,1978,170(3):529-535.
[27] JACOBSR L,STEAD L M,DEVLIN C,et al.Physiological regulation of phospholipid methylation alters plasma homocysteine in mice[J].Journal of Biological Chemistry,2005,280(31):28299-28305.
[28] MICHEL V,YUAN Z,RAMSUBIR S,et al.Choline transport for phospholipid synthesis[J].Experimental Biology and Medicine,2006,231(5):490-504.
[29] DANTZLER W H,EVANS K K,WRIGHT S H.Basolateral choline transport in isolated rabbit renal proximal tubules[J].Pflügers Archiv,1998,436(6):899-905.
[30] 倪玉姣.低能量水平下商品蛋鸡胆碱适宜需要量的研究[D].硕士学位论文.郑州:河南农业大学,2012:9.
[31] SOUTHERN L L,BROWN D R,WERNER D D,et al.Excess supplemental choline for swine[J].Journal of Animal Science,1986,62(4):992-996.
[32] VACHHRAJANI K D,SAHU A P,DUTTA K K.Excess choline availability:a transient effect on spermatogenesis in the rat[J].Reproductive Toxicology,1993,7(5):477-481.
[33] 周源,冯国强,李丹丹,等.黄羽肉鸡对胆碱的需要量研究[J].中国家禽,2011,33(3):14-17.

