动脉粥样硬化性脑梗死患者CXCL16TNF-α血清水平的相关研究
刘 丹 张 伟 孙洪英 董向力 王贵喜 贾 璐 李新辉 张 佳 杨 静
包头医学院第一附属医院神经内科 包头 014010
·论著·
动脉粥样硬化性脑梗死患者CXCL16TNF-α血清水平的相关研究
刘 丹 张 伟 孙洪英 董向力 王贵喜 贾 璐 李新辉 张 佳 杨 静
包头医学院第一附属医院神经内科 包头 014010
目的 探讨血清CXC型趋化因子配体16(CXC ligand 16,CXCL16)、肿瘤坏死因子a(tumor necrosis Factor-α,TNF-α)水平与动脉粥样硬化性脑梗死的关系。方法 采用酶联免疫吸附法检测120例急性动脉粥样硬化性脑梗死患者血清CXCL16、TNF-α水平,与75例健康对照者进行比较。结果 脑梗死组血清CXCL16、TNF-α水平均显著高于对照组(P<0.05)。脑梗死患者病情严重程度各组的血清CXCL16水平差异有统计学意义(P<0.05),而TNF-α水平差异无统计学意义(P>0.05),且血清CXCL16水平与脑梗死患者病情严重程度呈等级正相关(r=0.434,P=0.000)。梗死灶大小各组和梗死部位各组的血清CXCL16、TNF-α水平差异均无统计学意义(P>0.05)。联表卡方检验的相关分析得出,血清CXCL16、TNF-α水平均与发生动脉粥样硬化性脑梗死呈正相关(C=0.475,P=0.000,C=0.252;P=0.001)。脑梗死急性期血清CXCL16水平与脑梗死各危险因素及TNF-α水平之间无显著相关性(P>0.05)。结论 血清CXCL16、TNF-α水平在动脉粥样硬化性脑梗死急性期升高,与脑梗死的发生、发展密切相关。血清CXCL16水平可作为预测动脉粥样硬化性脑梗死发病、评估病情和判断预后的可靠生物学标记物之一。
脑梗死;CXC型趋化因子配体16;肿瘤坏死因子α
脑梗死是由于多种原因导致的脑血管病变,脑组织缺血、缺氧从而造成神经功能缺损的一类疾病,其发病率、致死率、致残率高,严重危害人类健康。目前,已知炎症是动脉粥样硬化(atherosclerosis,As)的重要病理生理学机制[1]。趋化因子是一类小分子分泌蛋白,在炎症和免疫应答过程中起重要作用,是联系炎症与As发生的枢纽[2]。近年来,在人As损伤部位的巨噬细胞、平滑肌细胞和血管内皮细胞中发现一种新的趋化因子,命名为CXC配体16(CXCL16)[3-4]。研究表明,CXCL16与As的发生发展密切相关,且其表达受TNF-α等的依赖性调节[3-5]。已熟知TNF-α是体内重要的炎性细胞因子,而脑梗死主要病因是动脉粥样硬化,炎症反应又参与了脑梗死的病理生理机制。本研究采用病例对照研究方法,探讨CXCL16、TNF-α血清水平与急性脑梗死的可能关系,以期为急性脑梗死的诊断、预防和治疗提供科学依据。
1 资料与方法
1.1 一般资料 选择2012-09—2013-06在我科连续住院的急性动脉粥样硬化性脑梗死患者(发病1周内),不包括腔隙性梗死和脑栓塞患者,均符合全国第4届脑血管病学术会议通过的诊断标准,并经头颅CT或MRI检查证实。有严重感染、恶性肿瘤、结缔组织病以及1a内患组织损伤疾病,如心肌梗死,重大外科手术及接受免疫抑制剂治疗者除外。同期选择我院体检中心体检的健康人群作为对照组。入组者均为包头市长住居民,均为汉族,彼此无亲缘关系。病例组120例,男73例,女47例;平均年龄(62.43±11.72)岁。对照组75例,男45例,女30例;平均年龄(61.69±9.68)岁。2组年龄、性别差异无统计学意义(P>0.05),具有可比性。由表1可见,与对照组比较,脑卒中组吸烟者比例、收缩压、舒张压、空腹血糖、甘油三酯、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)、血小板水平增高,差异有统计学意义(P<0.05),总胆固醇水平虽增高,但差异无统计学意义(P>0.05)。
1.2 研究方法
1.2.1 血液标本收集与测定:病例组患者在入院第2天06:00空腹采集静脉血4mL,离心后取血清,放于-30℃低温冰箱中保存待测CXCL16和TNF-α血清浓度。检测方法采用酶联免疫吸附法,试剂盒是美国RD公司分装,操作过程按试剂盒说明。对照组在体检当天亦空腹采血,保存和检测方法同上。
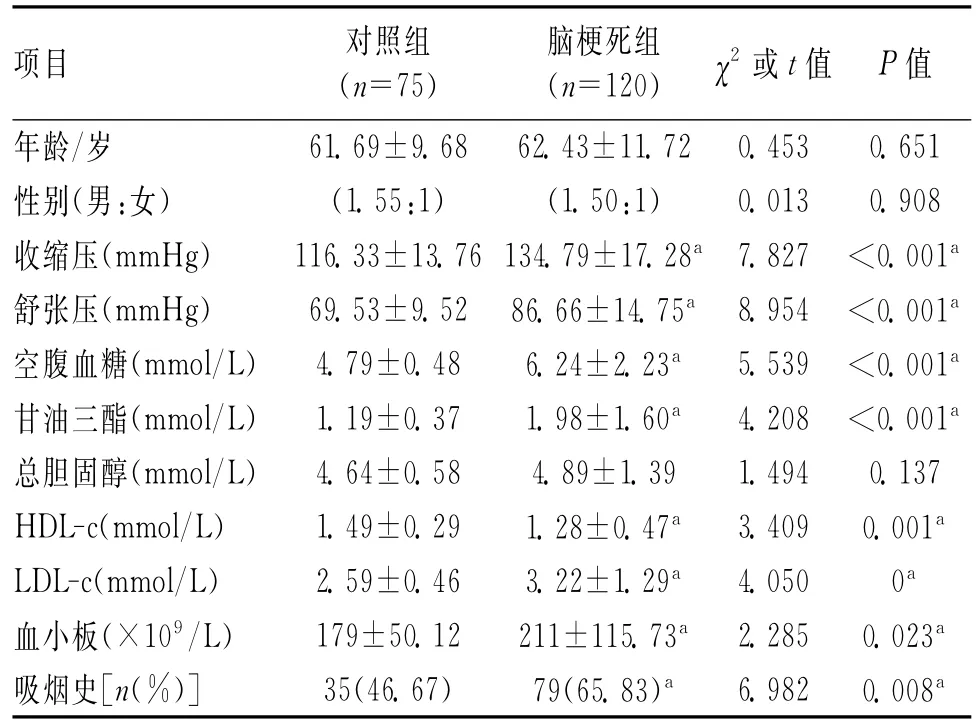
表1 2组一般资料比较
1.2.2 病例登记:登记内容包括:(1)患者一般资料:包括姓名、性别、年龄、职业、民族、住院号、地址、联系电话等;(2)既往情况:既往病史及健康状况、吸烟饮酒史;(3)住院情况:包括入院日期、入院NIHSS评分、实验室血液学检验值、颈部血管超声、头颅影像结果、出院日期、并发症等。
1.2.3 脑梗死病情严重程度分组:病例组根据美国国立卫生院神经功能缺损评分(NIHSS)标准在入院第1天进行评分,分为轻型组(<4分)、中型组(4~10分)、重型组(>10分)。
1.2.4 病灶大小分组:测量责任病灶最大层面的病灶长径。分为大梗死组(>5cm)、中梗死组(3~5cm)、小梗死组(<3cm)。多发性梗死则只计算最大责任病灶的最大层面的长径。
1.2.5 梗死灶部位分组:根据责任病灶所在部位分为皮质梗死、皮质下梗死、皮质+皮质下梗死、脑干、小脑梗死5组。
1.3 统计学方法 应用SPSS 17.0软件包进行统计学处理。计数资料,如研究对象的性别构成、吸烟、饮酒例数的比较采用卡方检验;计量资料,如总胆固醇、三酰甘油和血清CXCL 16、TNF-α水平等符合正态分布,用±s表示,多个独立样本的比较用方差分析,2组比较用t检验。两因素相关性用Peason直线相关分析和列联表卡方检验的相关分析,等级相关性用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 病例组和对照组血清CXCL16、TNF-α水平比较 病例组血清CXCL16、TNF-α水平均显著高于对照组(t=5.984,P=0.000;t=2.715,P=0.007)。见表2。
表2 2组血清CXCL16、TNF-α水平比较(±s)

表2 2组血清CXCL16、TNF-α水平比较(±s)
注:与对照组比较,aP<0.05
组别 n CXCL16(ng/mL) TNF-α(pg/mL)病例组 120 0.250±0.195a 4.098±7.998a对照组750.091±0.151 1.572±1.149
2.2 脑梗死患者不同病情严重程度各组血清CXCL16、TNF-α水平比较 脑梗死患者120例,患者病情严重程度在入院第1天根据NIHSS评分标准分为轻型组70例,中型组26例,重型组24例。由轻型到中、重型组,患者血清CXCL16水平逐渐增高,且3组间比较差异均有统计学意义(P<0.05)。血清TNF-α水平3组间比较差异无统计学意义(P>0.05)。见表3。
表3 脑梗死患者不同病情严重程度各组血清CXCL16、TNF-α水平比较(±s)
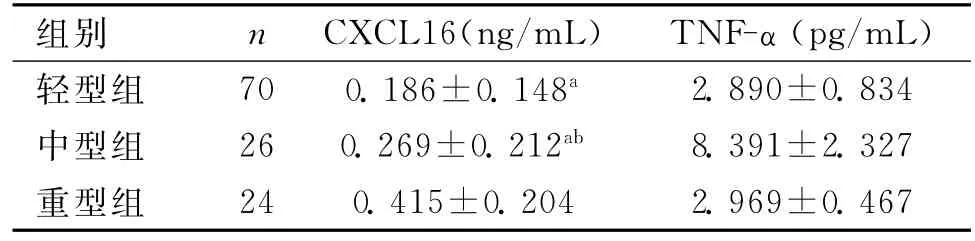
表3 脑梗死患者不同病情严重程度各组血清CXCL16、TNF-α水平比较(±s)
注:与重型组比较,aP<0.05;与轻型组比较,bP<0.05
组别 n CXCL16(ng/mL) TNF-α(pg/mL)轻型组 70 0.186±0.148a2.890±0.834中型组 26 0.269±0.212ab 8.391±2.327重型组24 0.415±0.204 2.969±0.467
2.3 脑梗死患者不同病灶大小各组血清CXCL16、TNF-α水平比较 脑梗死患者根据病灶大小分为小梗死组51例,中梗死组40例,大梗死组29例。3组间血清CXCL16、TNF-α水平比较差异无统计学意义(P>0.05)。见表4。
表4 脑梗死患者不同病灶大小各组血清CXCL16、TNF-α水平比较(±s)
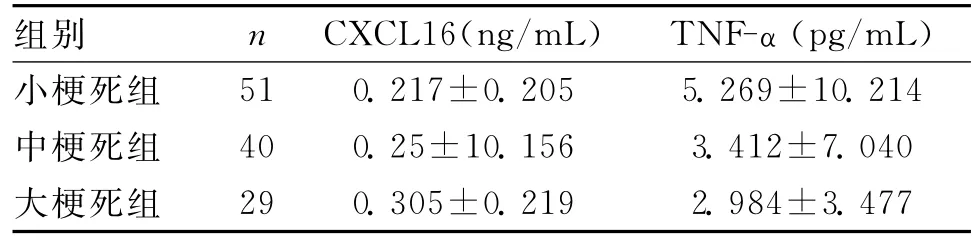
表4 脑梗死患者不同病灶大小各组血清CXCL16、TNF-α水平比较(±s)
组别 n CXCL16(ng/mL) TNF-α(pg/mL)小梗死组51 0.217±0.205 5.269±10.214中梗死组 40 0.25±10.156 3.412±7.040大梗死组29 0.305±0.219 2.984±3.477
2.4 脑梗死患者不同梗死灶部位各组血清CXCL16、TNF-α水平比较 脑梗死患者根据责任病灶所在部位分为皮质梗死3例,皮质下梗死64例,皮质+皮质下梗死31例,脑干梗死15例,小脑梗死7例。3组间血清CXCL16、TNF-α水平差异比较无统计学意义(P>0.05)。见表5。
表5 脑梗死患者不同梗死部位各组血清CXCL16、TNF-α水平比较(±s)

表5 脑梗死患者不同梗死部位各组血清CXCL16、TNF-α水平比较(±s)
组别 n CXCL16(ng/mL)TNF-α(pg/mL)皮质梗死组3 0.230±0.134 2.025±0.915皮质下梗死组 64 0.272±0.196 3.723±7.147皮质+皮质下梗死组31 0.247±0.222 3.363±5.447脑干梗死组 15 0.206±0.166 8.721±14.768小脑梗死组7 0.157±0.126 1.761±2.939
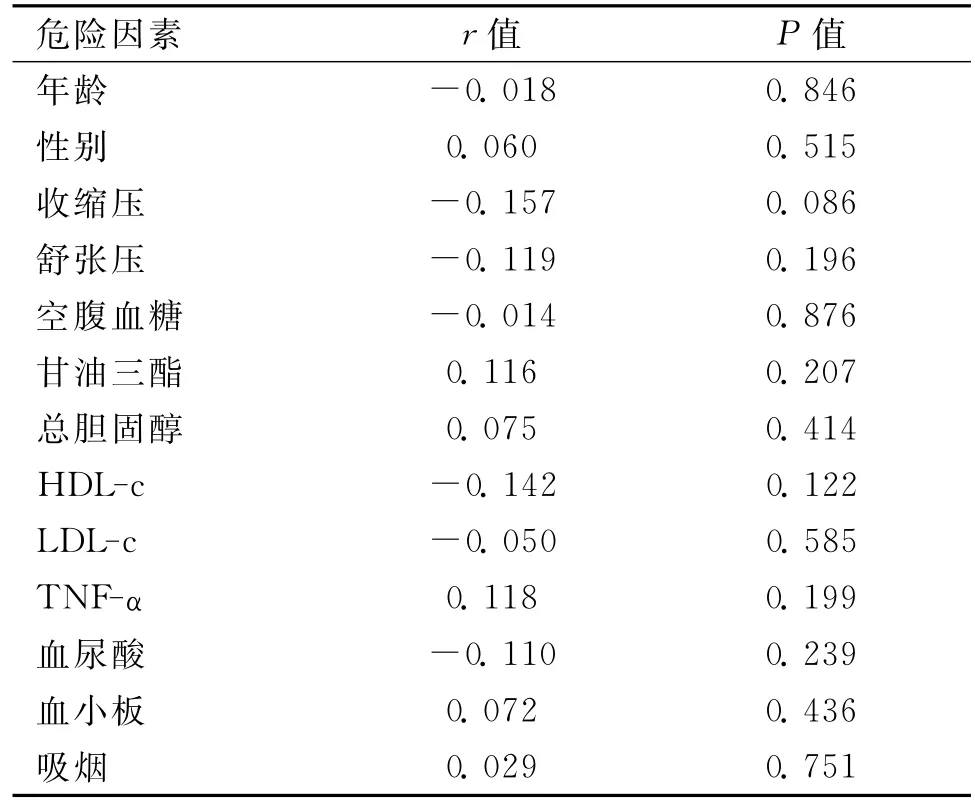
表6 病例组血清CXCL16水平与脑梗死各危险因素及TNF-α的相关性
2.5 相关分析 病例组和对照组的血清CXCL16、TNF-α水平分段,进行列联表卡方检验的相关分析得出,血清CXCL16水平与发生动脉粥样硬化性脑梗死呈正相关(C=0.475,P=0.000),血清TNF-α水平与发生动脉粥样硬化性脑梗死呈正相关(C=0.252,P=0.001)。血清CXCL16水平与动脉粥样硬化性脑梗死患者病情严重程度各组进行Spareman相关分析显示,二者呈等级正相关(r=0.434,P=0.000)。
2.6 血清CXCL16与脑梗死各危险因素及TNF-α水平的相关性 动脉粥样硬化性脑梗死急性期血清CXCL16水平与脑梗死各危险因素及TNF-α水平之间无显著相关性(P>0.05)。见表6。
3 讨论
2000年Matlourbian等[6]和Wilbanks等[7]发现了一种新的趋化因子——CXCL16,是一类跨膜蛋白分子,属于CXC趋化因子亚家族,同时具有CC家族和CX3C家族趋化因子的特征。CXCL16蛋白由254个氨基酸组成,分子量约为30 000。CXCL16存在两种形式,即可溶分泌型和膜结合型,不仅具有趋化因子的功能,而且还有清道夫受体的作用。CXCR6是其唯一受体。
近年研究发现,CXCL16与动脉粥样硬化密切相关。主要通过以下方面的病理生理作用参与动脉粥样硬化的发生、发展。(1)可溶分泌型CXCL16主要通过与T淋巴细胞表面的CXCR6结合,对T淋巴细胞起趋化作用,促使T淋巴细胞向动脉粥样硬化部位迁移[8]。As病变部位的T淋巴细胞可产生和分泌多种细胞因子,如白细胞介素、趋化因子、生长因子、肿瘤坏死因子以及多种酶,进而激活内皮细胞,促进平滑肌细胞增殖和斑块形成、进展[9-10]。T淋巴细胞还可促进基质金属蛋白酶的激活[11],而后者可促使纤维帽降解和斑块破裂,从而加剧As进展和斑块不稳定性。(2)介导巨噬细胞对oxLDL的摄取,参与As细胞内脂质聚集,促使巨噬细胞形成泡沫细胞。(3)还能作为一种血管源性因子诱导血管形成[12]。在As斑块内,大量新生血管形成浸润至病灶,促进斑块发生、发展,甚至诱发斑块出血和斑块破裂[13-14],成为在动脉粥样硬化性疾病中的核心事件。(4)强烈趋化激活CD8+T细胞,CD8+T细胞的激活会引发As斑块部位细胞的凋亡。
临床研究表明,CXCL16参与了动脉粥样硬化的发生发展。吕永清等[15]采用实时定量RT-PCR方法检测颈动脉斑块组和健康组外周血单个核细胞CXCL16及其受体CXCR6基因表达情况。结果显示颈动脉斑块组比健康组CXCL16及其受体CXCR6基因表达水平显著增高。颈动脉粥样硬化是全身As的局部体现,说明CXCL16是动脉硬化发生的危险因素之一。
本文结果显示,脑梗死急性期血清CXCL16水平显著高于对照组(P<0.05),血清CXCL16与发生动脉粥样硬化性脑梗死呈正相关(C=0.475,P=0.000),且血清CXCL16水平与脑梗死患者病情严重程度呈等级正相关(r=0.434,P=0.000),CXCL16水平越高,脑梗死患者病情越重,均提示血清CXCL16水平升高与脑梗死的发生、发展密切相关,但血清CXCL16水平升高与脑梗死病灶大小和部位无关。由于As是脑梗死的主要病因,我们推测,血清CXCL16可能通过参与As发生和发展过程而促进脑梗死的发生、发展。脑梗死组血清CXCL16表达水平与脑梗死各传统危险因素及TNF-α水平均无显著相关性,提示血清CXCL16表达水平不受各危险因素影响而独立起作用。
肿瘤坏死因子(TNF-α)是一种具有广泛生物学功能的多肽类细胞因子,不仅介导抗肿瘤及调节机体的免疫功能,是一种重要的免疫细胞因子,又是一种重要的炎性细胞因子,在感染性疾病中具有重要的病理生理作用[16]。
脑梗死的病理生理机制很复杂,目前仍不完全清楚,其中涉及血脑屏障的破坏、氧自由基的大量释放、炎症免疫反应、兴奋性氨基酸的毒性作用、细胞内钙超载、细胞凋亡等方面。炎症反应是重要的损伤机制之一[17]。而As发生发展的病理学过程中,炎症反应也发挥至关重要的作用。
我们的研究结果显示,脑梗死急性期血清TNF-α水平显著高于对照组(P<0.05),与辛雅萍等[18]研究结果一致,进一步分析得出,血清TNF-α水平与发生动脉粥样硬化性脑梗死呈正相关(C=0.252,P=0.001),但与脑梗死患者病情严重程度、梗死灶大小和梗死部位无显著相关。表明血清TNF-α水平升高与脑梗死的发生密切相关,参与了脑梗死的病理生理过程。
综上所述,血清CXCL16、TNF-α水平在动脉粥样硬化性脑梗死急性期升高,与脑梗死的发生、发展密切相关。血浆CXCL16、TNF-α水平与发生动脉粥样硬化性脑梗死有很好的相关性,可作为预测动脉粥样硬化性脑梗死发病、评估病情和判断预后的可靠生物学标记物,为疾病的调查研究、诊断和治疗提供帮助。但我们的研究仅对血清可溶性CXCL16、TNF-α进行研究,且病例数量有限,临床有待进一步深入研究CXCL16、TNF-α与脑梗死的关系以及二者在人体内更为详尽的作用机制。
[1]Hansson GK.Inflammation,atherosclerosis,and coronary artery disease[J].N ENGL J Med,2005,352(16):1 685-1 695.
[2]Barlic J,Murphy PM.Chemokine regulation of atherosclerosis[J].J Leukoc Biol,2007,82(2):226-236.
[3]Wilbanks A,Zondlo SC,Murphy K,et al.Expression cloning of the STRL33/BONZO/TYMSTR ligand reveals elements of CC,CXC,and CX3Cchemokines[J].J Immunol,2001,166(8):5 145-5 154.
[4]Shimaoka T,Nakayama T,Fukumoto N,et al.Cell surfaceαnchored SR-PSOX/CXC chemokine ligand 16mediates firm adhesion of CXC chemokine receptor 6-expressing cells[J].J Leukoc Biol,2004,75(2):267-274.
[5]Wuttge DM,Zhou X,Sheikine Y,et al.CXCL16/SR-PSOX is an interferon-gamma-regulated chemokine and scavenger receptor expressed in atherosclerotic lesions[J].Arterioscler Thromb Vasc Biol,2004,24(4):750-755.
[6]Matloubian M,David A,Engel S,et al.A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo[J].Nat Immunol,2000,1(4):298-304.
[7]Wilbanks A,Zondlo SC,Murphy K,et al.Expression cloning of the STRL33/BONZO/TYMSTR ligand reveals elements of CC,CXC,and CX3Cchemokines[J].J Immunol,2001,166(8):5 145-5 154.
[8]徐焕宾,熊思东.新发现的CXCL16趋化凶子及其受体[J].生命的化学,2003,23:8-10.
[9]Koenig W,Khuseyinova N.Biomarkers of atherosclerotic plaque instability and rupture[J].Arterioscler Thromb Vasc Biol,2007,27(1):15-26.
[10]Patel DN.Bailey SR,Gresham JK,et al.TLR4-NOX4-αP-1 signaling mediates lipopolysaccharide-induced CXCR6expression in human aortic smooth muscle cells[J].Biochem Biophys Res Commun,2006,347(4):1 113-1 120.
[11]Hansson GK,Libby P.The immune response in atherosclerosis:a double-edged sword[J].Nat Rev lmmunol,2006,6(7):508-519.
[12]Zhuge X,Murayama T,Arai H,et al.CXCL16is a novel angiogenic factor for human umbilical vein endothelial cells[J].Biochem Biophys Res Commun,2005,331(4):1 295-1 300.
[13]Mofidi R,Crotty TB,McCarthy P,et al.Association between plaque instability,angiogenesis and symptomatic carotid occlusive disease[J].Br J Surg,2001,88(7):945-950.
[14]Ross JS,Stagliano NE,Donovan MJ,et al.Atherosclerosis and cancer:common molecular pathways of disease development and progression[J].Ann N Y Acad Sci,2001,947:27l-293.
[15]吕永清,卜培莉.CXCL16与动脉粥样硬化的关系研究[J].中国实用医药,2009,4(9):60-62.
[16]徐德忠主编.分子流行病学[M].北京:人民军医出版社,1998:32-36.
[17]肖珍珍,李惠勉.舒洛地特对大鼠脑缺血再灌注损伤后脑组织的保护作用及机制[J].中国实用神经疾病杂志,2011,14(3):30-32.
[18]辛雅萍,张苏河,赵志刚,等.2型糖尿病合并脑梗死患者血清脂联素水平测定及临床意义[J].中国实用神经疾病杂志,2006,9(4):61-62.
(收稿2014-05-12)
Study on serum CXCL16 and TNF-αlevels in patients with the atherosclerosis cerebral infarction
Liu Dan,Zhang Wei,Sun Hongying,Dong Xiangli,Wang Guixi,Jia Lu,Li Xinhui,Zhang Jia,Yang Jiang
Department of Neurology,the First Affiliated Hospital of Baotou Medical College,Baotou014010,China
Objective To investigate the changes of serum CXCL16and TNF-αlevels in patients with acute atherosclerosis cerebral infarction.Methods The serum CXCL16and TNF-αlevels were measured by enzyme-linked immunosorbent assay(ELISA)in 120patients with acute atherosclerosis cerebral infarction compared with 75healthy controls.Results The serum CXCL16and TNF-αlevels in patient group were significantly higher than those in control group(P<0.05).The serum CXCL16level had significant difference in each of patient group which was divided into minor group,moderate group and severe group according to the severity of disease(P<0.05)and was hierarchically positively correlated with severity of cerebral infarction(r=0.434,P=0.000),while TNF-αlevel had no statistical difference(P>0.05).The serum CXCL16,TNF-αlevels had no significant difference in each group of patient group classified by volume and area of infarction(P>0.05).It was shown that both serum CXCL16and TNF-αlevel were positively related to atherosclerosis cerebral infarction(C=0.475,P=0.000,C =0.252;P=0.001)by related analysis of contingency table and chi-square test.Conclusion The serum CXCL16,TNF-αlevels increased in acute atherosclerosis cerebral infarction,which a closely related with the occurrence and development of cerebral infarction.The serum CXCL16level is regarded as one of the reliable biological marker in predicting incidence,estimating condition and evaluating prognosis of atherosclerosis cerebral infarction.
Cerebral infarction;CXC ligand 16;Tumor necrosis factor-α
R743.33
A
1673-5110(2015)05-0001-04
内蒙古自治区自然科学基金项目(编号:2013MS1174);内蒙古自治区高等学校科学技术研究一般项目(编号:NJZY13245);包头市社会发展科技支撑项目(编号:2012S2006-04-08)

