饲料中添加牛至精油对红罗非鱼货架期的影响
郑宗林,朱成科,Delbert M. GATLIN III
(1.西南大学荣昌校区水产系,水产动物繁育和健康养殖研究中心,重庆 402460;2.美国德州农工大学野生动物和鱼类科学及营养系,美国 德克萨斯 77840-2258)
饲料中添加牛至精油对红罗非鱼货架期的影响
郑宗林1,2,朱成科1,Delbert M. GATLIN III2
(1.西南大学荣昌校区水产系,水产动物繁育和健康养殖研究中心,重庆 402460;2.美国德州农工大学野生动物和鱼类科学及营养系,美国 德克萨斯 77840-2258)
研究牛至精油对红罗非鱼品质和货架期的影响。以空白添加组为对照,分别在对照组饲料中添加250、500、1 000、2 000 mg/kg牛至精油,经过20 周养殖实验,红罗非鱼在4 ℃条件下冷藏0、7、14、21 d,在每个冷藏时间点检测红罗非鱼物理化学特性、微生物定性定量分析和感官分析评估,以判定其腐败程度。结果表明,牛至精油添加对红罗非鱼体色、硫代巴比妥酸反应值和总挥发性盐基氮含量有显著的影响。1 000、2 000 mg/kg牛至精油可有效降低冷藏鱼片的肠杆菌和大肠菌群数量。感官分析表明,红罗非鱼体的质量指数与牛至精油的添加量没有显著相关,对照组的货架期为16 d,牛至精油组的货架期为18 d,但与添加量无显著相关。
牛至精油;日粮补充;红罗非鱼;货架期
食品脂质过氧化指标是食物质量安全和品质的重要评判标准之一。脂质氧化后的产物会产生难闻的气味,降低产品的感官质量。水产品因其较高含量的不饱和脂肪酸而易导致脂肪氧化。由于目前人们对食品安全的关注程度日益增强,使用化学合成抗氧化剂逐渐被限制。因此,从食品安全的角度出发,选择一些天然植物和香料作为天然抗氧化剂显得至关重要[1]。
牛至精油是从天然植物牛至(O. heracleoticum L.)的叶片和花朵中提取,主要成分为酚类化合物,其中香芹酚和麝香草酚含量可达78.27%[2],在所有天然原料中抗氧化性能首屈一指[3]。纯的精油比其任意单一成分的抗氧化性能都要强,其主要成分抗氧化活性比较如下:麝香草酚>香芹>γ-松油烯>月桂烯>芳樟醇>p-对伞花烃>苎>1,8-桉树脑>α-蒎烯[4]。这种活性的差异与芳香环和羟基的数目和位置相关[5]。
同时,牛至精油的抗菌活性也是其促进动物生长、抑制病原微生物增殖从而控制冷藏食物的腐败变质的重要作用机理[2]。麝香草酚的抗菌活性超过其他含芳香类化合物的植物,如迷迭香和鼠尾草[6]。牛至精油对革兰氏阳性菌的效果略优于革兰氏阴性菌,而且在低pH值、低温和低溶氧的情况下效果更好[7]。牛至精油主要含疏水性化合物,对细菌细胞质膜具有较高的亲和性,降低细菌细胞膜的稳定性,通过破坏细胞膜而导致细菌细胞内容物流出、膜电位改变等方式逐步抑制和杀灭细菌[8]。
目前已有关于牛至精油或其主要成分在食品加工或贮藏保护方面的研究[9-11],也有在饲料中添加精油后对养殖动物活体及加工产品的抗氧化、抗菌等方面的研究[12-13],但缺乏对牛至精油深入全面的研究和探讨。本研究通过在红罗非鱼(Oreochromis niloticus× O. mossambicus)饲料中加入不同剂量的牛至精油后,养殖20 周后,对冷藏的全鱼及肌肉进行质量评估,以期为探讨牛至精油对水产品的品质保障提供参考资料。
1 材料与方法
1.1 材料
1.1.1 鱼和养殖条件
实验鱼来自重庆市铜梁热带鱼繁殖场。生长实验在15 个长方形水泥池(1.5 m×0.8 m×0.7 m,每缸水体积为600 L)组成的循环水养殖系统进行,水流速率0 L/h。每天测一次水温,每3 d检测水体溶氧和氨氮。实验期间水温范围为25~28 ℃;饲养用水为经曝气过的自来水,水体中溶氧保持在6 mg/L以上,氨氮在0.4 mg/L以下,pH 7.5。
1.1.2 实验饲料
实验设计5 种等氮等能(34.5%蛋白质、2.98 kcal/g能量)饲料,以动植物混合蛋白为饲料蛋白源。基础饲料配方见表1,添加牛至精油配制成5 种水平梯度的实验饲料,饲料干物质中牛至精油添加量分别为0、250、500、1 000、2 000 mg/kg,记为OEO250、OEO500、OEO1000和OEO2000。由于牛至精油的疏水性,将牛至精油先溶在菜油中,然后再与其他组分混合。饲料原料过40 目筛混匀,压粒制成直径4 mm 颗粒40 ℃烘干后置于冰箱备用。
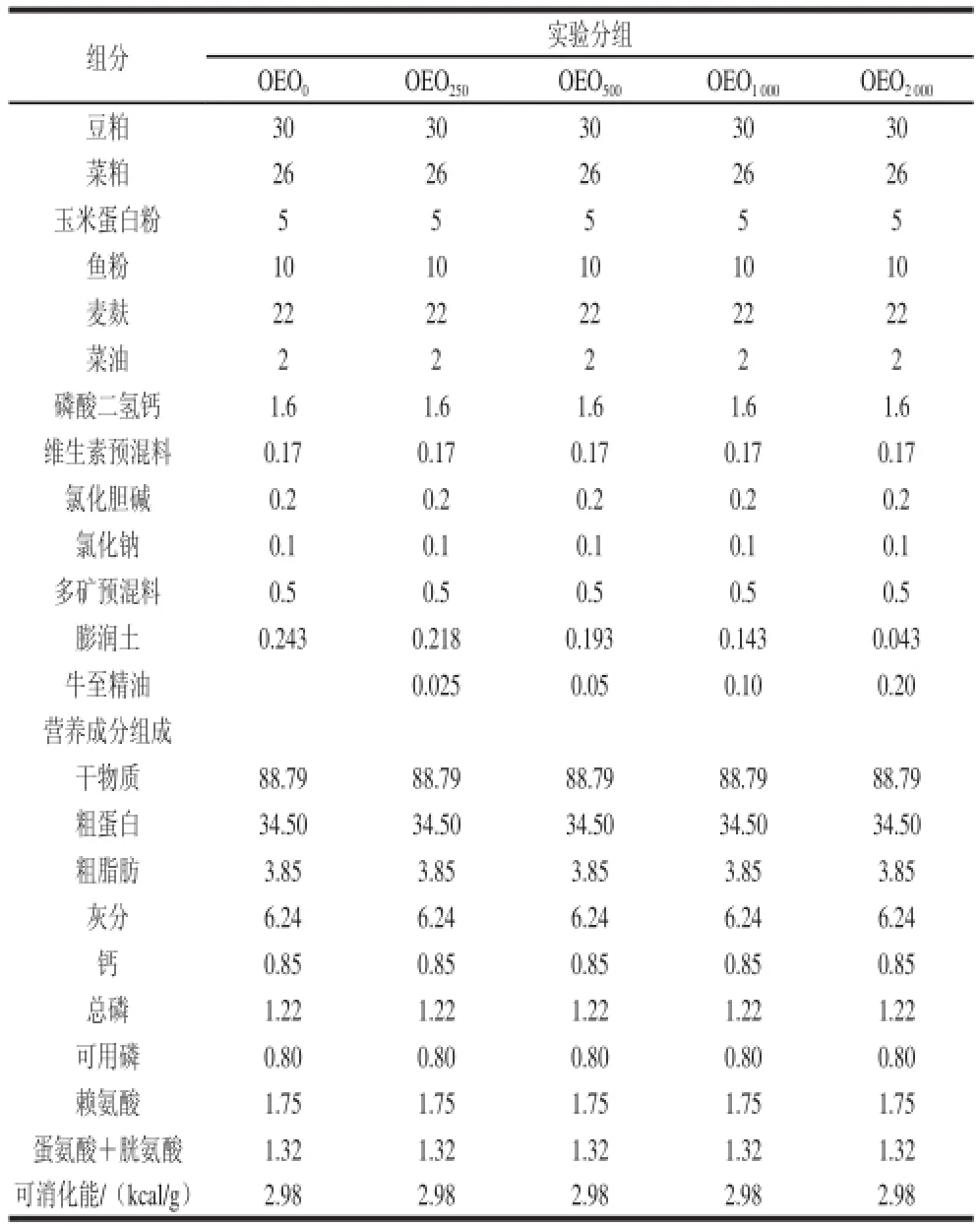
表1 饲料配方组成和营养成分分析Table1 Formulation and proximate composition of the diets %
1.2 方法
1.2.1 实验分组
将初质量(230±13.5) g共300 尾鱼随机安排在15 个水泥池中,每个水泥池20 尾,每组3 个重复。饱食投喂,每天投喂2 次。每月每组取6 尾鱼进行取样称质量。养殖实验进行140 d,直到达商品规格(485±35.5)g。实验结束后,所有鱼都进行称质量,每池选择6 尾鱼低温致死后解剖取样。全鱼冷藏(4±1)℃贮藏0、7、14、 21 d,每组18 尾鱼平均放在2 个封闭的聚苯乙烯盒(带排水孔)中,盒中冰和鱼的比重保持在1∶1。
1.2.2 指标测定
1.2.2.1 色差的测定
采用WSC-100型色差仪对鱼片进行L*、a*、b*值的测定。根据测得的a*、b*的值计算色彩饱和度C*ab值[14]。
C*ab=(a*2+b*2)1/2
每个样品对3 个部位进行颜色检测,第1个部位是尾鳍靠背部附近,第2个部位是尾鳍靠泄殖孔附近,第3个部位是腹部。这3 个部位测定结果的平均值即为该样品的最后色度计算值。
1.2.2.2 细菌总数的测定
取10 g肌肉样品加入90 mL含1%蛋白胨的培养基中,旋涡混合器振荡5 min 后,按10 倍稀释法稀释成102、103、104等稀释液,再接种到合适的培养基上。根据GB 4789.1—2010《食品卫生微生物学检验总则》测定方法进行。采用稀释倒平板法,并用平板计数琼脂计算可培养的需氧菌数量。将接种后的平皿置于30 ℃培养箱中培养72 h,测定总的可培养嗜温菌数量;将接种后的平皿置于15 ℃培养箱中培养120 h,测定总的可培养嗜冷菌数量;将稀释样品加入10 mL经45 ℃融化的紫红胆盐葡糖糖琼脂中,37 ℃培养24 h,具有紫色环的较大克隆即为肠杆菌。样品稀释液涂布于显色培养基(Oxoid code CM 956),并在37 ℃培养24 h,计数大肠菌群和大肠杆菌(Escherichia coli);选择性培养基加入头孢噻啶,20 ℃培养48 h,计数假单胞菌。所有的菌落形成单位(CFU/g)以对数形式表示。
1.2.2.3 硫代巴比妥酸反应(thiobarbituric acid reactive substances,TBARS)值和挥发性盐基氮(total volatile base nitrogen,TVB-N)值的检测
按照Botsoglou等[15]的方法测定TBARS值,以丙二醛(malondialdehyde,MDA)含量表示。MDA通过酸溶液提取,再与硫代巴比妥酸孵育后进行紫外检检测。TVB-N值的测定方法参考欧盟规范[16]进行。
1.2.2.4 感官评定
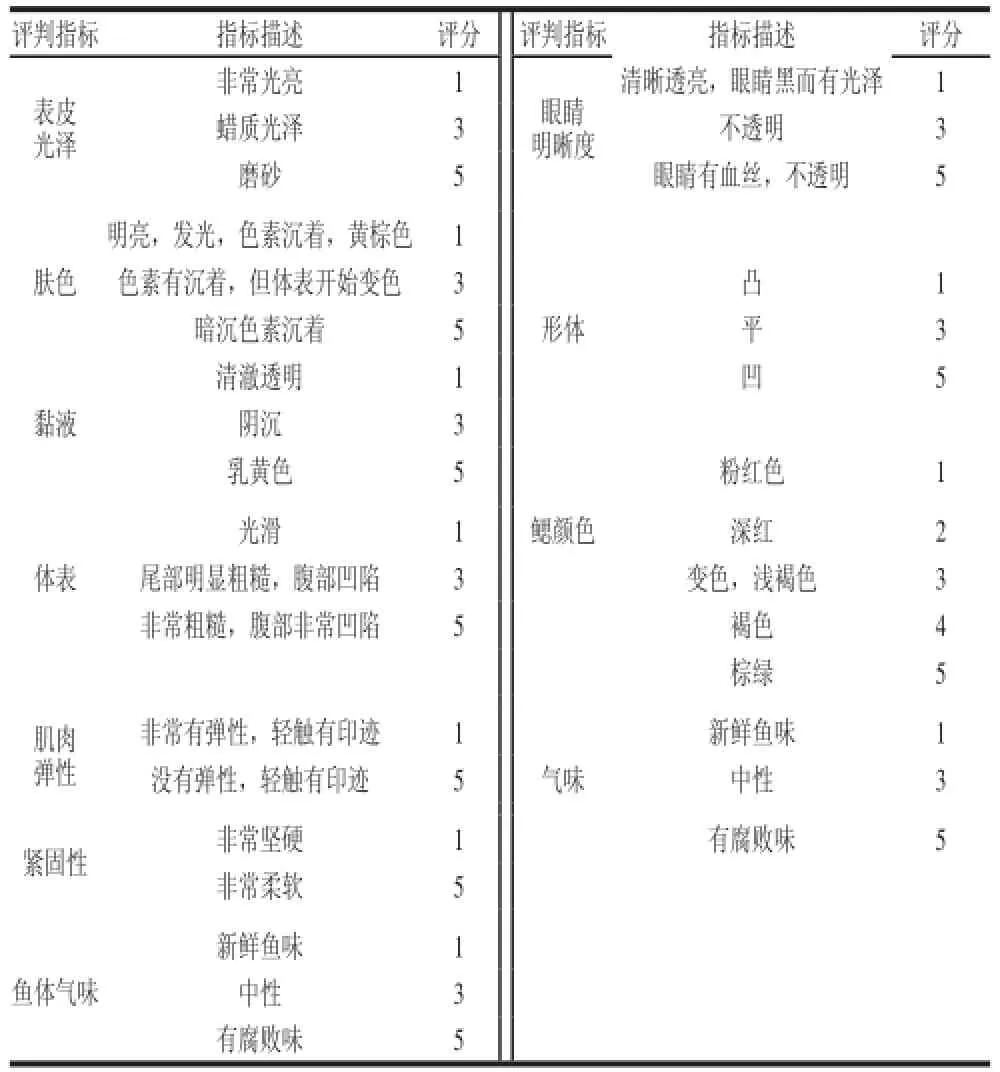
表2 冷藏红罗非鱼的感官评判标准Table2 Criteria for sensory evaluation of O. niloticus × O. mossambiiccuuss during ice storage
采用感官评定中的选择检验法,同时参考欧盟水产品质量检验规程[16]进行。由6 位实验小组成员对实验样品进行11 个参数按照表2的评判标准,对质量、感官的好坏进行评分(1~5 分)。每组取4 尾鱼进行评估,1 分表示鱼体新鲜,分数增加表示鱼体腐败程度增加。每个参数的得分总和平均数即为最后的质量参数。
1.3 数据分析
2 结果与分析
2.1 牛至精油对红罗非鱼贮藏期间理化性质的影响
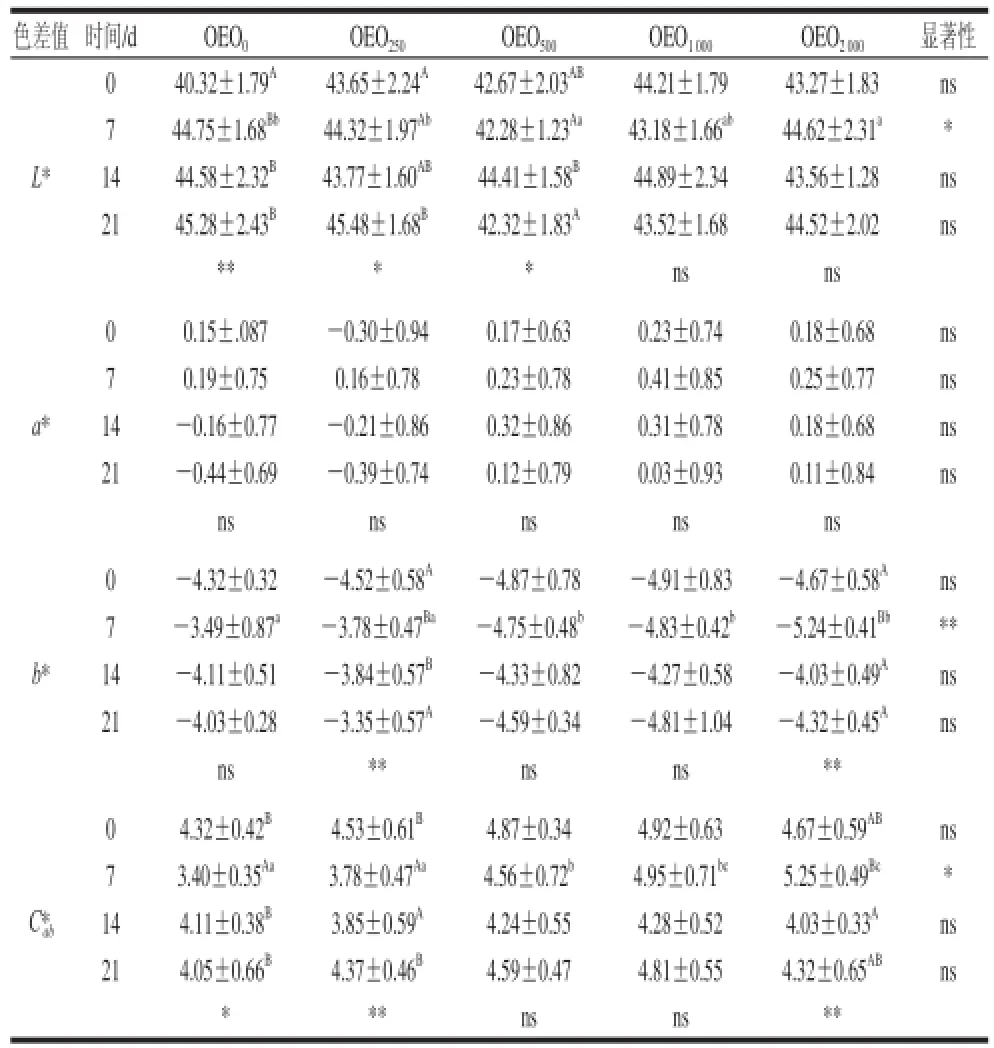
表3 牛至精油对冷藏红罗非鱼片肌肉颜色的影响Table3 Color measurements taken on fi llets during storage on ice for O. niloticus × O. mossambicus fed different doses of oregano essential oil
由表3可知,红罗非鱼片颜色的变化很好地体现了其质量变化的趋势,Pavlidi等[18]认为,L*值随冷藏时间延长的可能原因是系水力、自溶及肌肉蛋白质降解导致的光折射率的变化所致。蛋白质的腐败对亮度值都有同向影响,均有同一冷藏时间内随牛至精油的添加而逐渐减小的趋势。a*值的变化均不显著,这可能是由于罗非鱼片的冷藏过程中氧化程度不严重,这与Harmre等[19]的研究结果一致。L*值在冷藏期间有缓慢增加趋势。a*值在冷藏期间均没有显著变化,b*值在冷藏期内逐渐降低,C*ab值的变化趋势与b*值基本一致。牛至精油对a*值也没有显著影响,但有增加b*值和C*ab值的趋势。在冷藏的第7天,随着牛至精油添加量的增加,b*值和C*ab值呈显著提高趋势,其中OEO2000组达到最大值。
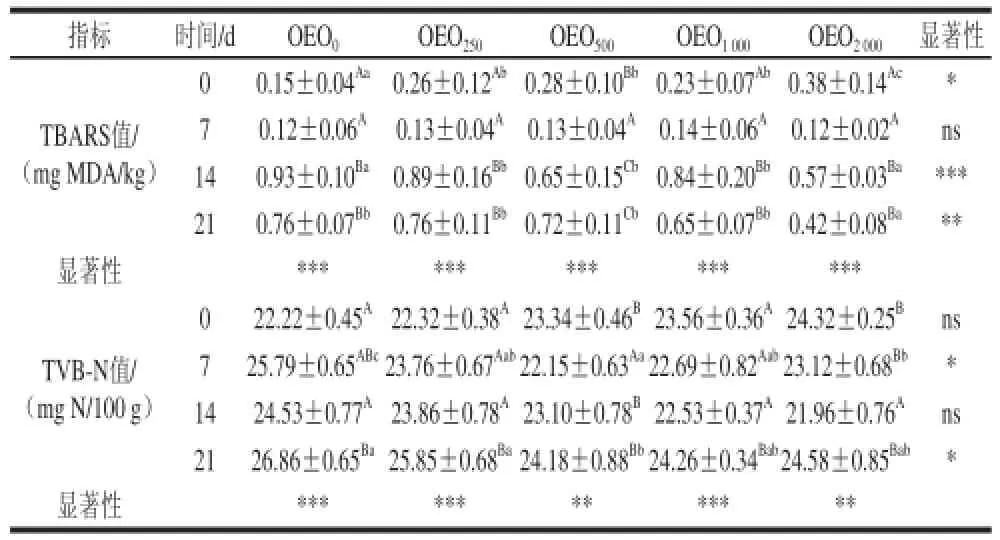
表4 牛至精油对冷藏红罗非鱼片的TBARS、TVB-N值的影响Table4 Color measurements taken on fi llets during storage on ice for O. nilotiiccuuss × O. mossambicus fed different doses of oregano essential oil
由表4可知,脂质过氧化参数TBARS值或过氧化值是判定食品氧化程度的重要参数[20-22]。所以,正常情况下在冷藏过程中过氧化值逐渐增加,这在本实验中也得到验证。同时发现,牛至精油的添加具有明显地抑制罗非鱼片肌肉过氧化的进程,TBARS值证实了这一特点,而类似的研究结果也在金头鲷(Sparus aurata)中发现[23-24]。Alarcon-Rojo等[25]发现添加1 g/kg的牛至精油,猪屠宰后经过16 d的冷藏观察发现,肉品质和脂质抗过氧化能力都得到明显提高。TVB-N值也是判定鱼片品质的一个重要参数,欧盟委员会根据不同的水产品种类,确定了鱼片的TVB-N限值范围(25、30、35 mg N/100 g)[26]。但这个跟多个因素有关,如养殖类型、饲料、鱼龄,是全鱼还是去除内脏冷藏等[27-28],因为内源性酶也会参与这些物质的形成[29],直接与鱼片内的微生物活动相关[27]。麝香草提取物也发现可以降低烟熏或真空保存的蓝鱼[29]和虹鳟[30]鱼片的TVB-N值,并提出麝香草提取物具有抑菌机能。表4的结果提示,TBARS值介于0.12~1.00 mg MDA/kg之间,MDA值随冷藏时间的延长,呈现显著上升趋势。冷藏0 d时,牛至精油的TBARS值还比对照组显著提高;冷藏7 d时,各组间没有显著差异,而到第14、21天时,随牛至精油的添加量逐渐加大,罗非鱼肌肉中TBARS值呈现显著下降趋势,以OEO2000组最低。TVB-N值随冷藏时间延长显著提高,到第21天各组均达最大值。第14、21天,牛至精油有显著降低TVB-N值的趋势。
2.2 牛至精油对红罗非鱼贮藏期间微生物菌群分析
由表5可知,在本实验中,也发现使用牛至精油后,嗜热菌和嗜冷菌都有降低的趋势。牛至具有很好的抗菌活性的原因是有高含量的酚类化合物,特别是香芹酚[31-33]。而牛至精油具有更强的抗菌活性,主要化学组分为香芹酚和百里香酚[7,34]。Abdel-Latif等[35]将牛至精油直接添加于饲料中,结果发现牛至精油可以促生长、增强抗氧化活性,以及提高抗感染能力,类似实验Zheng等[2]在斑点叉尾鮰、Gracia-Valenzuela等[36]在对虾的研究中也有发现。Wu等[37]发现在白鲢皮明胶-壳聚糖膜中添加牛至精油后,其抗菌活性明显提高。在本实验中发现,牛至精油对肠杆菌和大肠菌群在冷藏期的数量变化影响非常显著,冷藏14~21 d后,均发现1 000、2 000 g/kg组的肠杆菌和大肠菌群数量较其他组明显下降,但假单胞菌却有比较明显的上升趋势。这种相反的效果可能是因为从鱼体分离的多株假单胞菌具有高黏合性的铁载体,相比其他细菌,会利用大部分的铁离子,而对其他细菌,如肠杆菌、大肠菌群和乳酸菌的生长造成抑制[38]。国际食品微生物分类委员会规定冷藏水产品的最高微生物检出量不能超过7 (lg(CFU/g)),在本实验中直到第21天,冷藏罗非鱼片的细菌含量也未超过这个标准。但感官分析却没有这么长的货架期,而消费者的感官质量评判是产品货架期的一个重要依据之一。冷藏期间,所有实验组各被检细菌均显著增加。从第7~21天细菌的增速明显加快,而0~7 d各组的几种测定细菌基本没有显著变化。在冷藏期结束时,耗氧嗜温菌总数和耗氧嗜冷菌总数都在7 (lg(CFU/g))左右,假单胞菌数都在5 (lg(CFU/g))左右,而肠杆菌及大肠菌群数都在1~2 (lg(CFU/g))左右。冷藏期14 d时,牛至精油对鱼片细菌都有显著影响,肠杆菌和大肠菌群数量都有显著下降,其中以OEO1000和OEO2000组最低;与此同时,嗜冷菌总数和假单胞菌数则随牛至精油的增加而呈快速增加趋势;冷藏期21 d时,牛至精油对鱼片各组被检细菌无显著影响。
2.3 牛至精油对红罗非鱼贮藏期间感官品质的影响
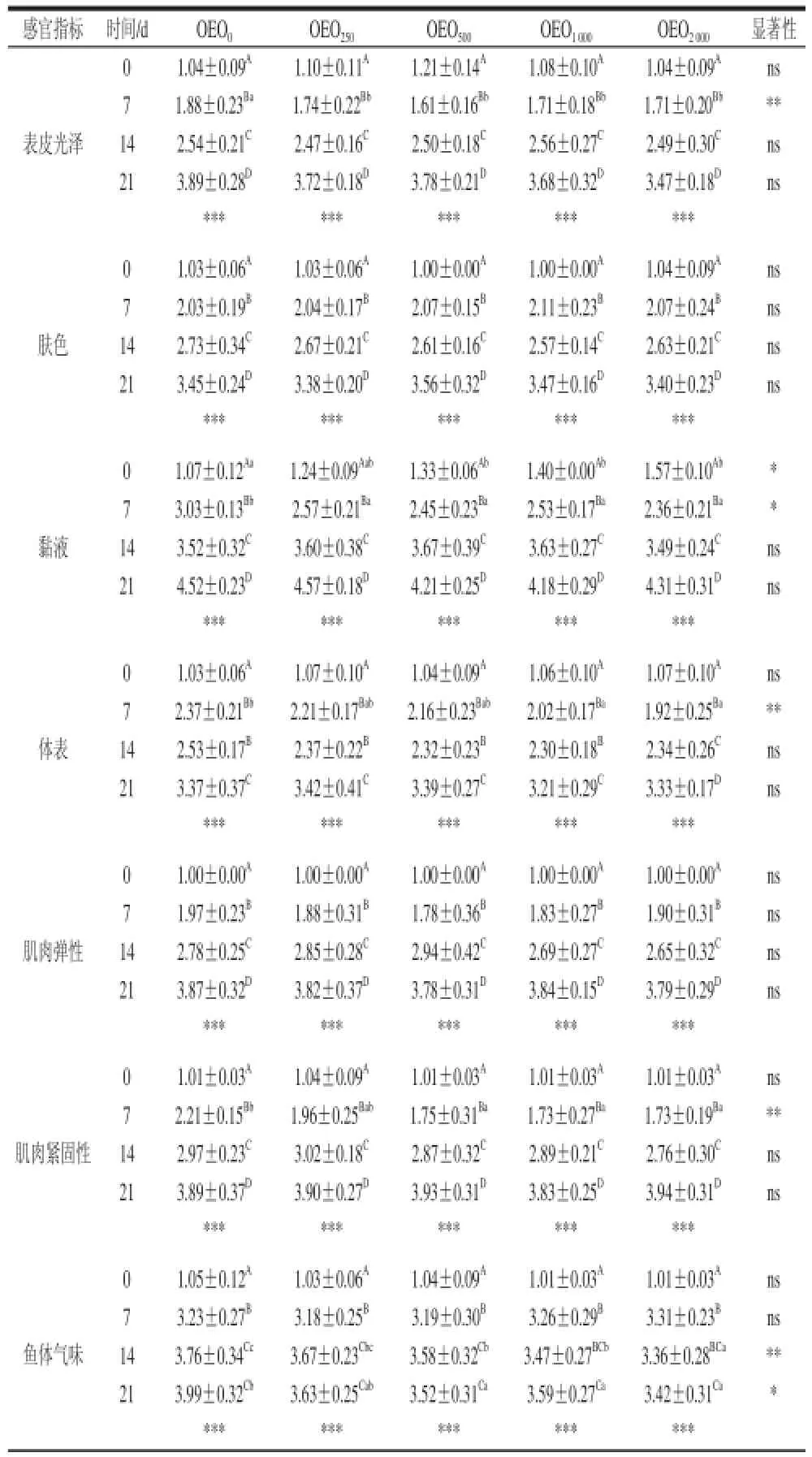
表6 牛至精油对红罗非鱼冷藏后感官评估结果Table6 Sensory evaluation off tilapia during storage on ice for O. niloticcuuss × O. mossambicus fed different doses of oregano essential oil
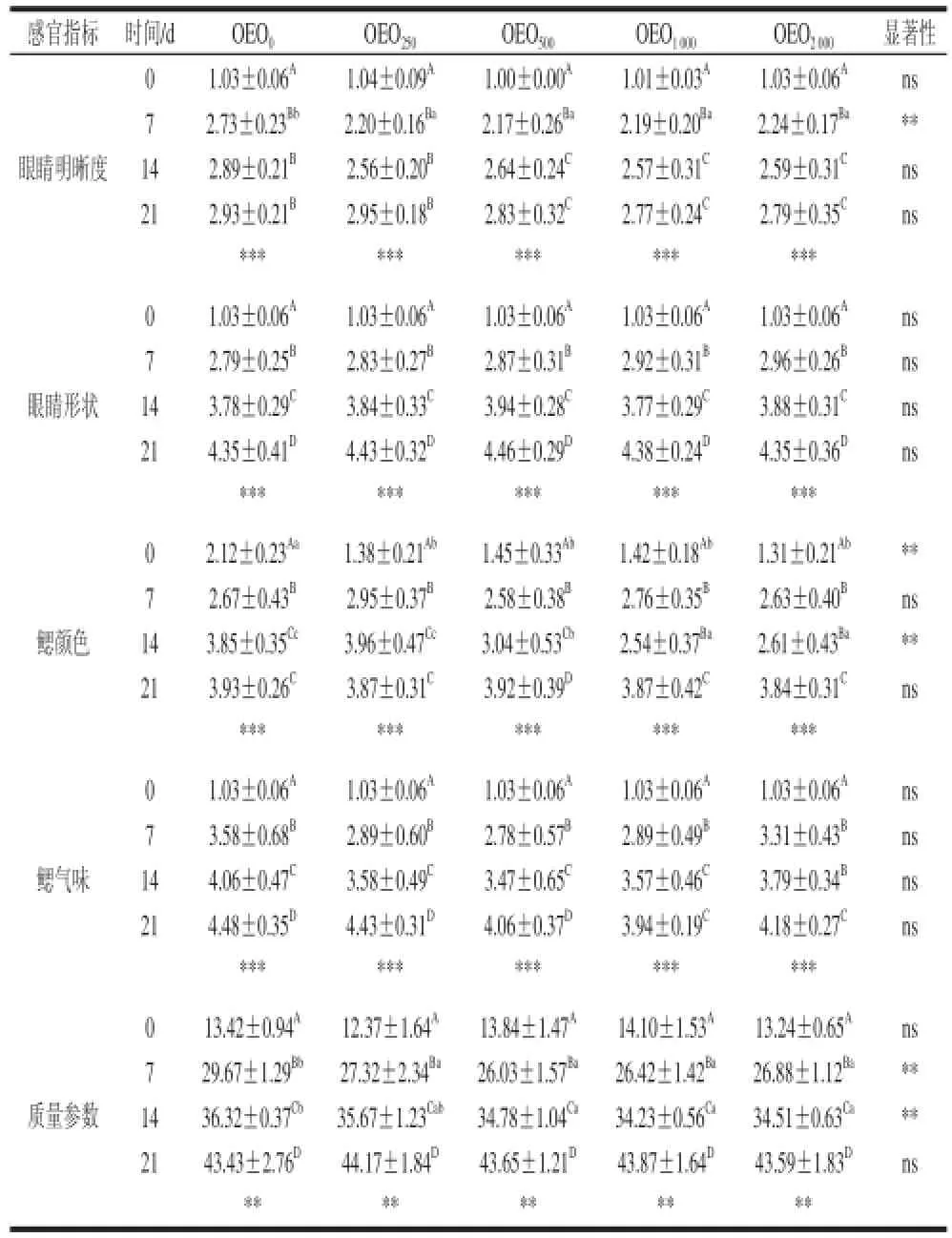
续表6
牛至精油对红罗非鱼冷藏后感官评估结果见表6。Hernández等[39]在饲料中加入不同剂量的麝香草提取物后,发现金头鲷的感官质量有明显提升;Alçiçek等[30]也发现了类似的效果。Kostaki等[11]发现麝香草提取物还会影响海鲈的气味和味道,同时延长货架期3 d。但值得注意的是,以上案例都是直接将提取物外用在鱼体上判定的,而本实验时直接加入饲料投喂鱼所获得的结果。牛至精油对水产品感官质量的提高(感官指数下降)可能的机理不仅是其抑制病原微生物生长,Zheng等[2]发现其还有提高水产动物抗氧化、增强水产动物非特异性免疫机能,Abdel-Latif等[35]在尼罗罗非鱼中也得到了验证。本实验发现牛至精油能保护黏液的脱离,而黏液也是提高鱼类免受细菌感染的重要屏障[40],但对于如何保持鱼片黏液的机制还需要进一步研究。
牛至精油还能改善鱼体的气味。在第0、7天时,各组之间没有显著差异,这表明牛至精油不改变鱼体的天然气味;但第14、21天时,OEO1000和OEO2000组跟对照组相比,可以显著降低鱼体气味的感官评分,表明牛至精油可能是通过降低导致鱼体恶臭的物质而其作用。本实验已经发现牛至精油可降低鱼体脂肪产生腐臭味的产生。实际上,鱼体气味在冷藏后期快速变差主要与假单胞菌的形成有密切关系,该过程包括了特定的一些鱼体腐败细菌,而这是产生恶臭味道的基础。
Mexis等[41]将虹鳟鱼片涂布牛至精油(0.4%)后发现,对照组的感官货架期为4 d,而牛至精油组为7~8 d。Álvarez等[24]根据金头鲷的冷藏的感官标准制定其货架期,货架期结束时的质量指数是根据38 个质量控制点计算而来,本实验采用了同一标准。根据此标准,利用线性回归所获得的数据,对照组的货架期为16 d,而实验组的货架期为18 d。这个数据联合质量指数可以得出牛至精油对提高红罗非肉冷藏期肉品质有一定帮助,但各添加量度组未体现显著差异。各实验组冷藏罗非鱼片感官评估的分值都随时间的延长而显著增加(表6)。高剂量牛至精油添加组的红罗非鱼体表黏液评分显著高于对照组,但到第7天,低剂量组和对照组的黏液评分快速上升,且对照组与高剂量组差异已达显著。冷藏前7 d,牛至精油对鱼体气味没有显著影响,但第14、21天的感官评估结果发现,鱼体气味评分随牛至精油的添加而显著降低,表示其新鲜度保持更好。对鳃颜色的评估结果也发现,冷藏开始时(0 d),牛至精油添加组的鳃颜色明显比对照组罗非鱼鳃要鲜红,到第14天评估时,仍然保持与第0天时一致的结果。而对于鳃的气味指标评估中,虽然各组没有显著差异,但能看到实验组鳃的新鲜度还是要高于对照组。从其他指标如体表、肌肉弹性、眼睛明晰度等都可以看出,对照组的评估分基本都高于牛至精油添加组。第7、14天,冷藏罗非鱼质量参数随牛至精油的添加量增加呈显著下降趋势。
3 结 论
本实验表明牛至精油加入饲料后对红罗非鱼具有较好的保护作用。牛至精油的添加对鱼片的物理化学参数和微生物数量等的影响并未反映到质量指数上,但诸如鱼体气味、鳃的颜色等,而这些特征却是提高消费者购买欲的几个重要指标。从前述实验数据总体分析表明,饲料中添加1 000 mg/kg的牛至精油,可以获得较好的鱼体感官品质,并延长红罗非鱼的货架期。
[1] YANISHLIEVA N V, MARINOVA E, POKORN J. Natural antioxidants from herbs and spices[J]. European Journal of Lipid Science and Technology, 2006, 108(9): 776-793.
[2] ZHENG Z, TAN J Y, LIU H, et al. Evaluation of oregano essential oil (Origanum heracleoticum L.) on growth, antioxidant effect and resistance against Aeromonas hydrophila in channel catfi sh (Ictalurus punctatus)[J]. Aquaculture, 2009, 292(3): 214-218.
[3] BOTSOGLOU N, FLOROU-PANERI P, BOTSOGLOU E, et al. The effect of feeding rosemary, oregano, saffron and a-tocopheryl acetate on hen performance and oxidative stability of eggs[J]. South African Journal of Animal Science, 2005, 35(3): 143-151.
[4] YOUDIM K, DEANS S, FINLAYSON H. The antioxidant properties of thyme (Thymus zygis L.) essential oil: an inhibitor of lipid peroxidation and a free radical scavenger[J]. Journal of Essential Oil Research, 2002, 14(3): 210-215.
[5] BREWER M. Natural antioxidants: sources, compounds, mechanisms of action, and potential applications[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(4): 221-247.
[6] IVANOVIC J, MISIC D, ZIZOVIC I, et al. In vitro control of multiplication of some food-associated bacteria by thyme, rosemary and sage isolates[J]. Food Control, 2012, 25(1): 110-116.
[7] BURT S. Essential oils: their antibacterial properties and potential applications in foods: a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253.
[8] SHAPIRO S, GUGGENHEIM B. The action of thymol on oral bacteria[J]. Oral Microbiology and Immunology, 1995, 10(4): 241-246.
[9] MAHMOUD B S, YAMAZAKI K, MIYASHITA K, et al. Bacterial microflora of carp (Cyprinus carpio) and its shelf-life extension by essential oil compounds[J]. Food Microbiology, 2004, 21(6): 657-666. [10] GOULAS A E, KONTOMINAS M G. Combined effect of light salting, modifi ed atmosphere packaging and oregano essential oil on the shelf-life of sea bream (Sparus aurata): biochemical and Sensory Attributes[J]. Food Chemistry, 2007, 100(1): 287-296.
[11] KOSTAKI M, GIATRAKOU V, SAVVAIDIS I N, et al. Combined effect of MAP and thyme essential oil on the microbiological, chemical and sensory attributes of organically aquacultured sea bass (Dicentrarchus labrax) fillets[J]. Food Microbiology, 2009, 26(5): 475-482.
[12] AHMADIFAR E, FALAHATKAR B, AKRAMI R. Effects of dietary thymol-carvacrol on growth performance, hematological parameters and tissue composition of juvenile rainbow trout, Oncorhynchus mykiss[J]. Journal of Applied Ichthyology, 2011, 27(4): 1057-1060.
[13] GIANNENAS I, TRIANTAFILLOU E, STAVRAKAKIS S, et al. Assessment of dietary supplementation with carvacrol or thymol containing feed additives on performance, intestinal microbiota and antioxidant status of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2012, 350: 26-32.
[14] CORZO O, BRACHO N, MARVAL J. Effects of brine concentration and temperature on color of vacuum pulse osmotically dehydrated sardine sheets[J]. LWT-Food Science and Technology, 2006, 39(6): 665-670.
[15] BOTSOGLOU N A, FLETOURIS D J, PAPAGEORGIOU G E, et al. Rapid, sensitive, and specifi c thiobarbituric acid method for measuring lipid peroxidation in animal tissue, food, and feedstuff samples[J]. Journal of Agricultural and Food Chemistry, 1994, 42(9): 1931-1937.
[16] REGULATION E. Council Regulation (EC) N 2406/96 of 26 November 1996 laying down common marketing standards for certain fishery products[J]. Official Journal of the European Union, 1996, 334(23): 1996.
[17] CHOW G C. Tests of equality between sets of coefficients in two linear regressions[J]. Econometrica: Journal of the Econometric Society, 1960, 28(3): 591-605.
[18] PAVLIDIS M, PAPANDROULAKIS N, DIVANACH P. A method for the comparison of chromaticity parameters in fi sh skin: preliminary results for coloration pattern of red skin Sparidae[J]. Aquaculture, 2006, 258(1): 211-219.
[19] HAMRE K, LIE Ø, SANDNES K. Development of lipid oxidation and fl esh colour in frozen stored fi llets of Norwegian spring-spawning herring (Clupea harengus L.). Effects of treatment with ascorbic acid[J]. Food Chemistry, 2003, 82(3): 447-453.
[20] RUFF N, FITZGERALD R, CROSS T, et al. The effect of dietary vitamin E and C level on market-size turbot (Scophthalmus maximus)fi llet quality[J]. Aquaculture Nutrition, 2003, 9(2): 91-103.
[21] HERN N M, PEZ M L, ALVAREZ A, et al. Sensory, physical, chemical and microbiological changes in aquacultured meagre (Argyrosomus regius) fillets during ice storage[J]. Food Chemistry, 2009, 114(1): 237-245.
[22] TUCKEY N P, FORGAN L G, JERRETT A R. Fillet colour correlates with biochemical status in Australasian snapper (Pagrus auratus) during storage in refrigerated seawater[J]. Aquaculture, 2012, 356: 256-263.
[23] CAKLI S, KILINC B, CADUN A, et al. Quality differences of whole ungutted sea bream (Sparus aurata) and sea bass (Dicentrarchus labrax) while stored in ice[J]. Food Control, 2007, 18(5): 391-397.
[24] ÁLVAREZ A, GARC A G B, GARRIDO M, et al. The infl uence of starvation time prior to slaughter on the quality of commercial-sized gilthead seabream (Sparus aurata) during ice storage[J]. Aquaculture, 2008, 284(1): 106-114.
[25] ALARCON-ROJO A D, PEA-GONZALEZ E, JANACUA-VIDALES H, et al. Meat quality and lipid oxidation of pork after dietary supplementation with oregano essential oil[J]. World Applycation Science Journal, 2013, 21(5): 665-673.
[26] COUTRELIS N. European Union food law update[J]. Journal of Food Science and Technology, 2006, 42: 121-143.
[27] KYRANA V R, LOUGOVOIS V P, VALSAMIS D S. Assessment of shelf-life of maricultured gilthead sea bream (Sparus aurata) stored in ice[J]. International Journal of Food Science and Technology, 1997, 32(4): 339-347.
[28] TEJADA M, HUIDOBRO A. Quality of farmed gilthead seabream (Sparus aurata) during ice storage related to the slaughter method and gutting[J]. European Food Research and Technology, 2002, 215(1): 1-7.
[29] TOSUN Ş Y, ULUSOY Ş, ÜRETENER G. The use of thyme and laurel essential oil treatments to extend the shelf life of bluefish (Pomatomus saltatrix) during storage in ice[J]. Journal für Verbraucherschutz and Lebensmittelsicherheit, 2011, 6(1): 39-48.
[30] ALÇIÇEK Z. The effects of thyme (Thymus vulgaris L.) oil concentration on liquid-smoked vacuum-packed rainbow trout (Oncorhynchus mykiss Walbaum, 1792) fillets during chilled storage[J]. Food Chemistry, 2011, 128(3): 683-688.
[31] 郑宗林, 金立志. 专利植物提取物对斑点叉尾鮰生长性能的研究[J].饲料研究, 2009(5): 63-66.
[32] HAMMER K A, CARSON C, RILEY T. Antimicrobial activity of essential oils and other plant extracts[J]. Journal of Applied Microbiology, 1999, 86(6): 985-990.
[33] DORMAN H, DEANS S. Antimicrobial agents from plants: antibacterial activity of plant volatile oils[J]. Journal of Applied Microbiology, 2000, 88(2): 308-316.
[34] PECARSKI D M, KNEŽEVΙĆ-JUGOVΙĆ Z D, DΙMΙTRΙJEVΙĆBRANKOVΙĆ S I, et al. Comparative analysis of the chemical composition and antimicrobal activities of some of Lamiaceae family species and Eucaliptus (Eucaliptus globules M.)[J]. Acta Periodica Technologica, 2014, 45: 201-213.
[35] ABDEL-LATIF H M, KHALIL R H. Evaluation of two phytobiotics, Spirulina platensis and origanum vulgare extract on growth, serum antioxidant activities and resistance of Nile tilapia (Oreochromis niloticus) to pathogenic Vibrio alginolyticus[J]. Aquaculture, 2013, 371(15): 99-117.
[36] GRACIA-VALENZUELA M, VERGARA-JIM N M, BAEZ-FLORES M, et al. Antimicrobial effect of dietary oregano essential oil against Vibrio bacteria in shrimps[J]. Archives of Biological Sciences, 2014, 66(4): 1367-1370.
[37] WU J, GE S, LIU H, et al. Properties and antimicrobial activity of silver carp (Hypophthalmichthys molitrix) skin gelatin-chitosan fi lms incorporated with oregano essential oil for fi sh preservation[J]. Food Packaging and Shelf Life, 2014, 83(2): 1513-1519.
[38] GRAM L, RAVN L, RASCH M, et al. Food spoilage-interactions between food spoilage bacteria[J]. International Journal of Food Microbiology, 2002, 78(1): 79-97.
[39] HERNÁNDEZ B A, GARCÍA M J, JORDÁN M D, et al. Study of the dose of thyme essential oil in feed to prolong the shelf life of gilthead seabream (Sparus aurata)[J]. Aquaculture Nutrition, 2014, 65(7): 68-81.
[40] 鄢庆枇, 陈强, 邹文政, 等. 不同环境条件对溶藻弧菌黏附大黄鱼肠黏液的影响[J]. 水产学报, 2006, 30(2): 254-259.
[41] MEXIS S, CHOULIARA E, KONTOMINAS M. Combined effect of an oxygen absorber and oregano essential oil on shelf life extension of rainbow trout fi llets stored at 4 ℃[J]. Food Microbiology, 2009, 26(6): 598-605.
Evaluation of the Dose of Oregano Essential Oil in the Feed to Prolong the Shelf Life of Oreochromis niloticus × O. mossambicus
ZHENG Zonglin1,2, ZHU Chengke1, Delbert M. GATLIN III2
(1. Fisheries Breeding and Healthy Cultivation Research Centre, Department of Veterinary Medicine, Rongchang Campus, Southwest University, Chongqing 402460, China; 2. Department of Wildlife and Fisheries Sciences and Faculty of Nutrition, College Station, Texas A&M University, Texas 77840-2258, USA)
The effect of oregano essential oil (OEO) from Origanum heracleoticum L. on the quality and shelf life of Oreochromis niloticus × O. mossambicus was studied. Five treatments were included in this trial, a control diet (OEO0) and four other diets (OEO250, OEO500, OEO1000and OEO2000) with 250, 500, 1 000 and 2 000 mg/kg of oregano essential oil, respectively. After 20 weeks of experimentation, the fi sh were stored on ice at 4 ℃ for 0, 7, 14 and 21 days, respectively. Physicochemical, microbiological and sensory analyses were carried out at each sampling point to determine the degree of deterioration. A dose-dependent effect was observed on the color, TBARS and TVB-N during the storage. Microbiological counts were lower for Enterobacteriaceae and coliforms at higher doses of oregano essential oil. The sensory analysis showed no signifi cant correlation between overall sensory quality of fi sh and oregano essential oil dose. The experimental diets extended the shelf life of Oreochromis niloticus× O. mossambicus from 16 to 18 days compared with the control diet, without signifi cant correlation with dose.
Origanum heracleoticum L.; dietary supplements; Oreochromis niloticus × O. mossambicus; shelf life
S984.1
A
1002-6630(2015)22-0203-07
10.7506/spkx1002-6630-201522039
2015-02-16
中央高校基本科研业务费专项(DJK2014C056);中国长江三峡集团公司科研项目(CT-12-08-01)
郑宗林(1978—),男,副教授,博士,研究方向为水产动物营养与疾病控制。E-mail:zhengzonglin@126.com

