分散液液微萃取-高效液相色谱法测定枸杞中α-生育酚
曹江平,刘世巍,解启龙,易宗慧,周继梅,张玉龙
(1.宁夏师范学院化学化工学院,宁夏 固原 756000;2.中国科学院山西煤炭化学研究所,煤转化国家重点实验室,山西 太原 030001)
分散液液微萃取-高效液相色谱法测定枸杞中α-生育酚
曹江平1,刘世巍1,解启龙2,易宗慧1,周继梅1,张玉龙1
(1.宁夏师范学院化学化工学院,宁夏 固原 756000;2.中国科学院山西煤炭化学研究所,煤转化国家重点实验室,山西 太原 030001)
建立基于分散液液微萃取样品前处理法,并 结合高效液相色谱紫外检测技术测定枸杞中α-生育酚的含量,考察影响分散液液微萃取的因素包括萃取剂和分散剂类型及用量、pH值、离子强度、萃取时间和萃取温度。方法的线性范围为100~50 000 μg/L,r=0.999 7。在最优条件下,日内和日间重复性分别为2.9%和6.5%, 检出限为3.1 μg/L,定量限为10.2 μg/L。并将该法成功应用于3 种市售枸杞中α-生育酚含量的测定,加标回收率为85.7%~106.3%,相对标准偏差为0.68%~4.6 2%。方法具有有机溶剂用量少、操作简单快捷、准确度和灵敏度高、重复性好等优点。
分散液液微萃取;枸杞;α-生育酚
VE,又名生育酚,为脂溶性维生素,自然界有(α-、β-、γ-、δ-生育酚)和(α-、β-、γ-、δ-生育三烯酚)8 种存在形式,其中以α-生育酚的生物活性最高。α-生育酚具有促进生育、抗氧化的作用,其广泛存在于植物油脂及其衍生物、水果、蔬菜和谷物中[1-4]。测定VE的含量是食品分析的重要项目之一,我国也制定了测定其含量的国标方法[5]。目前,食品中VE的提取方法主要是液液萃取法[5-6]、有机溶剂加热回流法[7]、超临界CO2萃取法[8]等。这些样品前处理方法出现较早,发展比较成熟,应用也很广泛,但是存在有机溶剂耗量大、操作繁琐、样品损失多、装置昂贵等缺点。检测方法主要有分光光度法[9]、分子荧光法[10]、电化学法[11]、气相色谱法[12]、高效液相色谱法[13-15]。
分散液液微萃取(dispersive liquid-liquid microextraction,DLLME)法是2006年由Rezaee等[16]提出的一种新型样品前处理技术,基于萃取剂、分散剂和水溶液3 组分溶剂系统,萃取时形成萃取剂/分散剂/样品溶液三相乳浊液体系,使分析物在样品溶液及萃取剂之间快速达到分配平衡而完成萃取。该方法集萃取与富集于一体,有机溶剂用量少,萃取时间短,具有很高的萃取效率和富集倍数[17-19]。目前,已广泛应用于环境水样中农药等污染物的检测[20-22],而极少用于食品中维生素的测定中。本实验采用皂化-DLLME样品前处理技术提取枸杞中的α-生育酚,同时结合高效液相色谱-紫外(high performance liquid chromatography-ultraviolet,HPLCUV)检测技术测定其含量,并将此法成功应用于市售枸杞中α-生育酚的检测。
1 材料与方法
1.1 材料与试剂
3 种枸杞样品 市购。DL-α-生育酚(纯度99.5%)美国Sigma公司;四氯化碳、氯苯、二氯甲烷、甲醇(均为色谱纯) 上海阿拉丁试剂公司;无水乙醇、抗坏血酸、盐酸、氯化钠、氢氧化钾均为分析纯;实验用水均为二次蒸馏水。
1.2 仪器与设备
1200高效液相色谱仪 美国安捷伦科技有限公司;KQ-5200E型超声波清洗器 昆山市超声波仪器有限公司;BT25S型电子天平 德国Sartorius公司;pH 213型酸度计 意大利Hanna公司;Direct-Q3型纯水仪 美国Millipore公司。
1.3 方法
1.3.1 对照品溶液的制备
准确称量α-生育酚10.0 mg(准确至0.1 mg),用甲醇溶解并定容至10 mL容量瓶中,配成质量浓度为1 mg/mL的α-生育酚标准储备液,4 ℃避光保存。
1.3.2 样品的制备与分析
1.3.2.1 皂化
准确称取5.0 g枸杞粉末于250 mL皂化瓶中,加50.0 mL无水乙醇,搅拌至分散均匀。依次加入0.5 g抗坏血酸、10.0 mL氢氧化钾溶液(1 g/mL),混匀。沸水浴回流30 min,皂化完成后立即放入冰水中冷却。5 000 r/min离心10 min,取上清液用二次蒸馏水定容到100.0 mL,用6 mol/L盐酸溶液调节pH值到7。
1.3.2.2 DLLME
移取4.0 mL皂化液于10 mL带旋帽的锥形离心管中,加入5.0 mL二次蒸馏水稀释后,加入100.0 μL四氯化碳萃取剂,轻摇5 min并离心(5 000 r/min)3 min,离心后萃取剂形成微小的液滴并沉积于离心管底部,用100 μL微量注射器吸取沉积相并确定用量,加入等用量的甲醇溶液稀释,供HPLC分析。
1.3.3 色谱条件
色谱柱:Diamonsil C18(100 mm×4.6 mm, 5 μm);流动相:V(甲醇)∶V(水)=98∶2;流速1.00 mL/min;进样量20 μL;紫外检测波长290 nm;柱温为室温。
1.3.4 线性范围、重复性、精密度、加标回收率、富集倍数
实验用外标法定量,取对照品溶液,用二次蒸馏水依次稀释为5 个不同质量浓度的α-生育酚标准溶液做点,拟合出回归方程用以定量分析样品中α-生育酚含量。重复性实验选用样品S1、S2,重复测试3 次,得到日内重复性,6 d连续测定,得到日间重复性;精密度实验在测定样品时的平行实验数据中得到;加标回收率实验对实际样品加入一定质量浓度标准溶液后测定回收情况,按公式(1)计算加标回收率,计算方法同文献[17]。

式中:Cs为加标后样品中α-生育酚总质量浓度/(μg/m L);C0为未加标样品中α-生育酚质量浓度/(μg/mL);Ca为加标质量浓度/(μg/mL);PF为富集倍数。
富集倍数用空白加标样品萃取后的质量浓度和萃取液质量浓度的比值,按公式(2)计算。

式中:Co为萃取后萃取液相中α-生育酚质量浓度/(μg/mL);Cw为未萃取样品中α-生育酚质量浓度/(μg/mL)。
2 结果与分析
2.1 DLLME条件优化
取皂化样品溶液按照1.3.2.2节方法进行萃取并上机分析,用于DLLME萃取条件的优化,对比各平行条件下萃取液分析所得峰面积选择最优条件。
2.1.1 萃取剂种类和用量的选择
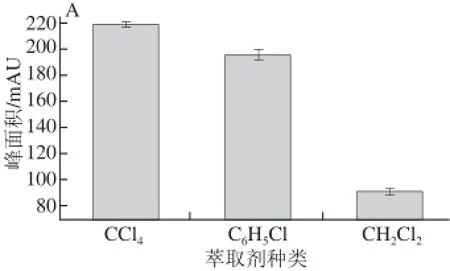
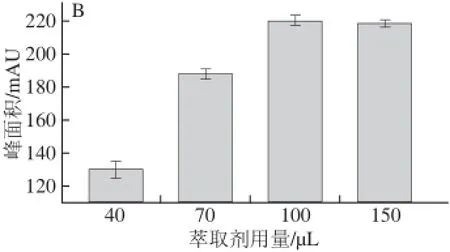
图1 萃取剂种类(A)、用量(B)对萃取率的影响Fig.1 Effect of type and volume of extraction solvents on extraction effi ciency
萃取剂的性质是影响D LLME萃取率的重要因素之一。萃取剂需满足的条件是:在样品溶液中溶解度小,二者密度差异大,萃取完成后容易实现和样品溶液分离;能较强地溶解水样中的分析物以达到萃取、富集效果;有好的色谱条件,不干扰目标分析物出峰。实验考察了氯苯、四氯化碳和二氯甲烷作为萃取剂对α-生育酚的萃取率。结果如图1A所示,四氯化碳对α-生育酚的萃取率显著高于氯苯和二氯甲烷,且四氯化碳在α-生育酚出峰位置也无溶剂峰,故选择四氯化碳为萃取剂。
萃取剂用量不仅影响萃取率,而且要满足仪器进样量。实验对比了从40.0~150.0 μL的不同萃取剂加入量对萃取率的影响。结果如图1B所示,随着萃取剂加入量的增加萃取液出峰面积逐渐减小,但是萃取率增加而且重复性变好,40.0~100.0 μL时萃取率呈逐 渐增加的趋势,100.0~150.0 μL萃取率几乎不再增加,为了方便操作,选择100.0 μL萃取剂为实验最佳萃取剂加入量。
2.1.2 分散剂的选择
图2 分散剂用量对萃取率的影响Fig.2 Effect of volume of disperser solvents on extraction effi ciency
分散剂是影响萃取率的又一重要因素,分散剂一般需在萃取剂和样品溶液中都具有良好的溶解性,以使萃取剂能被分散成微小的液滴均匀分散在样品溶液中,从而增大萃取剂与分析物的接触面积,提高萃取率。因样品中含有乙醇,可作为分散剂,故只考察其在样品 中含量。实验考查了分别移取2.0、4.0、6.0 mL样品溶液稀释到9.0 mL进行萃取。如图2所示,加入2.0~4.0 mL皂化液稀释萃取,样品中乙醇含量增加分散效果明显加强,超过4.0 mL后萃取率不再增加,因此实验选择移取4.0 mL样品溶液稀释到9.0 mL进行萃取为分散剂乙醇最佳用量。
2.1.3 pH值的选择
调整样品溶液的pH值,可以改变酸性或碱性分析物的存在状态,使其处于分子或离子状态,从而影响萃取效率。α-生育酚为酚类化合物,实验选择用0.01 mol/L磷酸盐缓冲溶液调节样品溶液pH 3.0、pH 7.0和pH 10.0比较萃取率。结果表明,样品溶液pH 3.0萃取峰面积为298.3 mAU,pH 7.0萃取峰面积为306.8 mAU,pH 10.0萃取峰面积为302.7 mAU。可见,改变样品溶液pH值对萃取率无明显影响,故实验中选择不调节皂化液pH值。
2.1.4 离子强度的比较
改变溶液的离子容量,能引起分析物在水溶液中溶解度的改变,样品溶液中含有KCl,实验对比不加NaCl溶液,分别加入质量分数5%、10%、20%、30% NaCl溶液对萃取率的影响。结果表明,不加NaCl溶液和加入质量分数5% NaCl溶液萃取峰面积分别为303.9 mAU和305.8 mAU,加NaCl溶液量多于5%,峰面积均小于300 mAU,且随着加NaCl量增加萃取率反而呈现下降趋势,由于离子浓度过强会引起盐离子在萃取剂中产生静电效应而阻止分析物进入萃取剂中使萃取率降低[23],故选择不加入NaCl溶液萃取。
2.1.5 萃取时间和萃取温度的选择
萃取过程中,分析物在两相间的传质平衡过程是萃取的控制步骤,而萃取时间和温度影响着萃取操作的效率。萃取时分析物转入萃取相,这个过程必须有一定时间保障实现萃取完全,实验考察0~10 min萃取时的萃取率的变化,结果显示,在0~3 min萃取率显著增加,3~10 min萃取率几乎不变,因为在分散剂的作用下,传质速度加快,在很短时间内即可达到萃取平衡,故实验选择振摇3 min为最佳萃取时间。萃取温度也影响萃取传质过程的进行,实验对比了室温(20 ℃)和60 ℃时萃取率,结果发现在加热时萃取率没有明显增加,故实验中选择室温作为萃取温度。
2.2 方法学验证
2.2.1 线性、精密度和重复性
在优化的条件下,考察方法学实验。α-生育酚质量浓度在100~50 000 μg/L线性良好,标准曲线的回归方程为Y=7.279X+0.391(r=0.999 7),方法的精密度用相对标准偏差(relative standard deviation,RSD)表示,为3.2%。为了验证方法的重复性,取实际样品分别做了日内和日间重复性,其精密度分别为2.9%、6.5%。
2.2.2 加标回收率、富集倍数、检出限和定量限
3 种枸杞样品做加标回收率实验,结果如表1所示,加标质量浓度为5.0 μg/L和10.0 μg/L,加标回收率分别为85.7%~106.3%和96.7%~100.9%,RSD在0.68%~4.62%之间。富集倍数为84,以3 倍信噪比为检出限,10 倍信噪比为定量限,检出限为3.1 μg/L,定量限为10.2 μg/L。
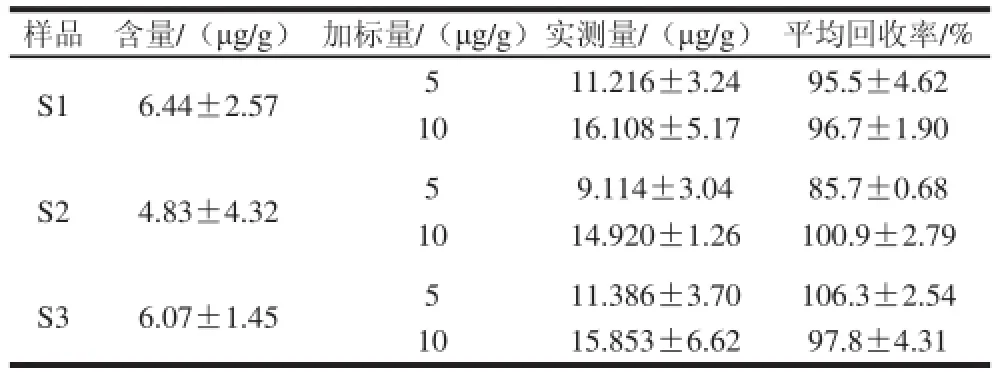
表1 样品测定结果、加标回收率(n==33)Tabllee 11 α-Tocopherol contents and recovery rates in real samples (n == 33))
2.3 实际样品分析
为检验此方法在实际样品中的适用性,运用该方法在优化条件下对3 种枸杞样品测定。结果如表1和图3所示,3 种枸杞样品α-生育酚含量分别为6.44、4.83、6.07 μg/g,从回收率实验可以看出,此方法能准确测 定枸杞中α-生育酚含量。
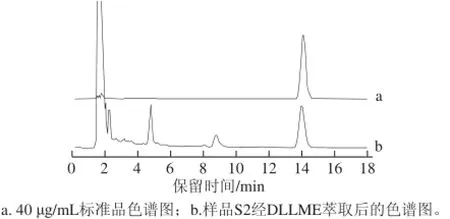
图3 标准品和实际样品色谱图Fig.3 Chromatograms of α-tocopherol standard and sampl e
3 结 论
本实验采用皂化-DLLME样品前处理方法结合HPLC法测定枸杞中α-生育酚的含量,方案中皂化部分参照国标方法[5],将后续的液液萃取改为DLLME,用少量四氯化碳(100 μL)代替大量的乙醚(200 mL),节省有机溶剂用量2 000 倍;将分液、洗涤、干燥、旋蒸4 步浓缩为萃取、离心2 个步骤,大大简化了实验操作;实验重点集中于DLLME萃取条件的优化,通过回收率和重复性实验结果表明该法具有回收率高和精密度好等特点,且有机溶剂耗量少、萃取率高、简单快捷、易于操作,能实现大量样品测试;线性良好、回收率高,能够准确定量样品中α-生育酚,是对国标法测定VE的一大改进,该方法可以作为枸杞中α-生育酚含量的检测技术推广应用。
[1] RYYNANEN M, LAMPI A M, SALO-VAANANEN P, et al. A small-scale sample preparation method with HPLC analysis for determination of tocopherols and tocotrienols in cereals[J]. Journal of Food Composition and Analysis, 2004, 17: 749-765.
[2] NIU Huaxin, JIA Yudong, HU Peng, et al. Effect of dietary vitamin E on the growth performance and nonspecifi c immunity in sub-adult turbot (Scophthalmus maximus)[J]. Fish and Shell fish Immunology, 2014, 41(2): 501-506.
[3] GALLARDO B, MANCA M G, MANTECON A R, et al. Effects of linseed oil and natural or synthetic vitamin E supplementation in lactating ewes’ diets on meat fatty acid profi le and lipid oxidation from their milk fed lambs[J]. Meat Science, 2015, 102: 79-89.
[4] EL-SHENAWY N S, AL-HARBI M S, HAMZA R M. Effect of vitamin E and selenium separately and in combination on biochemical, immunological and histological changes induced by sodium azide in male mice[J]. Experimental and Toxicologic Pathology, 2015, 67(1): 65-76.
[5] 卫生部. GB/T 5009.82—2003 食品中维生素A和维生素E的测定[S].北京: 中国标准出版社, 2003.
[6] KIENEN V, COSTA W F, VISENTAINER J V, et al. Development of a green chromatographic method for determination of fat-soluble vitamins in food and pharmaceutical supplement[J]. Talanta, 2008, 75(1): 141-146.
[7] 张春红, 许传梅, 董琦, 等. HPLC测定青稞中的维生素E[J]. 分析试验室, 2008(B12): 89-91.
[8] IMSANGUAN P, ROAYSUBTAWEE A, BRORORAK R, et al. Extraction of α-tocopherol and γ-oryzanol from rice bran[J]. LWTFood Science and Technology, 2008, 41(8): 1417-1424.
[9] 刘树恒. 间接分光光度法测定药物中的维生素E[J]. 光谱实验室, 2010, 27(5): 1890-1892.
[10] 夏贤明, 饶泽清. 荧光法测定食品中的维生素E的研究[J]. 中国酿造, 1986, 5(6): 37-39.
[11] 钟亮, 李利军, 喻来波, 等. 巯基乙酸自组装修饰金电极不可逆双安培法对维生素E的测定[J]. 分析测试学报, 2008, 27(8): 820-824.
[12] 金米聪, 王立, 符展明. 毛细管气相色谱法同时测定鸡蛋中的胆固醇和α-维生素E[J]. 色谱, 2001, 19(5): 478-480.
[13] HEWAVITHARANA A K, LANARI M C, BECU C. Simultaneous determination of vitamin E homologs in chicken meat by liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2004, 1025(2): 313-317.
[14] SALO-VAANANEN P, OLLILAIEN V, MATTILA P, et al. Simultaneous HPLC analysis of fat-soluble vitamins in selected animal products after small-scale extraction[J]. Food Chemistry, 2000, 71: 535-543.
[15] DROTLEFF A M, TERNES W. Determination of RS, E/Z-tocotrienols by HPLC[J]. Journal of Chromatography A, 2001, 909(2): 215-223.
[16] REZAEE M, ASSADI Y, MILANI H M R, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006, 1116(1/2): 1-9.
[17] CAO Jiangping, LIU Shuhui, BAI Weiwei, et al. Determination of the migration of bisphenol a from polycarbonate by dispersive liquid-liquid microextraction combined with high performance liquid chromatography[J]. Analytical Letters, 2013, 49(9): 1342-1354.
[18] 曹江平, 范盈盈, 解启龙, 等. 分散液液微萃取-高效液相色谱法测定白酒中的酞酸酯[J]. 食品科学, 2013, 34(24): 233-237. doi: 10.7506/ spkx1002-6630-201324049.
[19] 孙建芝, 贺晖, 刘书慧. 分散液液微萃取-反相液液微萃取-扫集-胶束电动色谱法测定红酒中的3 种氯酚类物质[J]. 色谱, 2014, 32(3): 256-262.
[20] 李晓晶, 陈安, 黄聪, 等. 分散液液微萃取-气相色谱法快速测定水中23 种有机磷农药[J]. 分析测试学报, 2011, 30(3): 326-329.
[21] 郑小焱, 何丽君, 张凯歌, 等. 新型对称性1,3-二己基咪唑离子液体分散液液微萃取多环芳烃研究[J]. 分析测试学报, 2014, 33(5): 566-571.
[22] 王宇, 朱成华, 邹晓莉, 等. 溶剂去乳化-悬浮固化分散液液微萃取-气相色谱-质谱联用测定水中的有机氯农药[J]. 色谱, 2013, 31(11): 1076-1080.
[23] BASHEER C, LEE H K, OBBARD J P. Application of liquid-phase microextraction and gas chromatography-mass spectrometry for the determination of polychlorinated biphenyls in blood plasma[J]. Journal of Chromatography A, 2004, 1022 (1/2): 161-169.
Determination of α-Tocopherol in Goji Berries (Lycium barbarum) Using Dispersive Liquid-Liquid Microextraction Combined with High Performance Liquid Chromatography
CAO Jiangping1, LIU Shiwei1, XIE Qilong2, YI Zonghui1, ZHOU Jimei1, ZHANG Yulong1
(1. College of Chemistry and Chemical Engineering, Ningxia Normal University, Guyuan 756000, China; 2. State Key Laboratory of Coal Conversion, Institute of Coal Chemistry, Chinese Academy of Sciences, Taiyuan 030001, China)
A novel method for the determination of α-tocopherol in Goji berries (Lycium barbarum) was developed using dispersive liquid-liquid microextraction (DLLME) coupled with high performance liquid chromatography by UV detection (HPLC-UV). The influence of DLLME experimental parameters including type and volume of extraction solvents and dispersers, sample solu tion pH, ionic strength, extraction time and temperature on extraction e fficiency were examined. The method offer ed excellent linearity over a range of 100-50 000 μg/L with correlation coefficient (r) of 0.999 7. Under the optimum conditions, intra-day and inter-day repeatability values, expressed as relative standard deviation (RSD), were 2.9% and 6.5%, respectively. The limit of detection (LOD) and limit of quantitation (LOQ) were 3.1 μg/L and 10.2 μg/L, respectively. The developed method was successfully applied to the determination of α-tocopherol in 3 types of commercial Goji berry products. Average recoveries varied from 85.7% to 106.3%, with RSD in the range of 0.68%-4.62%. In addition, the DLLME techniq ue had the advantages of simplicity, rapidity and low organic solvent consumption, excellent precision, high sensitivity and good repeatability.
dispersive liquid-liquid microextraction; Lycium barbarum; α-tocopherol
T S207.3
A
1002-6630(2015)22-0122-04
10.7506/spkx1002-6630-201522022
2015-02-16
宁夏自然科学基金资助项目( NZ14275;NZ13216);宁夏师范学院科研项目(YB201433)
曹江平(1984—),男,助教,硕士,研究方向为分离科学与分离分析技术。E-mail:jiangpingcao@126.com

