利用简并引物检测金黄色葡萄球菌肠毒素A、B基因
刘继超 陈柏儒 姜铁民 陈历俊(.北京三元食品股份有限公司,北京 0063;.北京市育才学校,北京 00050)
金黄色葡萄球菌(Staphylococcus aureus,SA),是目前最常见的能够引起细菌性食物中毒的病原体之一,该菌产生葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)是引起食物中毒的主要原因。根据血清学特性,SEs可分为5型(SEA、SEB、SEC、SED、SEE),这五类称为经典肠毒素,也是全球食物中毒中最常见的血清型[1,2],其中引起的食物中毒最多的是A和D型,B和C型次之。
目前检测金黄色葡萄球菌肠毒素的主要方法是免疫学方法,其特异性和灵敏度较差,已不能满足食物中毒等公共安全事件检测的需要[3]。但随着PCR技术的完善,应用该技术检测金黄色葡萄球菌肠毒素的报道[4-6]越来越多。顾琳等[7]使用PCR技术检测出食品中金黄色葡萄球菌肠毒素A、B、G等,其中SEA的检出率最高为77.27%。Mehrotra等[8]使用多重PCR技术检测金黄色葡萄球菌肠毒素A、B、C、D、E的基因,比用单一引物更具特异性和有效性。而简并引物有比特异引物有更高的适应性[9],以及较宽的检测范围,这对提高检测效率和降低检测成本更为有利。本研究拟利用SEA与SEB之间具有同源性的特点,自行设计简并引物SEAB,在同一台PCR仪、同一PCR条件下,建立同时检测SEA、SEB的方法,不仅能够克服酶联免疫法检测时间长的问题,还可提高PCR技术的检测效率,降低检测成本,对于快速诊断是否是由金黄色葡萄球菌引起的食物中毒事件具有重要意义。
1 材料与方法
1.1 材料
1.1.1 仪器
PCR仪:GeneAmp PCR System 2400型,美国PE公司;
电泳仪:PAC300型,伯乐生命医学产品(上海)有限公司;
天能凝胶成像仪:Tanon GIS 2010型,上海天能科技有限公司;
离心机:2K15型,美国Sigma公司。
1.1.2 试剂
乙二胺四乙酸、十二烷基硫酸钠、无水乙醇、苯酚、三氯甲烷、异戊醇:分析纯,国药集团化学试剂有限公司;
胞壁质酶:超纯,10kU/mg,美国Sigma公司;
核糖核酸酶A:≥50kU/mg,美国Sigma公司;
琼脂糖:优级纯,Spain Agarose香港基因公司;
dNTPs、PCR染料、DNA Marker B:超纯,北京赛百盛基因技术公司;
Taq DNA聚合酶:5U/μL,北京赛百盛基因技术公司;
PCR产物回收试剂盒(离心柱型)、新型pUM-T快速克隆试剂盒:北京百泰克生物技术有限公司。
1.1.3 菌种
金黄色葡萄球菌肠毒素SEA(ATCC-13565)、金黄色葡萄球菌肠毒素SEB(ATCC-14458):中国药品生物制品检定所菌种保藏中心;
金黄色葡萄球菌(CGMCC1.0128)、大肠杆菌(CGMCC1.1369)、沙门氏菌(CGMCC1.1552)、表皮葡萄球菌(CGMCC1.2429):中国普通微生物菌种保藏管理中心。
1.2 方法
1.2.1 DNA模板提取 挑取金黄色葡萄球菌肠毒素SEA和SEB的菌落,分别接种于10mL营养肉汤中,放置与37℃生化培养箱内培养12h后,培养基中有大量菌体增殖,分别离心收集菌体,提取基因组 DNA[3,10],于-20℃保存备用。
1.2.2 扩增引物设计 依据http://www.ncbi.nlm.nih.gov/上发布的SEA和SEB的基因编码序列,利用生物软件ClustalW与Primer 5.0,设计检测金黄色葡萄球菌肠毒素A和B的简并引物SEAB(见表1),简并引物SEAB在SEA和SEB上的相应位置分别为566~670,338~472,扩增产物长度分别为105,135bp。

表1 引物SEAB的序列Table 1Primers sequence of SEAB
1.2.3 配制PCR反应体系 PCR技术检测金黄色葡萄球菌肠毒素SEA和SEB的反应体系为20μL:模板1μL、上下游引物各0.5μL(25μmol/L)、10×扩增反应缓冲液2μL、PCR染料2μL、dNTPs 0.5μL、Taq DNA聚合酶0.5μL,其余为无菌超纯水。离心混匀后置PCR仪上进行扩增反应,循环参数设置:预变性95℃3min,变性95℃30s→退火51℃30s→延伸72℃1min,循环数为30,最后72℃延伸10min。从上述反应体系中吸取10μL,用于电泳检测。
1.2.4 克隆及测序 吸取PCR扩增后反应体系100μL,按PCR产物回收试剂盒的说明书操作。菌液抽提阳性质粒,送至天根科技公司进行测序。
1.2.5 特异性分析 利用上述PCR检测方法同时扩增SEA菌株、SEB菌株和对照菌株的金黄色葡萄球菌、大肠杆菌、沙门氏菌、表皮葡萄球菌基因组DNA,然后电泳检测PCR扩增产物,判定简并引物的特异性。
1.2.6 灵敏度分析 将提取的模板DNA进行适量稀释,再使用紫外分光光度计测定260nm波长下的OD值,按式(1)计算其浓度。然后将其按照10倍系列进行逐步稀释至10-5,以此为模板进行PCR检测,以分析简并引物SEAB检测SEB的DNA灵敏度。

式中:
c——DNA浓度,μg/mL;
m——50μg/mL,OD260=1 时 dsDNA 浓 度 约 为50μg/mL;
n——模板稀释倍数。
2 结果与分析
2.1 测序结果
将测序的结果在NCBI的Blast上与GenBank中核苷酸序列进行比对分析,结果发现与GenBank上发布的SEA和SEB基因序列的同源性均达到99%(见图1、2),证明了扩增的目的产物分别为SEA、SEB基因。

图1 SEA的Blast比对结果Figure 1 Blast comparison results of SEA

图2 SEB的Blast比对结果Figure 2 Blast comparison results of SEB
2.2 简并引物SEAB特异性分析
在同一个反应体系中分别加入SEA、SEB菌的DNA模板1μL,无菌超纯水12μL,其余用量与反应条件均同1.2.3,电泳检测的结果见图3、4。由图3、4可知,PCR反应分别扩增出SEA和SEB菌的目的基因片段,而对照组未出现特异性片段,显示出良好的特异性,且整个检测过程不超过20h,说明简并引物SEAB可以在同一个反应体系与反应条件下同步检测产SEA和SEB的金黄色葡萄球菌。

图3 SEA、SEB在同一个PCR反应管中反应的电泳分析图Figure 3 Electrophoretic analysis of SEA and SEB in the same PCR reaction tube

图4 简并引物SEAB特异性的琼脂糖凝胶电泳分析图Figure 4 Electrophoretic analysis the specificity of SEAB with degenerate primers
2.3 简并引物SEAB灵敏性分析
紫外分光光度计分别测定SEB的DNA模板的OD260=0.716 0,得出DNA含量为358ng/μL,分别吸取各稀释倍数的DNA模板1μL,进行PCR检测,结果见图5。由图5可知,DNA灵敏度为3.58ng。
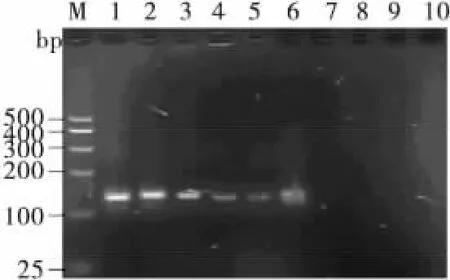
图5 简并引物SEAB灵敏性的琼脂糖凝胶电泳分析图Figure 5 Electrophoretic analysis the sensitivity of SEAB with degenerate primers
3 结论
本研究通过对SEA、SEB设计简并引物SEAB建立了能够准确地扩增目的基因的PCR方法,即一次PCR反应可同时扩增两个靶基因,表现出了良好的特异性,能够有效区分其它引起食物中毒的病原菌,SEB的DNA最低检测浓度为3.58ng,整个检测过程不超过20h,不但节省了检测时间,降低了检测成本,减少了漏检的可能性,而且为金黄色葡萄球菌肠毒素SEA和SEB菌引起的食物中毒事件快速筛查,以及流行病学研究提供了一种快速准确的检测方法。
在PCR反应中,若简并引物的简并度过高,PCR扩增产物的扩增效率和特异性较差,会严重影响目的片段的分离,应适当增加引物的浓度和调整退火温度,才能获得理想的检测效果[11]。而本研究设计的简并引物的简并度较低为32,不增加引物浓度或降低退火温度同样可获得较好的扩增结果。此外也应注意,在设计简并引物时,由于简并度的增加,PCR的特异性会下降,可能会造成假阳性结果。因此,探讨如何降低简并引物的简并度,提高简并引物的PCR扩增效率和特异性对于成功应用简并引物PCR法具有重要意义,例如用脱氧次黄苷(dI)替代简并引物中的高简并位点,可大幅度降低简并程度,显著提高扩增产物的特异性及扩增效率。
1 何晖,刘华章,魏泉德.PCR技术检测金黄色葡萄球菌肠毒素A、B、C、E基因的研究[J].中国卫生检验杂志,2012,22(7):1 585~1 587.
2 Smyth Davida S,Hartigan Patrick J,Meaney William J,et al.Superantigen genes encoded by the egc cluster and SaPIbov are predominant amongStaphylococcus aureusisolates from cows,goats,sheep,rabbits and poultry[J].Journal of Medical Microbiology,2005,54(4):401~411.
3 刘继超,姜铁民,姜阿赤.多重PCR检测金黄色葡萄球菌六型肠毒素基因的研究[J].食品科技,2012,37(6):304~307.
4 Gigaud O.Staphylococcal enterotoxin genes of classical and new types detected by PCR in France[J].Int.J.Food Microbiol.,2002,77(1~2):61~70.
5 Lovseth A,Loncarevic S,Berdal K G.Modified multiplex PCR method for detection of pyrogenic exotoxin genes in staphylococcal isolates[J].J.Clin Microbiol.,2004,42(8):3 869~3 872.
6 Ikeda T,Tamate N,Yamaguchi K,et al.Quantitative analysis ofStaphylococcus aureusin skimmed milk powder by real-time PCR[J].J.Vet.Med.Sci.,2005,67(10):1 037~1 041.
7 顾琳,黄平,宋衍燕,等.PCR检测食品中金黄色葡萄球菌肠毒素基因[J].中国食物与营养,2015,21(2):17~19.
8 Mehrotra M,Wang G,Johnson W M.Multiplex PCR for detection of genes for Staphylococcus aureusenterotoxins,exfoliative toxins,toxic shock syndrome toxin 1,and methicllin resistance[J].Journal of Clinical Microbiology,2000,38(3):1 032~1 035.
9 王少峡,陈丽媛,张竞秋,等.利用生物信息学资源设计简并引物[J].天津师范大学学报(自然科学版),2006,26(2):26~29.
10 Moon J S,Lee A R,Kang H M,et al.Antibiogram and coagulase diversity in staphylococcal enterotoxin-producingStaphylococcus aureusfrom bovine mastitis[J].Journal of Dairy Science,2007,90(4):1 716~1 724.
11 Simon A L,Jean M D,Johan M,et al.Identification of potyviruses using the polymerase chain reaction with degenerate primers[J].Journal of General Virology,1991(73):1 531~1 541.

