金黄色葡萄球菌LAMP可视化快速检测方法的建立
宋涛平 邱华丽 王淑娟 彭新凯 杨丽霞(长沙市食品质量安全监督检测中心,湖南 长沙 410013)
近期中国卫计委通报了2014年全国食物中毒事件情况,突发公共卫生事件网络直报系统全年共收到26个省份(含自治区、直辖市)食物中毒类突发公共卫生事件报告160起,中毒人数5 657人,其中死亡人数110人;而微生物性食物中毒人数最多,占中毒人数67.7%;且微生物性食物中毒事件主要由沙门氏菌、金黄色葡萄球菌等引起[1]。在美国由金黄色葡萄球菌肠毒素引起的食物中毒事件也占到整个细菌性食物中毒事件的33%;加拿大更高达45%[2]。
金黄色葡萄球菌(Staphylococcus aureus)是革兰氏阳性菌,为全球最常见的食源性致病菌之一,其引起的食物中毒在细菌性食物中毒中占有较大比例[3]。人类因食用受其污染的肉、奶、鱼、蛋类及其制品等食品而感染,主要会引起食物中毒及肺炎、心包炎、败血症等疾病[4-6]。金黄色葡萄球菌可在温度7.0~48.5℃、pH 4.2~9.3及高盐(高达15%NaCl)的环境条件下生存,这些特点皆有利于其污染不同的食品[7]。因此,建立快速、灵敏、可靠的食源性致病菌金黄色葡萄球菌的检测方法,对预防和控制致病菌引起的中毒事件发生,增强食品安全性具有重要意义。
传统致病菌检测以生化培养检测方法为主,检测时间较长,且灵敏度较低。PCR技术灵敏度高、特异性强,常被用于致病菌检测,但需要后续电泳检测,增加了污染的风险[8,9]。同时,实时荧光PCR技术也可用于致病菌检测[10-12],但其设备、试剂昂贵,且需经过专业培训的人员操作,对实验室环境条件的要求也较高,只有专业实验室才能具备上述条件,基层单位难以开展此类检测。
环 介 导 等 温 扩 增 (loop-mediated isothermal amplification,LAMP)技术是利用BstDNA聚合酶在60~65℃恒温条件下完成核酸的扩增[13]。BstDNA聚合酶在较高镁离子浓度条件下,才具有5'→3'外切酶活性[14]。该酶80℃处理15min即可失活。在LAMP反应中,需要针对靶基因的6个区域设计4种特异引物,在恒温条件下进行核酸扩增[13]。环引物的加入可缩短反应时间[15]。LAMP技术已广泛应用于致病菌的检测,包括金黄色葡萄球菌[16]、大肠杆菌O157[17]、沙门 氏 菌[18,19]、副 溶 血 性 弧 菌[20,21]、绿 脓 假 单 胞菌[22]、单核细 胞 增 多 性 李 斯 特 菌[23]、阪 崎 肠 杆 菌[24]。 目 前已报道的LAMP技术主要是采用浊度仪或反应后加入显色剂,根据浊度或颜色的变化进行结果判断,浊度法需要较为贵重的浊度仪,而反应后加入显色剂SYBR GreenⅠ,开盖容易造成气溶胶污染,反应前加入高浓度SYBR GreenⅠ对反应有抑制作用。因此,急需建立一种更适合基层使用的反应前加入显色剂,且无需开盖、无需大型仪器设备的LAMP扩增技术。
本研究拟采用实时荧光LAMP技术,根据扩增时间和荧光强度筛选最佳引物组合,并最终运用金属离子指示剂羟基萘酚蓝[25](hydroxy naphthol blue,HNB)判定反应结果,使LAMP的结果判断更简单直观,旨为建立适合在基层检测单位推广使用的金黄色葡萄球菌LAMP可视化快速检测方法。
1 材料与方法
1.1 菌株
金黄色葡萄球菌、单增李斯特菌、大肠埃希氏杆菌、阪崎肠杆菌、铜绿假单胞菌、产气荚膜梭菌、粪肠球菌、副溶血性弧菌:美国典型菌种保藏中心(ATCC);
鼠伤寒沙门氏菌、蜡样芽孢杆菌、β溶血性链球菌、志贺氏菌:中国医学微生物菌种保藏管理中心(CMCC);
大肠埃希氏菌O157:H7:英国国家标准菌种保藏中心(NCTC);
金黄色葡萄球菌:由本实验室依据GB/T 4789.10—2010从食品中分离鉴定。
1.2 主要试剂和仪器
细菌基因组DNA提取试剂盒:天根生化科技(北京)有限公司;
DNA等温扩增试剂盒:广州迪澳生物科技有限公司;
羟基萘酚蓝(HNB):美国Sigma公司;
DL 1,000DNA Marker、Premix TaqTM:大连宝生物工程有限公司;
超微量核酸蛋白分析仪:BD1000型,北京五洲东方科技发展有限公司;
干式恒温器:K30B型,杭州奥盛仪器有限公司;
实时荧光定量PCR仪:7500FAST型,美国应用生物系统公司。
1.3 细菌基因组DNA提取
按细菌基因组DNA提取试剂盒使用说明书操作。
1.4 LAMP引物的设计与合成
针对金黄色葡萄球菌的特异性基因nuc和femA,参照文献[26]和SN/T 2754.1—2011中引物序列(见表1),合成2套LAMP引物,用于筛选最佳引物组合,引物由上海生工生物工程有限公司合成。

表1 引物序列Table 1 Sequences of primers
1.5 LAMP体系建立
LAMP反应体系25μL,包括:F3、B3浓度为0.2μmol/L,FIP、BIP浓度为1.6μmol/L,LB、LF浓度为0.3μmol/L(无环引物加双蒸水补足体积),2×反应缓冲液12.5μL,8UBst DNA聚合酶1μL,DNA模板2μL。将反应体系于63℃恒温反应45min。实时荧光LAMP反应体系中加SYTO-9荧光染料0.5μL,在实时荧光定量PCR仪上完成反应;显色法加3mmol/L HNB 0.5μL,在干式恒温器上完成反应。
1.6 灵敏度分析
将100ng/μL的金黄色葡萄球菌基因组DNA进行10倍梯度稀释,使得浓度梯度依次为100,10,1,0.1,0.01,0.001,0.000 1ng/μL。以此为模板进行LAMP扩增。平行进行PCR法检测金黄色葡萄球菌灵敏度的试验,对比分析两种方法的检测灵敏度。PCR法反应体系:2×Premix Taq 12.5μL,引物nuc-F3/nuc-B3(10μmol/L)各0.5μL,100ng DNA模版,补灭菌蒸馏水至25μL。反应程序为94℃5min;94℃30s,58℃30s,72℃30s共进行35个循环,最后72℃5min。
1.7 特异性分析
利用建立的LAMP法对表2中菌株的基因组DNA进行扩增,验证本方法的特异性。同时,使用金黄色葡萄球菌可视化LAMP检测法对按照GB/T 4789.10—2010的方法从肉类及蛋奶制品等样品中分离得到的野生菌株进行验证检测,并平行进行普通PCR检测。
2 结果与分析
2.1 最佳引物筛选
按上述反应体系,以金黄色葡萄球菌DNA为模板,运用2套LAMP引物分别进行实时荧光LAMP扩增,比较其扩增效率筛选最佳引物组合,图1为最佳引物筛选结果。由图1可知,nuc、femA引物组的扩增出峰时间分别为11.7,31.6min,而nuc引物组的扩增荧光强度明显高于femA引物组。因此选择nuc引物组进行后续试验。
2.2 LAMP法与PCR法检测灵敏度比较
在反应前加入HNB作为LAMP扩增的指示剂,根据HNB的颜色变化进行结果判定,阳性呈天蓝色,阴性为紫罗兰色。用nuc引物组,以金黄色葡萄球菌DNA为模板,用去离子水进行10倍系列稀释,分别进行LAMP、PCR法检测,比较两者灵敏度,结果见图2。由图2可知,LAMP法和PCR法灵敏度基本相同,都可以达到0.001ng/μL,但PCR法在0.001ng/μL的电泳条带较弱。

图1 最佳引物筛选Figure 1 Screening the best primers

图2 金黄色葡萄球菌检测灵敏度结果Figure 2 Detection sensitivity of Staphylococcus aureus
从试验易操作性、结果判定直观角度考虑,LAMP可视化检测法更适合现场快速检测。
2.3 LAMP特异性试验结果
利用建立的金黄色葡萄球菌LAMP法对表2中的13个种类共计27株细菌进行特异性试验,采用去离子水作为阴性对照。其中15株金黄色葡萄球菌为LAMP阳性结果、其他菌为阴性结果,与平行进行的普通PCR法检测结果一致,表明本试验所用的LAMP引物具有高度特异性。
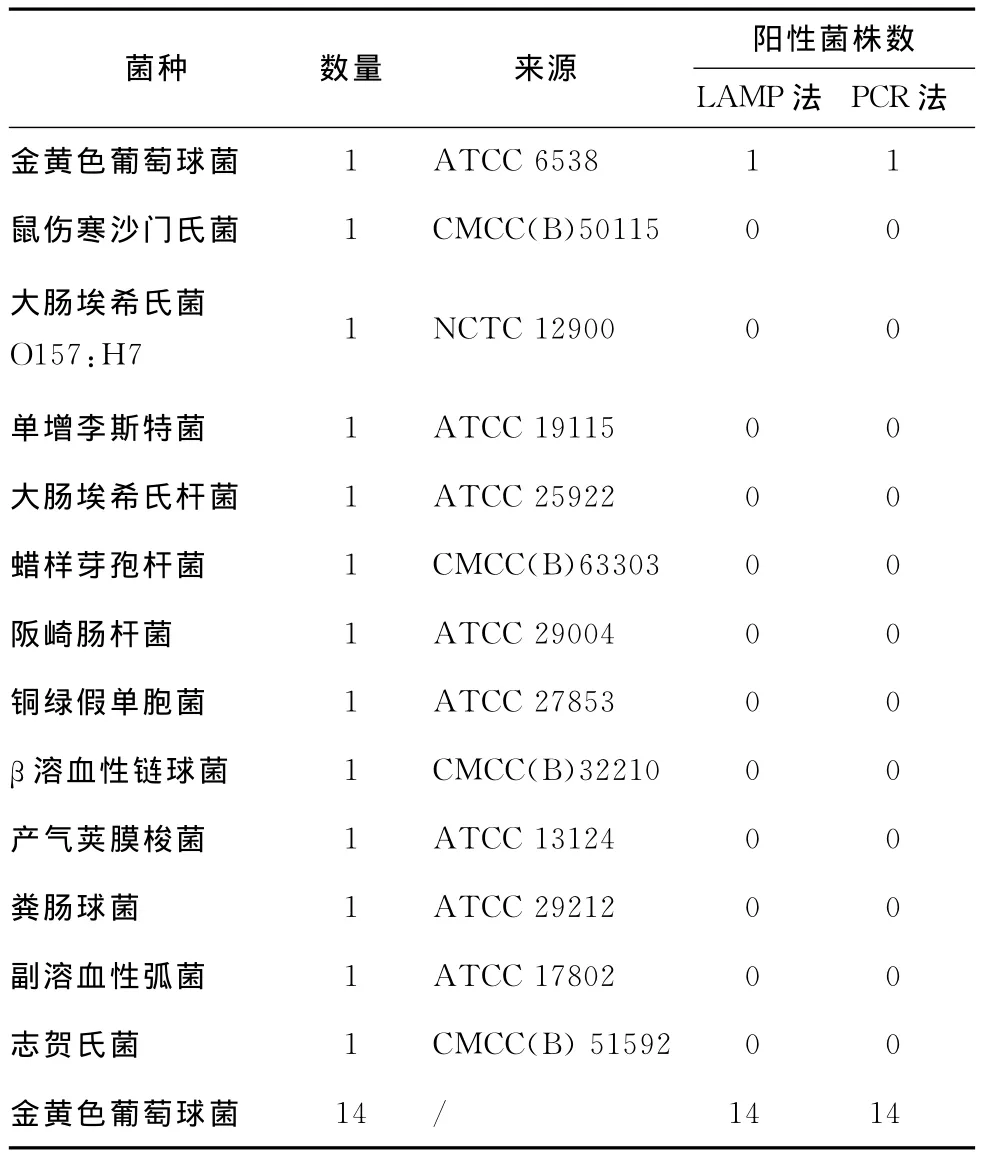
表2 特异性分析结果Table 2 Results of LAMP specific amplification
3 讨论
本研究通过实时荧光LAMP法对金黄色葡萄球菌的2套LAMP引物进行筛选,比较其出峰时间、荧光强度确定最佳引物组合。采用在反应前添加金属离子指示剂HNB,通过肉眼直接观察颜色变化进行判定,若反应液由紫罗兰变为天蓝色,即为阳性。本试验建立了金黄色葡萄球菌可视化LAMP反应体系,检测灵敏度为0.001ng/μL,与普通PCR相当,且特异性良好,与其他种类的致病菌无交叉反应。HNB作为LAMP反应显色剂,结果易于识别,且与普通PCR一致,说明基于HNB染料的LAMP检测结果可信。
本研究建立了金黄色葡萄球菌可视化快速检测方法,在63℃恒温条件下反应45min便可直接判定结果,无需特殊仪器设备,简便易行,可用于食品安全现场监督检验和基层快速检测。
1 中华人民共和国国家卫生和计划生育委员会.国家卫生计生委办公厅关于2014年全国食物中毒事件情况的通报[EB/OL].(2015—02—15)[2015-05-11].http://www.nhfpc.gov.cn/yjb/s3585/201502/91fa4b047e984d3a89c16194722ee9f2.shtml.
2 黄冰,邓志爱,谭铭雄,等.食品中金黄色葡萄球菌污染状况产肠毒素特性及耐药性研究[J].中国卫生检验杂志,2009,19(6):1 380~1 382.
3 Zhao Xi-hong,Li Yan-mei,Myoungsu P,et al.Loop-mediated isothermal amplification assay targeting thefemAgene for rapid detection ofStaphylococcus aureusfrom clinical and food samples[J].Microbiol Biotechnol,2013,23(2):246~250.
4 Jorgensen H J,Mork T,Hogasen H R,et al.EnterotoxigenicStaphylococcus aureusin bulk milk in Norway[J].Journal of Applied Microbiology,2005,99(1):158~166.
5 Kennedy J,Bolton D J,Cowan C.Food safety and bacterial pathogens:Why you should eat in restaurants[C]//Proceedings of an international conference hosted by the 32nd Annual Food science and Technology Research Conference.Ireland Cork:National University of Ireland Cork,2002:5.
6 王江桥,罗君,蔡珠,等.金黄色葡萄球菌感染的特征及其耐药性[J].实用预防医学,2007,14(4):990~991.
7 Margrit S,Ursula S S,Schmidt-Lorenz W.Temperature limits of growth,TNase and enterotoxin production ofStaphylococcus aureusstrains isolated from foods[J].Int J.Food Microbiol,1990,11:1~19.
8 Matsuda K,Tsuji H,Asahara T.Sensitive quantitative detection of commensal bacteria by rRNA-targeted reverse transcription-PCR[J].Applied Environment Microbiology,2007,73(1):32~39.
9 Alarcon B,Vicedo B,Aznar R.PCR-based procedures for detection and quantification ofStaphylococcus aureusand their application in food[J].J.Appl Microbiol,2006,100:352~364.
10 Sabet N S,Subramaniam G,Navaratnam P.Detection ofmecAandermAgenes and simultaneous identification ofStaphylococcus aureususing triplex real-time PCR fromMalaysian S.aureusstrain collections[J].International Journal of Antimicrobial Agents,2007,29(5):582~585.
11 Hein I,Lehner A,Rieck P,et al.Comparison of different ap-proaches to quantifyStaphylococcus aureuscells by real-time quantitative PCR and application of this technique for examination of cheese[J]. Appl Environ Microbiol,2001,67:3 122~3 126.
12 Palomares C,Torres M J,Torres A,et al.Rapid detection and identification ofStaphylococcus aureusfrom blood culture specimens using real-time fluorescence PCR[J].Diagn Microbiol Infect Dis,2003,45:183~189.
13 Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):E63.
14 Mori Y,Nagamine K,Tomita N,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochem Biophys Res Commun,2001,289:150~154.
15 Shi Xian-ming,Long Fei,Suo Biao.Molecular methods for the detection and characterization of food-borne pathogens[J].Pure Appl Chem.,2010,82:69~79.
16 Mohammadali S,Minhaz U A,Andy N.High-throughput realtime electrochemical monitoring of LAMP for pathogenic bacteria detection[J].Biosensors and Bioelectronics,2014,58:101~106.
17 Zhao Xi-hong,Li Yan-mei,Wang Li,et al.Development and application of a loop-mediated isothermal amplification method on rapid detectionEscherichia coliO157strains from food samples[J].Mol.Biol.Rep,2010,37:2 183~2 188.
18 Ueda S,Kuwabara Y.The rapid detection ofSalmonellafrom food samples by loop-mediated isothermal amplification(LAMP)[J].Biocontrol Sci.,2009,14:73~76.
19 Ohtsuka M,Yanagawa K,Takatori K.Detection ofSalmonella Entericain naturally contaminated liquid eggs by loop-mediated isothermal amplification,and characterization ofSalmonellaisolates[J].Appl Environ Microbiol,2005,71:6 730~6 735.
20 Chen Si-yi,Ge Bei-lei.Development of a toxR-based loop-mediated isothermal amplification assay for detecting Vibrio parahaemolyticus[J].BMC Microbiol,2010,10:41~45.
21 Yamazaki W,Kumeda Y,Misawa N,et al.Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of thetdhandtrhgenes of Vibrio parahaemolyticus and related Vibrio species[J].Appl Environ Microbiol,2010,76:820~828.
22 Zhao Xi-hong,Wang Li,Li Yan-mei,et al.Development and application of a loop-mediated isothermal amplification method on rapid detection ofPseudomonas aeruginosastrains[J].World J.Microbiol Biotechnol,2011,27:181~184.
23 Wang Li,Li Yue,Chu Jin,et al.Development and application of a simple loop-mediated isothermal amplification method on rapid detection ofListeria monocytogenesstrains[J].Mol.Biol.Rep,2012,39:445~449.
24 张淑红,吴清平,徐晓可,等.LAMP法在阪崎肠杆菌快速检测中的应用[J].食品与机械,2011,27(5):111~114.
25 Goto M,Honda E,Ogura A,et al.Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J].Biotechniques,2009,46(3):167~172.
26 Wang Xin-ru,Wu Li-fen,Wang yan,et al.Rapid detection ofStaphylococcus aureusby loop-mediated isothermal amplification[J].Appl Biochem Biotechol,2015,175(2):882~291.

