细菌纤维素产生菌选育与突变株发酵特性的研究
邓毛程,李 静,王 瑶,陈维新,吴永辉(.广东轻工职业技术学院,广东广州50300;.广州倚德生物科技有限公司,广东广州5340)
细菌纤维素产生菌选育与突变株发酵特性的研究
邓毛程1,李静1,王瑶1,陈维新1,吴永辉2
(1.广东轻工职业技术学院,广东广州510300;2.广州倚德生物科技有限公司,广东广州511340)
为了获得细菌纤维素高产菌株,采用紫外线和硫酸二乙酯对实验室保存的木葡糖酸醋杆菌BC13进行复合诱变。通过诱变、筛选和连续传代实验,获得1株产量达15.6g/L的高产突变株Y19-11,该菌株遗传稳定性良好,比原出发菌株产量提高44.4%。同时,通过比较不同温度、不同初始pH下的菌体量和细菌纤维素产量,确定突变株Y19-11的最适温度和初始pH分别为30℃和5.5。
细菌纤维素,紫外线诱变,硫酸二乙酯诱变,发酵特性
细菌纤维素(bacterial cellulose,简称BC)最早由英国科学家Brown发现[1],是由微生物(主要是细菌)利用液态培养基发酵产生的细胞外纤维素,与植物纤维素一样,都是由葡萄糖基通过β-1,4-糖苷键连接起来的大分子[2]。与植物纤维素相比,细菌纤维素具有高结晶度、高化学纯度、高抗张强度、高弹性模量、吸水性强和生物相容性好等优点,这些优点使其在食品、生物医药、组织工程支架材料、声学器材、化妆品、膜过滤材料、造纸等领域具有巨大的应用潜力[3-5]。
迄今为止,人们已经发现醋酸菌属(Acetobacter)、假 单 胞 菌 属(Prudomonas)、无 色 杆 菌 属(Achromobacter)、产碱杆菌属(Alcaligcncs)、土壤杆菌属(Agrobacterium)、固氮菌属(Azotobacter)、气杆菌属(Aerobacter)、根瘤菌属(Rhizobium)和八叠球菌属(Sarcina)等九个属中某些微生物能够合成细菌纤维素,其中,木醋杆菌(Acetobacter xylinum)是目前最常用和产率最高的细菌纤维素生产菌[3,6]。多年来,国内外研究人员一直致力于细菌纤维素高产菌的选育工作[5,7-8],但现有菌种的细菌纤维素产率依然较低。为了进一步提高细菌纤维素产生菌的产率,本研究对实验室已获得的野生菌株进行复合诱变选育,以期获得高产的突变株,为细菌纤维素的研究和生产提供优良菌种。
1 材料与方法
1.1材料与仪器
木葡糖酸醋杆菌(Gluconacetobacter xylinus)BC13广东轻工职业技术学院食品与生物工程系筛选与保藏的菌种;固体培养基葡萄糖20g/L,酵母膏10g/L,KH2PO41g/L,MgSO4·7H2O 0.2g/L,琼脂20g/L,pH5.5,121℃灭菌20min;液体培养基葡萄糖50g/L,酵母膏10g/L,KH2PO41g/L,MgSO4·7H2O 0.2g/L;新鲜椰子水椰子破壳取水,50%(v/v),pH5.5,121℃灭菌20min。
SHZ-82A恒温水浴振荡器江苏省太仓医疗器械厂;KDC-210HR高速冷冻离心机安徽中科中佳科学仪器有限公司;A200基因扩增仪杭州朗基科学仪器有限公司;RDY-SP1Z核酸电泳仪北京荣阳经典科技有限公司;GI-1凝胶成像系统通宝达成科技(北京)有限公司;S-3000N扫描电镜日本日立公司,VERTEX70傅立叶红外光谱仪德国布鲁克公司。
1.2实验方法
1.2.1菌悬液的制备用适量的无菌生理盐水将斜面上的菌种洗下,置于涡旋振荡器上振荡5min,再用无菌生理盐水调节菌体浓度,使浓度为106~107个/mL。
1.2.2出发株的紫外诱变将出发株BC13的菌悬液放入无菌的培养皿中,置于紫外灯(30W,254nm)下方20cm处进行照射处理,照射期间采用磁力搅拌器进行搅拌,每隔10s取样进行适当稀释,涂布平板培养基,于30℃下避光培养72h,观测菌落数,以未经照射的平板为参照,计算紫外诱变的致死率,选择适宜的诱变剂量。然后,在优选剂量下对菌悬液进行处理,经平板分离、液体发酵筛选,筛选出高产的UV突变株。
1.2.3UV突变株的化学诱变采用硫酸二乙酯进行化学诱变,操作参照文献[9]的方法。在UV突变株的菌悬液中,加入硫酸二乙酯,使其浓度为1%(v/v),于30℃下振荡处理,每隔5min取出1mL的菌悬液,用0.5mL硫代硫酸钠终止反应,再进行适当稀释,涂布平板培养基,于30℃下避光培养72h,观测菌落数,以未经处理的平板为参照,选择适宜的诱变剂量。然后,在优选剂量下对菌悬液进行处理,经平板分离、液体发酵筛选,筛选出高产的硫酸二乙酯突变株。
1.2.4突变株的分离与筛选将优选剂量下处理的菌悬液进行适当稀释,涂布平板培养基,于30℃下避光培养72h,挑取颗粒圆润,外形完整饱满的菌落,接入斜面培养基进行培养24h,然后将斜面菌种接入装有100mL液体培养基的三角瓶,置于30℃、150r/min的条件下振荡培养12h,再静止发酵10d,测定细菌纤维素产量,筛选出高产的突变株。
1.2.5传代稳定性的分析将上述优选突变株的斜面菌种转接斜面10次,每次的斜面培养24h,然后将各次的斜面菌种接入装有100mL液体培养基的三角瓶中,按1.2.4中的方法进行发酵,测定发酵液中细菌纤维素产量,分析突变株的传代稳定性。
1.2.6突变株发酵温度的分析将上述选突变株的斜面菌种接入装有100mL液体培养基的三角瓶中,分别在不同温度下,振荡(150r/min)培养12h,再静止发酵72h,测定发酵液中的菌体量。同时,以相同条件和方式进行发酵,静止发酵10d后,测定发酵液中的细菌纤维素产量。根据测定结果,分析突变株的适宜发酵温度。
1.2.7突变株发酵pH的分析将液体培养基调节至不同pH,按1.2.6中方法,在30℃下进行发酵,分别测定发酵液中的菌体量和细菌纤维素产量,分析适宜的初始发酵pH。
1.2.8指标的测定
1.2.8.1细菌纤维素产量(干重)的测定采用称重法测定发酵液中细菌纤维素产量[10]。将发酵液中的凝胶膜状产物取出,用纯净水漂洗干净,放入0.1mol/L的NaOH溶液中煮沸30min,用蒸馏水漂洗至中性,于105℃的条件下干燥,直至恒重,然后准确称量干燥物的质量,即可计算细菌纤维素产量(干重)。计算公式如下:
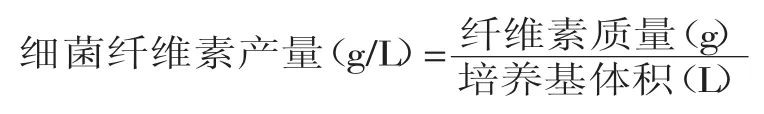
1.2.8.2菌体量(干重)的测定改进文献[11]提供的方法,将发酵液pH调节至5.0,加入3g纤维素酶粉(10000U/g),置于40℃下振荡酶解2h,然后离心分离(12000r/min,15min),收集沉淀物,于80℃下干燥,恒重后称量干燥物质量,菌体量的计算公式如下:
菌体干重(g)=离心沉淀物干燥质量(g)-3
1.2.8.3紫外诱变的致死率的计算致死率的计算如下式:
致死率(%)=[(参照平板上的菌落数-诱变平板上的菌落数)/参照平板上的菌落数]×100
2 结果与讨论
2.1紫外线诱变与筛选
紫外线对菌种BC13的致死率曲线如图1所示。随着紫外线照射时间的增大,菌种BC13的致死率呈上升的趋势,照射时间超过60s以后的致死率十分接近100%。根据文献报道[12],致死率较高时,存活的菌株出现正突变概率较小,但正突变菌株的产量提高幅度有可能很大,因而较多研究者选择致死率在80%~90%之间的剂量为最佳诱变剂量[13-15]。从图1可看出,紫外线照射30s时的致死率为88.2%,故被选为最佳诱变剂量。
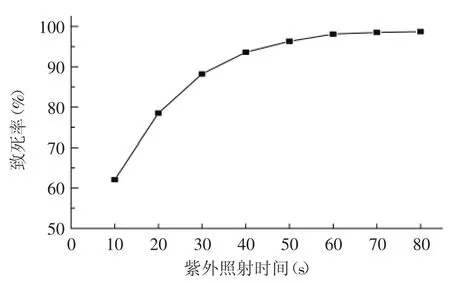
图1 紫外线诱变的致死率曲线Fig.1 Motality curve of UV mutagenesis
菌种BC13在此剂量下进行诱变,经平板分离,挑取96株菌株,再经发酵筛选,获得产量提高幅度达10%以上的菌株有8株,它们和出发菌株BC13的细菌纤维素产量如图2所示。由图2可知,这8株菌的产量在11.9~12.7g/L之间,产量增加幅度的范围为10.2%~17.6%,其中突变株Y26的产量最高,达12.7g/L,优于近年来汤卫华[9]、万中义、Mohite等[16-17]的研究成果。
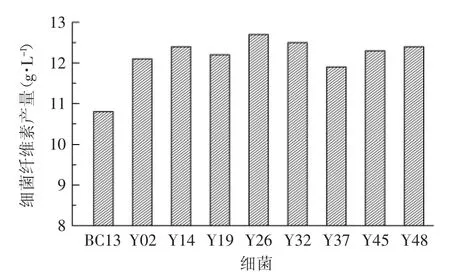
图2 紫外线突变株的细菌纤维素产量Fig.2 Bacterial cellulose(BC)yield data of strains treated by UV mutation
2.2硫酸二乙酯诱变与筛选
利用硫酸二乙酯对8株紫外线突变株进行处理,致死率的数据分布如表1所示。8株菌的致死率随硫酸二乙酯作用时间延长而增大,在30min时的致死率都在80%~90%之间,在40min及以后的致死率均超过90%,故优选30min作为硫酸二乙酯对这8株菌的最佳诱变剂量。

表1 硫酸二乙酯诱变的致死率(%)Table.1 Motality of diethyl sulfate mutagenesis(%)
在最佳诱变剂量下,利用硫酸二乙酯分别对紫外线照射的突变株Y02、Y14、Y19、Y26、Y32、Y37、Y45和Y48进行化学诱变,经平板分离、发酵筛选,选出产量比出发菌株BC13增加30%的菌株15株,它们的产量在14.1~15.6g/L之间,产量增加幅度的范围为30.6%~44.4%,如表2所示。经硫酸二乙酯诱变处理,有一部分产量较高的紫外线突变株发生了负突变,从突变株Y32和Y48的处理液中没有获得正突变幅度较大的菌株,产量最大的突变株Y26的正突变概率也相对减小;在此次诱变处理中,由突变株Y19诱变得到的菌株Y19-11的产量最大,达到15.6g/L,比突变株Y19的产量增加27.9%,比出发菌株BC13的产量增加44.4%。本结果较汤卫华[9]文献报道的细菌纤维素产量9.91g/L有较大幅度提高,因此,将突变株Y19-11优选为进一步研究的对象。
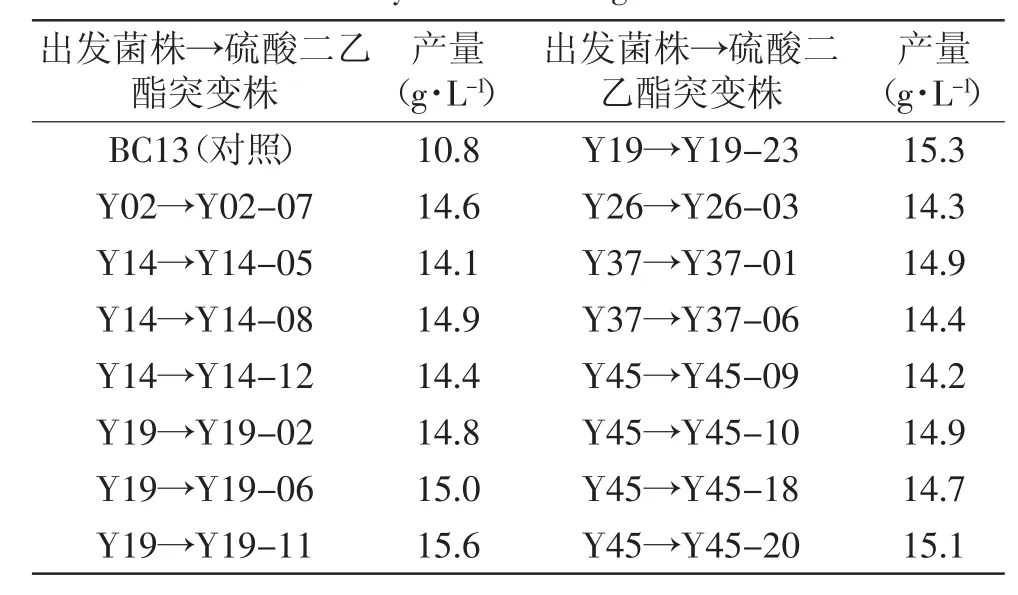
表2 硫酸二乙酯突变株的细菌纤维素产量Table.2 Bacterial cellulose(BC)yield data of strains treated by diethyl sulfate mutagenesis
2.3传代稳定性分析
将突变株Y19-11的斜面菌种进行转接斜面10次,各次斜面菌种的液体发酵结果如图3所示。从图3看出,细菌纤维素产量在14.9~15.8g/L的范围内波动,波动幅度很小,其中8次的产量均在15.4g/L以上,表明突变株Y19-11具有良好的传代稳定性,其高产细菌纤维素的性能可以比较稳定地保持,较出发菌株产量增加37.9%~46.2%。
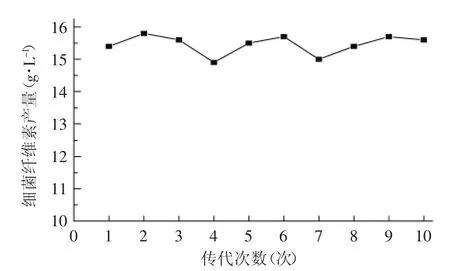
图3 传代10次的细菌纤维素产量Fig.3 Bacterial cellulose(BC)yield data of strain during 10 times passaged

图4 不同温度下的细菌纤维素产量和菌体重量Fig.4 Bacterial cellulose(BC)yield and cell weight under different temperature
2.4突变株的适宜温度
将突变株Y19-11分别在不同温度下进行液体发酵,静止发酵3d的菌体量和静止发酵10d的细菌纤维素产量如图4所示。可以看出,菌体量和细菌纤维素产量的关系大致为正相关,这与先前文献报道的结论基本一致[18-20]。菌体量和细菌纤维素产量在28~32℃之间处于较大,其中30℃的菌体量和细菌纤维素产量均为最大,分别为1.62g/L和15.6g/L。实验表明,突变株Y19-11的最适发酵温度为30℃。
2.5突变株的适宜初始pH
在不同的初始pH下,突变株Y19-11静止发酵3d的菌体量和静止发酵10d的细菌纤维素产量如图5所示。在初始pH为5.0~6.0的范围内,菌体量和细菌纤维素产量较大,两者在初始pH为5.5时均达到最大。在细菌纤维素产生的同时,会伴随产生酸类代谢产物,发酵液的pH下降幅度较大,不利于菌种生长和发酵,但浅层静态发酵(目前细菌纤维素发酵的主要工艺)过程难以调解pH,因而初始pH的控制十分重要。从图5看出,突变株Y19-11的最适初始pH宜选择为5.5。

图5 不同初始pH下的细菌纤维素产量和菌体量Fig.5 Bacterial cellulose(BC)yield and cell weight under different initial pH value
3 结论
目前,国内外研究人员的研究热点主要还集中在低值碳源、能源的筛选[21-23],包括各种食品加工废渣、酿造废水等,细菌纤维素产量基本在10g/L以下,对优良菌种开展诱变育种的研究较少,本文以木糖酸醋杆菌BC13为出发菌株,利用紫外线对其进行诱变,筛选获得细菌纤维素产量增加幅度为10%的突变株8株。然后,利用硫酸二乙酯对8株紫外线突变株进行复合诱变,筛选获得产量比菌株BC13增加30%以上的突变株15株。其中,突变株Y19-11的产量最大,其产量达15.6g/L,比菌株BC13的产量增加44.4%。经过10次转接斜面和发酵,突变株Y19-11的发酵产量波动极小,表现了良好的遗传稳定性。分别在不同温度、不同初始pH下进行发酵,通过比较菌体量和细菌纤维素产量,确定突变株Y19-11的最适温度和初始pH分别为30℃和5.5。该菌株具有生产应用的潜力,但仍需对发酵条件进行深入的研究。
[1]Brown A J.On an acetic ferment which forms cellulose[J]. Journal of Chemical Society,1886,49:432-439.
[2]曹海鹏,袁帅,赵昆,等.细菌纤维素高产菌株的筛选及鉴定[J].食品科学,2010,32(5):211-214.
[3]陆胜民,贾静静,杨颖.细菌纤维素发酵工艺与应用研究进展[J].食品与发酵科技,2011,47(1):27-31.
[4]Wang Yan,Luo Qingping,Peng Bihui,et al.A novel thermotropic liquid crystalline:Benzoylated bacterial cellulose [J].Carbohydrate Polymers,2008,74(4):875-879.
[5]王银存,李利军,马英辉,等.细菌纤维素生产及应用研究进展[J].中国酿造,2011,229(4):20-23.
[6]Peggy O S,Cannon R E.Acetobacter ylinum:An Inq uiry into Cellulose Biosynthesis[J].The Alnerican Biology Teacher,2000,62(6):442-444.
[7]Bae SQ,Sugano Y,Ohi K,et al.Features of bacterial cellulose synthesis in a mutant generated by disruption of the diguanylate cyclase 1 gene of Acetobacter xylinum BPR2001[J].Applied Microbiology and Bioteehnology,2004,65(3):315-322.
[8]张雯,齐香君,李彦军,等.醋酸杆菌Acetobacter xylinum pde基因敲除研究[J].陕西科技大学学报,2013(5):121-125.
[9]汤卫华,李飞,贾原媛,等.细菌纤维素高产菌株的诱变选育和发酵条件研究[J].现代食品科技,2009,25(9):1016-1019.
[10]邓毛程,吴亚丽,梁世中.超声波促进高纤椰果发酵的研究[J].食品与发酵工业,2008,34(3):62-64.
[11]汤卫华,马霞,贾原媛,等.木醋杆菌流加静置培养生产细菌纤维素[J].食品与发酵工业,2008,34(2):21-24.
[12]施巧琴,吴松刚.工业微生物育种学[M].北京:科学出版社,2003:l33-147.
[13]帖金鑫,林娟,李小平,等.耐酸耐胆盐嗜酸乳杆菌的紫外诱变选育[J].食品研究与开发,2013,34(17):111-115.
[14]李严军,廖杰琼,青文哲,等.产类黄酮链霉菌的紫外线诱变选育[J].农产品加工·学刊,2013(9b):1-3.
[15]古丽娜孜,库米拉,张晓燕,等.低温淀粉酶高产菌株的诱变选育[J].新疆农业大学学报,2013,36(4):288-292.
[16]万中义,吴顺清,朱海云,等.细菌纤维素高产菌株的诱变育种[J].湖北农业科学,2010,49(12):3067-3068.
[17]B V Mohite,K K Kamalja,S V Patil.Statistical optimization of culture conditions for enhanced bacterial cellulose production by gluconoacetobacter hansenii ncim 2529[J].Cellulose,2012,19(5):1655-1666.
[18]邵伟,乐超银,熊泽,等.醋酸杆菌合成细菌纤维素的发酵动力学研究[J].中国酿造,2005,151(10):26-28.
[19]齐香君,张雯,韩戌瑁,等.细菌纤维素生产菌株的动力学研究[J].食品科学,2005,26(12):65-67.
[20]马霞,察可文,王瑞明,等.细菌纤维素静态发酵生产的动力学模型的确定[J].河南工业大学学报:自然科学版,2005,26(1):36-38.
[21]Dehui Lin,Patricia Lopez-Sanchez,Rui Li,et al.Production of bacterial cellulose by Gluconacetobacter hansenii CGMCC 3917 using only waste beer yeast as nutrient source[J].Bioresource Technology,2014,151:113-119.
[22]Fa’bio P Gomes,Nuno HCS Silva,Eliane Trovatti,et al. Production of bacterial cellulose by Gluconacetobacter sacchari using dry olive mill residue[J].Biomass and Bioenergy,2013,55:205-211.
[23]Jyh-Ming Wu,Ren-Han Liu.Thin stillage supplementation greatlyenhancesbacterialcelluloseproductionby Gluconacetobacter xylinus[J].Carbohydrate Polymers,2012,90:116-121.
Study on breeding of bacterial cellulose producing strain and fermentation characteristics of mutation strain
DENG Mao-cheng1,LI Jing1,WANG Yao1,CHEN Wei-xin1,WU Yong-hui2
(1.Guangdong Industry Technical College,Guangzhou 510300,China;2.Guangzhou Yide Biotechnology Co.,Ltd.,Guangzhou 511340,China)
In order to obtain high bacterial cellulose(BC)-producing strain,composite mutagenesis of ultraviolet and diethyl sulfate was used to Gluconacetobacter xylinus BC13 which preserved in laboratory.A high-yield mutant strain Y19-11,BC yield reached 15.6g/L,was obtained by mutagenesis,screening and continuous passage.The mutant strain had excellent genetic stability and its BC yield increased by 44.4%,higher than the original strain.Meanwhile,through comparing the cell weight and yield of BC under different temperature and initial pH value,the optimal temperature and initial pH of mutant strain Y19-11 were determined as 30℃and 5.5,respectively.
bacterial cellulose;ultraviolet mutagenesis;diethyl sulfate mutagenesis;fermentation characteristics
TS201.2
A
1002-0306(2015)04-0159-04
10.13386/j.issn1002-0306.2015.04.026
2014-04-24
邓毛程(1971-),男,博士,教授,研究方向:生物工程。
2010年广州市科技计划项目(2010Y1-C571);2010年广东省科技计划项目(2010B011000008);2011年广东省教育厅省级工程中心建设项目(GCZX-B1103)。

