硝酸钠和2-溴乙烷磺酸钠对山羊体外瘤胃发酵甲烷、氢气和挥发性脂肪酸生成的影响
王 荣 谭利伟 王 敏 邓近平 颜志成 王玉诗 谭支良
(1.中国科学院亚热带农业生态研究所,长沙 410125;2.湖南农业大学动物科学技术学院,长沙 410128;3.农业部规划设计研究院,北京 100125;4.湖南农业大学园艺园林学院,长沙 410128)
反刍家畜胃肠道甲烷排放占食入总能的2%~12%,是饲粮能量损失的主要途径之一,也是人类活动温室气体排放的主要来源[1]。其中,约90%的胃肠道甲烷排放产生于反刍家畜瘤胃[2]。因此,反刍家畜胃肠道甲烷减排的重点在于抑制瘤胃甲烷生成。目前,抑制瘤胃甲烷生成主要通过2种机制:1)利用更低自由能的生物化学过程竞争甲烷菌生长代谢所需要的底物(氢气),从而抑制甲烷生成;2)通过抑制甲烷生成过程中所需要的关键性酶和甲烷菌活性,以达到减少甲烷排放的目的[3]。
硝酸钠和2-溴乙烷磺酸(2-bromoethanesulphonate,BES)是2种常用的甲烷生成抑制剂。硝酸钠抑制甲烷生成的机制比较复杂,归为以下2条:1)瘤胃内硝酸盐降解生成氨气需要消耗氢气,而该生物化学过程所需自由能明显低于瘤胃甲烷生成过程,硝酸盐可以竞争甲烷菌生长代谢所需氢气而阻断瘤胃甲烷生成;2)硝酸钠降解过程中产生亚硝酸钠,累积的亚硝酸钠会对瘤胃微生物产生毒性,在一定程度上可影响甲烷菌活性[4-5]。BES的结构类似于辅酶M(甲烷形成的关键酶),可特异性作用于甲烷菌,抑制甲烷菌产甲烷作用最后一步中辅酶的脱甲基还原作用,最终抑制甲烷产生[6-7]。当瘤胃氢气利用生物化学过程的自由能降低时,瘤胃氢气生成加强且有利于乙酸生成;当瘤胃氢气利用被阻断(甲烷菌受抑制)时,瘤胃氢气生成加强且有利于丙酸生成[8]。这2种不同甲烷抑制机制可能导致不同的瘤胃氢气和挥发性脂肪酸生成模式。本试验通过研究甲烷生成生物化学代谢产物气体、氢气、甲烷和挥发性脂肪酸等指标,揭示不同剂量下硝酸钠和BES 2种甲烷抑制剂对瘤胃甲烷、氢气和挥发性脂肪酸生成模式的影响机制。
1 材料与方法
1.1 试验材料
1.1.1 试验动物及瘤胃液采集
试验动物为2只装有永久性瘤胃瘘管的湘东黑山羊。饲粮精粗比为40∶60,即稻草300 g/d和精料200 g/d,自由饮水。每天08:00和18:00分2次等量饲喂。试验当天,在晨饲前1 h,从2只瘘管羊取得新鲜瘤胃液,迅速装入保温瓶带回实验室。
1.1.2 人工瘤胃培养液
人工瘤胃营养液的配制参照Menke等[9]的方法。将采集的瘤胃液用6层脱脂纱布过滤,量取600 mL的瘤胃液迅速加入到准备好的400 mL人工瘤胃营养液中(瘤胃液与人工瘤胃营养液体积比为1∶4),制成混合人工瘤胃培养液,其中整个过程的温度保持在39.5℃,通入纯二氧化碳以保持厌氧环境(以刃天青变成无色来判断),用磁力搅拌器搅拌以保持瘤胃液与营养液混合均匀。
1.1.3 甲烷抑制剂
试验用硝酸钠和BES:从Sigma-Aldrich公司购买,纯度≥99.0%。
1.1.4 体外瘤胃发酵设备
本研究采用的全自动体外瘤胃发酵设备包括厌氧瓶、三通电磁阀、培养箱、压力传感器、计算机和气相色谱仪[10]。培养箱设定:振荡频率50 r/min和培养温度39.5℃。厌氧瓶通过导管与三通电磁阀和压力传感器连接。压力传感器与计算机连接,每分钟测定并记录瓶中压力,通过压力与气体体积间关系计算气体产量[11]。三通电磁阀受计算机控制,当厌氧瓶中压力超过9 kPa,电磁阀打开,厌氧瓶中气体释放,并通过导管进入气相色谱仪(安捷伦7890A,美国)测定发酵瓶顶部空间氢气和甲烷含量。氢气(甲烷)产量根据厌氧瓶顶部空间大小、压力与气体体积的转化系数和氢气(甲烷)含量进行计算,方法参考文献[11]。
1.2 试验方法
1.2.1 试验设计
试验设7个组:对照组(无任何处理,A组);硝酸钠组设3个添加剂量,分别是0.10、0.20和0.40 mg/mL(N1、N2和 N3组);BES 组设 3 个添加剂量,分别是 0.63、1.26 和 2.52 mg/L(B1、B2和B3组)。每个培养瓶为1个平行,重复3次。
1.2.2 体外瘤胃发酵试验操作
称取0.6 g底物(0.3 g玉米粉 +0.3 g稻草秸秆)置入145 mL厌氧发酵瓶中,分别添加不同剂量的甲烷抑制剂,置于39.5℃的培养箱中预热。然后向厌氧发酵瓶中通入二氧化碳以保证发酵瓶中为厌氧环境。最后用瓶口分液器向每个发酵瓶中加入60 mL人工瘤胃培养液。
1.2.3 发酵液样品采集与挥发性脂肪酸产量测定
24 h发酵终止,取2 mL发酵液,15 000 r/min和4℃条件下离心10 min,取1.5 mL上清液体,加入0.15 mL 25%偏磷酸固定,静置 15 min后,-20℃保存。样品在常温条件下解冻,15 000 r/min和4℃条件下离心10 min,取0.6 mL装于测定瓶中,在气相色谱仪(安捷伦7890A,美国)中测定发酵液样品中挥发性脂肪酸各组分含量,计算产量[10]。
1.3 数据统计处理
应用非线性软件(NLREG)程序,按照Wang等[12-13]提出的模型对体外瘤胃发酵产气曲线进行拟合。起始底物降解速率(FRD0,h-1)的计算公式参考 Wang 等[12-13]提出的模型。
数据用Excel初步记录并做简单处理,然后采用SPSS 12.0软件对数据利用一般线性模型(GLM)程序进行方差(ANOVA)分析和Duncan氏多重比较,使用正交多项比较(orthogonal polynomial contrast)分析各个指标随大黄和大黄素添加量变化的趋势。P<0.05时,差异显著。
2 结果与分析
2.1 硝酸钠和BES对产气参数的影响
添加不同剂量硝酸钠和BES对体外瘤胃发酵气体的生成曲线具有影响(图1)。由表1可见,与对照组相比,添加0.4 mg/mL硝酸钠(N3组)显著降低了潜在最大产气量、产气量、产气速率和起始底物降解速率(P<0.05),分别减少了 46.27%、40.07%、50.00% 和 93.71%。随着硝酸钠添加剂量的增加,潜在最大产气量、产气量和起始底物降解速率均呈线性下降的变化趋势(P<0.05)。与对照组相比,随着BES添加剂量的增加,潜在最大产气量和产气量呈现下降趋势,但没有显著影响(P>0.05)。添加 0.63(B1组)和 1.26 mg/L BES(B2组)对起始底物降解速率没有显著影响(P>0.05),添加2.52 mg/L BES显著增加了起始底物降解速率(P<0.05)。与BES组相比,添加高剂量硝酸钠(0.4 mg/mL)对体外瘤胃发酵气体的生成曲线影响更大(图1)。硝酸钠添加剂量为0.4 mg/mL时,体外发酵潜在最大产气量、产气速率和起始底物降解速率均显著低于BES组(P<0.05)。
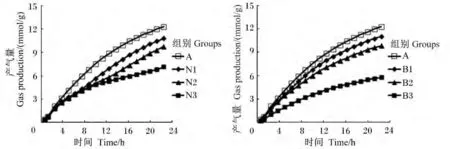
图1 不同添加剂量硝酸钠和BES对体外瘤胃发酵气体生成曲线的影响Fig.1 Effects of different supplemental levels of NaNO3 and BES on gas production curve of in vitro rumen fermentation
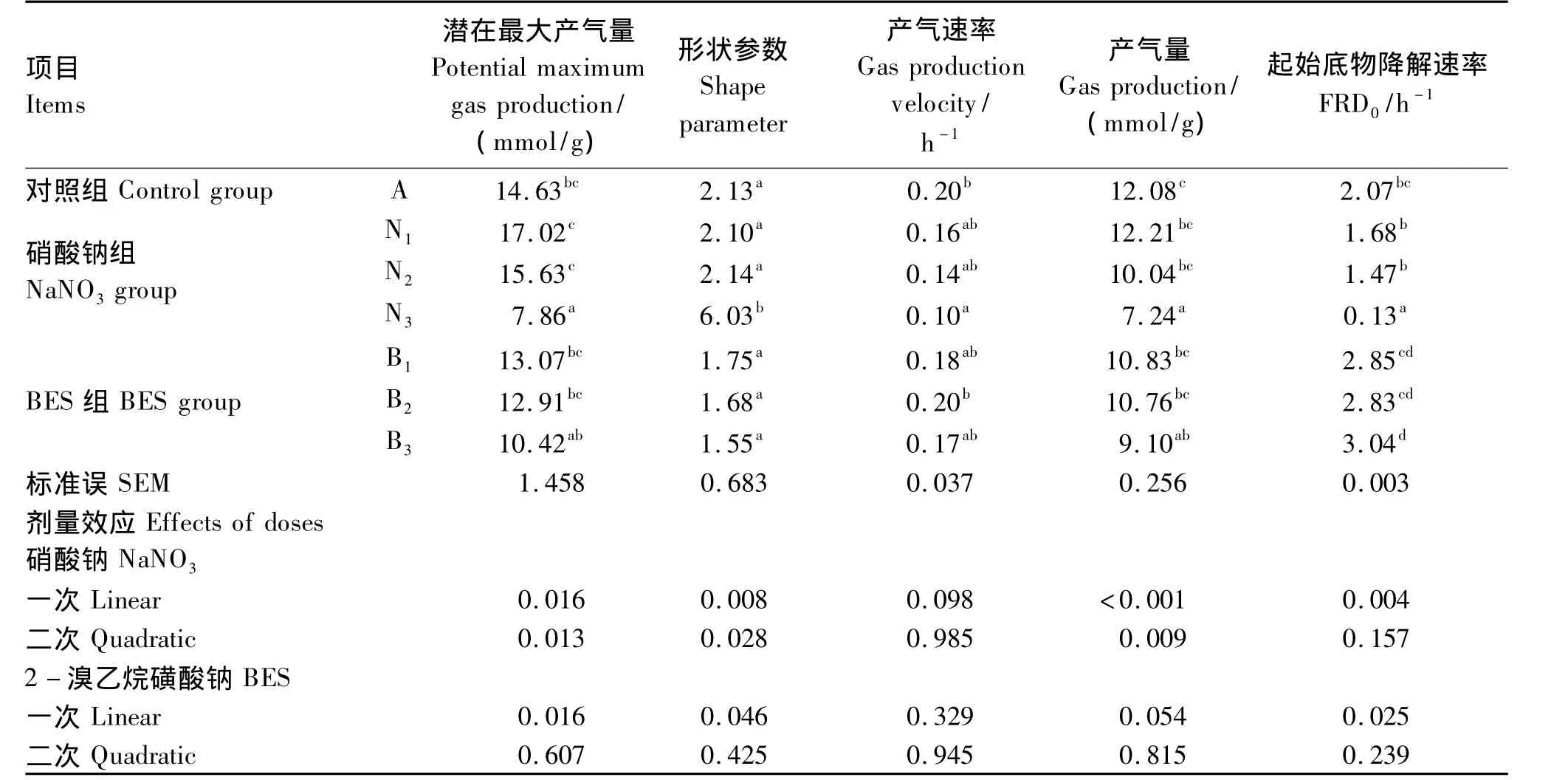
表1 不同添加剂量硝酸钠和BES对体外瘤胃发酵产气参数的影响Table 1 Effects of different supplemental levels of NaNO3 and BES on parameters of gas production of in vitro rumen fermentation
2.2 硝酸钠和BES对甲烷、氢气含量及产量的影响
不同添加剂量硝酸钠和BES对体外瘤胃发酵甲烷和氢气的含量和产量的影响见表2,甲烷含量及产量曲线见图2,生成速率曲线见图3,氢气含量及产量曲线见图4。
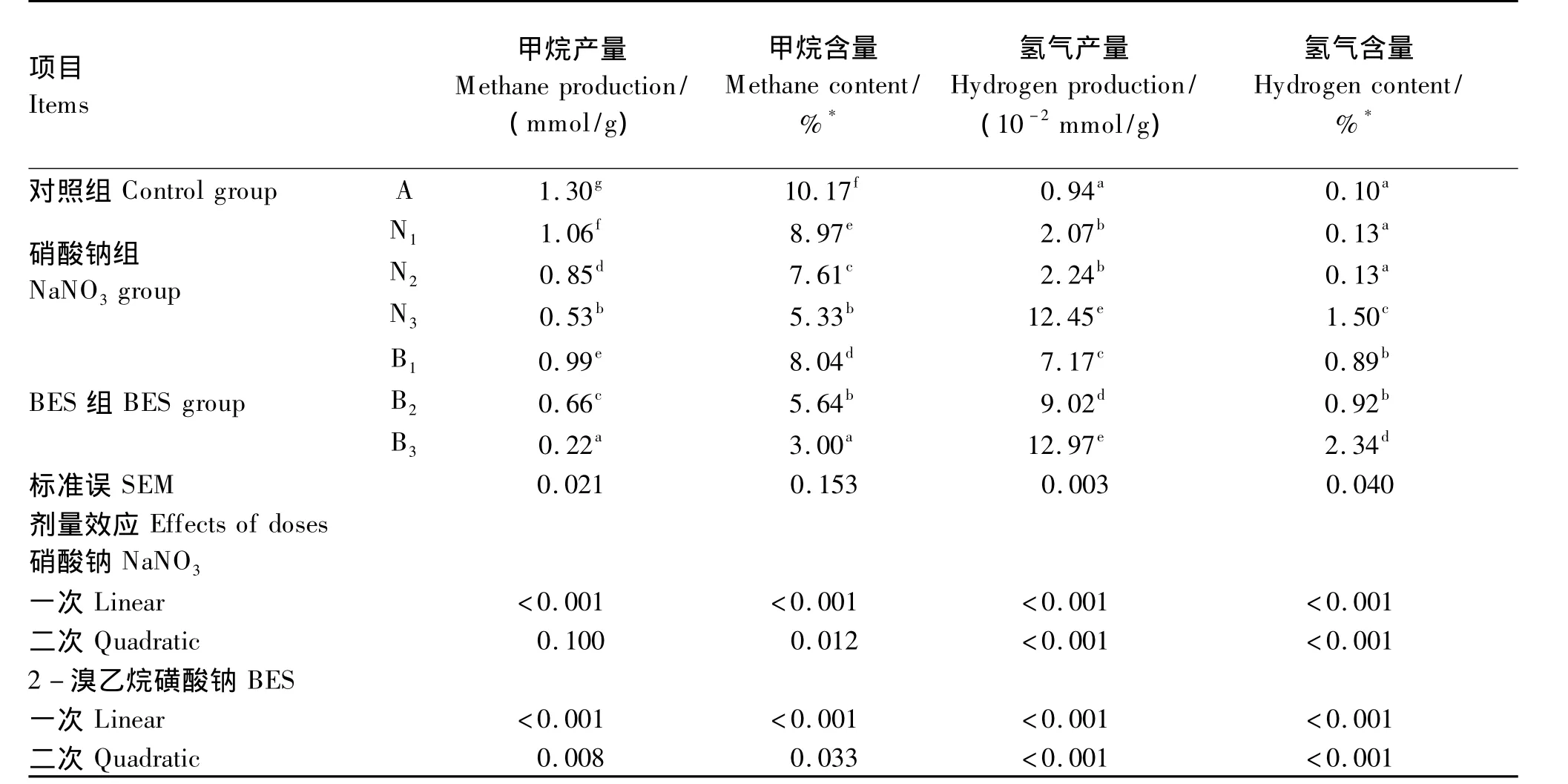
表2 不同添加剂量硝酸钠和BES对体外瘤胃发酵甲烷和氢气的含量和产量的影响Table 2 Effects of different supplemental levels of NaNO3 and BESon in vitro methane and hydrogen concentration and production
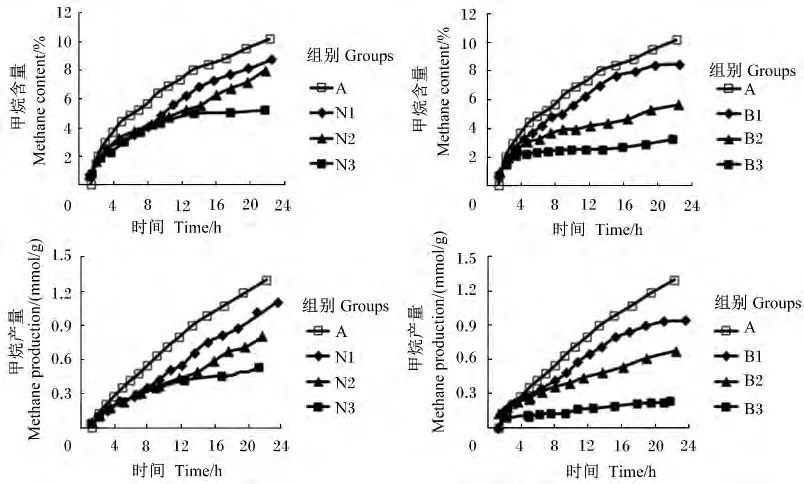
图2 不同添加剂量硝酸钠和BES对体外瘤胃发酵甲烷含量及产量曲线的影响Fig.2 Effects of different supplemental levels of NaNO3 and BES on methane content and production curves of in vitro rumen fermentation
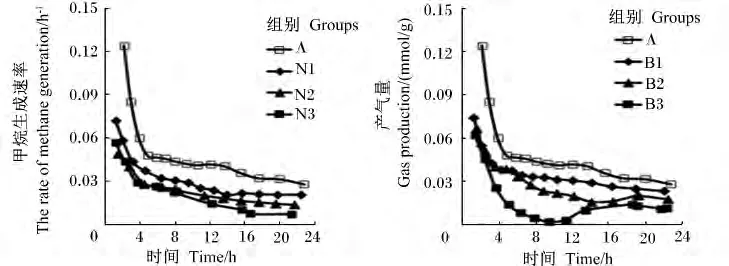
图3 不同添加剂量硝酸钠和BES对体外瘤胃发酵甲烷生成速率曲线的影响Fig.3 Effects of different supplemental levels of NaNO3 and BESon the velocity curve of methane production of in vitro rumen fermentation
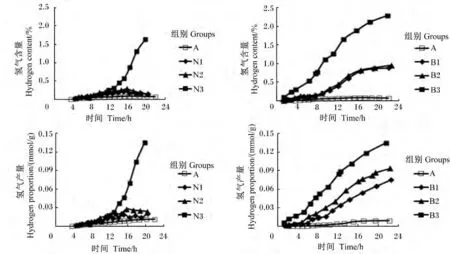
图4 不同添加剂量硝酸钠和BES对体外瘤胃发酵氢气含量及产量曲线的影响Fig.4 Effects of different supplemental levels of NaNO3 and BES on in vitro kinetics of on hydrogen content and production curves of in vitro rumen fermentation
2.2.1 甲烷含量及产量
添加硝酸钠和BES对24 h甲烷含量及产量的生成曲线影响较大(图2)。与对照组相比,添加不同剂量的硝酸钠均显著降低了甲烷含量及产量(P<0.05)。添加0.1、0.2 和 0.4 mg/mL 硝酸钠降低甲烷产量18.46%、34.62%、59.23%。与对照组相比,添加不同剂量的BES均显著降低了甲烷含量及产量(P <0.05),添加0.63、1.26 和2.52 mg/L BES分别降低甲烷产量 23.85%、49.23%、83.07%(表2)。对照组、硝酸钠组和添加0.63 mg/L BES的瘤胃甲烷生成速率随发酵时间呈不断下降的趋势;添加1.26 mg/L BES的甲烷生成速率随发酵时间呈先下降后趋于稳定的趋势;添加2.52 mg/L BES的甲烷生成速率随发酵时间呈先下降后上升的趋势(图3)。随着硝酸钠和BES添加剂量的增加,甲烷含量及产量呈线性下降的变化趋势(P<0.05)。与硝酸钠组相比,添加高剂量BES(2.52 mg/L)对体外瘤胃发酵甲烷的生成曲线影响更大(图2)。BES添加剂量为2.52 mg/L时,甲烷产量及含量均显著低于硝酸钠组(P<0.05)。
2.2.2 氢气含量及产量
添加0.4 mg/mL硝酸钠和BES组对氢气含量及产量的生成曲线均影响较大(图4)。与对照组相比,添加0.1和0.2 mg/mL硝酸钠均显著增加氢气产量(P<0.05),但氢气含量无显著变化(P<0.05);添加0.4 mg/mL硝酸钠和BES组均显著增加了氢气含量及产量(P<0.05)。随着硝酸钠和BES添加剂量的增加,氢气含量及产量呈线性上升的变化趋势(P<0.05)(表2)。当硝酸钠添加0.1和0.2 mg/mL时,氢气生成曲线与对照组相似;当硝酸钠添加0.4 mg/mL时,氢气产量及含量在0~24 h呈现不断上升趋势,24 h氢气产量是对照组的13.24倍(图4)。
添加0.63和1.26 mg/L BES的氢气含量随时间(0~16 h)呈现不断上升的变化趋势,16 h以后无明显变化;添加2.52 mg/L BES的氢气含量随时间呈现不断上升变化趋势;而添加不同剂量BES的氢气产量均呈现不断上升的趋势(图4)。当BES添加2.52 mg/L时,氢气产量是对照组的13.80倍,与0.4 mg/mL硝酸钠的氢气产量无显著差异(P>0.05),两者氢气产量显著高于其他添加剂量的BES和硝酸钠组(P<0.05)(表2)。
2.3 硝酸钠和BES对挥发性脂肪酸产量及组成的影响
由表3可见,不同添加剂量的硝酸钠和BES对于乙酸的产量无显著影响(P>0.05)。硝酸钠组丙酸产量与对照组无显著差异(P>0.05),而BES组丙酸产量显著高于对照组(P<0.05),并随着剂量的增加,呈现线性上升的变化趋势(P<0.05)。随着硝酸钠和BES添加剂量的增加,硝酸钠组总挥发性脂肪酸产量呈现不断下降趋势,其中添加0.4 mg/mL硝酸钠能够显著降低总挥发性脂肪酸产量(P<0.05)。而BES组总挥发性脂肪酸产量与对照组无显著差异(P>0.05)。另外,添加硝酸钠对乙丙比无显著影响(P>0.05),而BES可以显著降低乙丙比(P<0.05)且随添加剂量增加呈现线性下降趋势(P<0.05)。
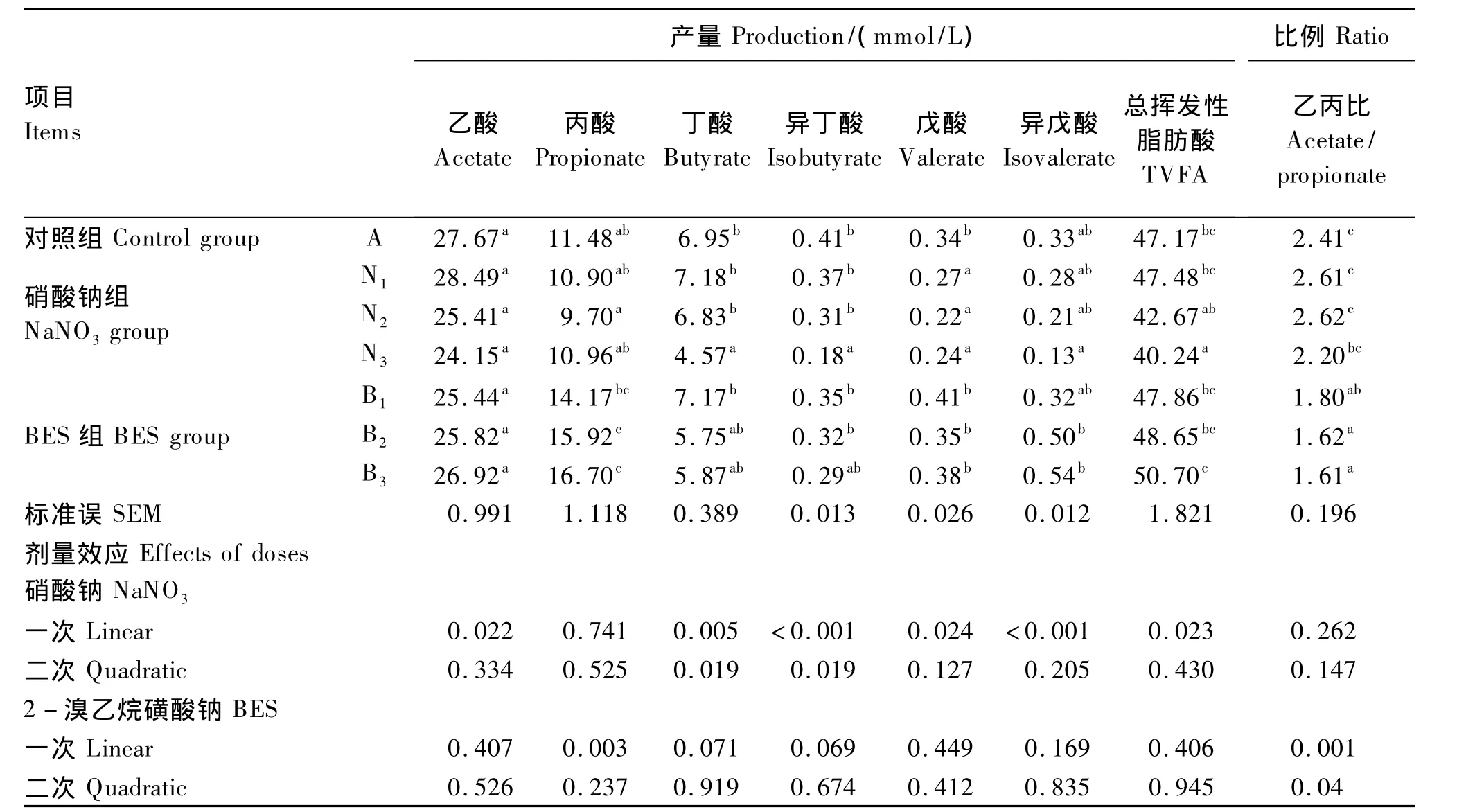
表3 不同水平硝酸钠和BES对体外瘤胃发酵挥发性脂肪酸产量和组成的影响Table 3 Effects of different levels of NaNO3 and BES on in vitro volatile fatty acids production and molar proportion of individual volatile fatty acids
3 讨论
3.1 硝酸钠和BES对体外瘤胃发酵甲烷生成的影响
硝酸盐可作为电子受体与甲烷菌竞争氢,抑制甲烷生成[14-15]。另外,硝酸钠还具有抑菌功能,可能抑制瘤胃微生物活性[16-17]。从化学计量角度看,硝酸钠完全还原成氨消耗8个氢,即还原1 mol的硝酸盐可以降低1 mol甲烷排放。因此,0.10、0.20 和 0.40 mg/mL 硝酸钠理论上应该减少甲烷产量分别为 0.07、0.14 和 0.28 mmol,而实际甲烷产量分别减少了0.14、0.27 和0.46 mmol,理论值远远低于实测值。这说明,除硝酸盐作为电子受体抑制甲烷生成外,硝酸钠的抑菌功能也是导致甲烷产量减少的另一因子。例如,添加0.4 mg/mL硝酸钠显著降低了潜在最大产气量、产气量和产气速率。起始底物降解速率随硝酸钠添加剂量增加呈线性下降变化趋势,结果说明添加硝酸钠可能会影响到瘤胃微生物对饲料的降解、消化和利用。在硝酸盐还原菌的作用下,硝酸盐很快转化成亚硝酸盐。如果亚硝酸盐无法快速被降解,造成亚硝酸盐累积,累积亚硝酸盐会对瘤胃微生物产生毒性,进而会影响瘤胃微生物对饲料的降解、消化和利用,使产气量和甲烷产量减少[4]。
与硝酸盐的抑菌机制不同,BES通过抑制辅酶脱甲基还原作用,抑制甲烷产生。适量添加BES不影响瘤胃其他微生物活性,对干物质消失率和产气量没有显著影响[18]。Nollt等[19]报道,添加0.01和0.03 mmol/L BES可分别减少了24 h甲烷产量的90.6%和93.9%。在本研究中,添加2.52 mg/L(0.012 mmol/L)BES 甲烷产量减少了83.07%。BES对甲烷抑制效果相差10%左右,这是因试验动物品种及饲喂饲粮不同所产生。添加0.63和1.26 mg/L BES对产气量无显著影响,而添加2.52 mg/L BES显著降低了产气量。Ungerfeld等[20]研究表明,瘤胃内氢分压会抑制微生物能量代谢中呼吸链的电子传递,进而影响瘤胃微生物的活性。添加高剂量BES会降低产气量,这可能因发酵瓶中大量氢气累积抑制微生物能量代谢。
本试验对照组的甲烷生成速率随发酵时间延长呈现不断下降趋势,这是发酵底物不断消耗所致。BES组甲烷生成速率随发酵时间延长呈先下降后上升趋势,高剂量组最明显。这说明,8 h后,BES对甲烷产生的抑制作用出现减弱,甲烷生成速率不断增加。Tomkins等[21]报道,饲粮中添加BES可以减少甲烷的排放,但是瘤胃微生物对BES有一定的适应性。另外,24 h内,硝酸盐对甲烷产生的抑制作用没有出现减弱,甲烷生成速率随发酵时间延长呈现不断下降趋势。
3.2 硝酸钠和BES对体外瘤胃发酵氢气生成的影响
硝酸盐还原菌利用氢气还原硝酸盐生成氨的过程中所需要的自由能为-254 J/mol,而甲烷菌利用氢气和二氧化碳合成甲烷所需要的自由能为-16.9 J/mol[22]。与甲烷合成相比,硝酸盐还原成氨的过程所需要的氢分压更低。这说明,硝酸盐可与瘤胃氢反应而成为氢池(hydrogen sink)。因此,从理论上讲,添加硝酸盐会减少瘤胃内氢气含量。但试验结果正好相反。例如,添加0.1和0.2 mg/mL的硝酸钠氢气生成曲线与对照组相似,而添加0.4 mg/mL硝酸钠的氢气生成曲线呈现明显的上升趋势。这说明,硝酸钠抑制甲烷生成不仅通过氢池方式,硝酸盐代谢过程形成中间体亚硝酸盐毒性可直接抑制抑制甲烷生成。中间体亚硝酸盐毒性导致氢气利用速率下降,大量氢气积累。
与硝酸盐的抑菌机制不同,BES通过抑制辅酶脱甲基还原作用来抑制甲烷菌对氢气的利用[23]。因此,添加BES抑制甲烷产生常常伴随着大量氢气的积累。本试验结果同样显示,添加BES增加了氢气的含量及产量,但其氢气累积会在8 h后出现拐点,这说明氢气产生速率出现降低。BES对甲烷菌的抑制作用出现减弱,这是导致氢气产生速率降低的一个重要原因。与BES组不同,高剂量硝酸盐的氢气累积曲线在24 h内没有明显拐点,这说明硝酸盐对甲烷菌的抑制作用没有出现减弱现象。
3.3 硝酸钠和 BES对体外瘤胃发酵挥发性脂肪酸生成的影响
挥发性脂肪酸的产量和组成是衡量瘤胃发酵模式的重要指标。一方面,硝酸钠可以作为氢池消耗瘤胃氢,这有助于更多的产氢产物乙酸生成;另一方面,硝酸钠代谢过程产生的中间体亚硝酸钠具有毒性,可以直接抑制瘤胃微生物(包括甲烷菌)活性,使氢气利用率减少,引起氢气累积,这有助于更多的耗氢产物丙酸生成[24-25]。在本试验中,添加0.1和0.2 mg/mL硝酸钠的总挥发性脂肪酸产量与对照组无显著差异,但添加0.4 mg/mL硝酸钠显著降低了总挥发性脂肪酸产量。这从侧面表明,低剂量硝酸钠同样会对瘤胃微生物产生毒性。但是,低剂量硝酸钠所引起瘤胃微生物毒性低于高剂量硝酸钠。结果说明,在瘤胃中培育硝酸盐还原菌对于安全使用硝酸钠非常重要,否则将引起饲养家畜硝酸盐中毒。这与目前许多瘤胃微生物试验报告结果相一致[4,26-27]。
与硝酸钠不同,在本研究结果中,添加BES增加了丙酸产量。BES特异性地抑制产甲烷最后一步中辅酶的活性[19],减少甲烷菌对瘤胃内氢的利用,结果瘤胃内氢大量累积,这有助于生成更多耗氢产物(丙酸)和降低乙丙比,发酵模式趋向于丙酸型发酵。
4 结论
①硝酸钠抑制甲烷生成不仅通过氢池方式,还可以通过中间体亚硝酸盐毒性参与抑制甲烷生成。氢代谢路径与硝酸钠添加量密切相关。
②BES通过抑制辅酶脱甲基还原作用来抑制甲烷菌对氢气的利用。氢代谢路径与BES添加量无关。
[1] GOEL G,MAKKAR H P S.Methane mitigation from ruminants using tannins and saponins[J].Tropical Animal Health and Production,2012,44(4):729 -739.
[2] MURRAY R M,BRYANT A M,LENG R A.Rates of production of methane in the rumen and large intestine of sheep[J].British Journal of Nutrition,1976,36(1):1-14.
[3] 刘开朗,王加启,卜登攀,等.瘤胃甲烷调控方法评述[J].中国微生态学杂志,2009,21(4):354 -358.
[4] ZHOU Z M,YU Z T,MENG Q X.Effects of nitrate on methane production,fermentation,and microbial populations in vitro ruminal cultures[J].Bioresource Technology,2012,103(1):173 -179.
[5] GUO W S ,SCHAEFER D Μ,GUO Χ Χ,et al.Use of nitrate-nitrogen as a sole dietary nitrogen source to inhibit ruminal methanogenesis and to improve microbial nitrogen synthesis in vitro[J].Asian-Australasian Journal of Animal Sciences,2009,22(4):542 -549.
[6] KHIAOSA A R,BRYNER S F,SCHEEDER M R,et al.Evidence for the inhibition of the terminal step of ruminalα-linolenic acid biohydrogenation by condensed tannins[J].Journal of Dairy Science,2009,92(1):177-188.
[7] NOLLET L,DEMEYER D,VERSTRAETE W.Effect of 2-bromoethanesulfonic acid and peptostreptococcus productus ATCC 35244 addition on stimulation of reductive acetogenesis in the ruminal ecosystem by selective inhibition of methanogenesis[J].Applied and Environmental Microbiology,1997,63(1):194 -200.
[8] 张春梅.植物油及十八碳不饱和脂肪酸对瘤胃甲烷生成和微生态的影响[D].博士学位论文.杭州:浙江大学,2008.
[9] MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro[J].The Journal of Agricultural Science,1979,93(1):217-222.
[10] MUETZEL S,HUNT C L,TAVENDALE M H.Brief communication:evaluating rumen fluid from sheep and cattle as inoculum in a newly developed automated in vitro rumen batch culture system[J].Proceeding of the New Zealand Society of Animal Production,2011,71:240-242.
[11] WANG M,JANSSEN P H,SUN X Z,et al.A mathematical model to describe in vitro kinetics of H2gas accumulation[J].Animal Feed Science and Technology,2013,184(1/2/3/4):1 -16.
[12] WANG M,TANG S X,TAN Z L.Modeling in vitro gas production kinetics:derivation of logistic-exponential(LE)equations and comparison of models[J].Animal Feed Science and Technology,2011,165(3/4):137-150.
[13] WANG M,SUN X Z,TANG S X,et al.Deriving fractional rate of degradation of logistic-exponential(LE)model to evaluate early in vitro fermentation[J].Animal,2013,7(6):920 -929.
[14] PATRA A K,YU Z T.Effective reduction of enteric methane production by a combination of nitrate and saponin without adverse effect on feed degradability,fermentation,or bacterial and archaeal communities of the rumen[J].Bioresource Technology,2013,148:352-360.
[15] ASANUMA N,IWAMOTO M,KAWTO M,et al.Numbers of nitrate-reducing bacteria in the rumen as estimated by competitive polymerase chain reaction[J].Animal Science Journal,2002,73(3):199 -205.
[16] LIN M,SCHAEFER D M,GUO W S,et al.Comparisons of in vitro nitrate reduction,methanogenesis,and fermentation acid profile among rumen bacterial,protozoal and fungal fractions[J].Asian-Australasian Journal of Animal Sciences,2011,24(4):471 -478.
[17] PATRA A K,YU Z T.Combinations of nitrate,saponin,and sulfate additively reduce methane production by rumen cultures in vitro while not adversely affecting feed digestion,fermentation or microbial communities[J].Bioresource Technology,2014,155:129 -135.
[18] LEE SY,YANG SH,LEE W S,et al.Effect of 2-bromoethanesulfonic acid on in vitro fermentation characteristics and methanogen population[J].Asian-Australasian Journal of Animal Sciences,2009,22(1):42 -48.
[19] NOLLT L,DEMEYER D,VERSTRAEE W.Effect of 2-bromoethanesulfonic acid and peptostreptococcus productus ATCC 35244 addition on stimulation of reductive acetogenesis in the ruminal ecosystem by selective inhibition of methanogenesis[J].Applied and Environment Microbiology,1997,63(1):194 -200.
[20] UNGERFELD E M,RUST S R,BOONE D R,et al.Effects of several inhibitors on pure cultures of ruminal methanogens[J].Journal of Applied Microbiology,2004,97(3):520 -526.
[21] TOMKINS N W,HUNTER R A.Methane mitigation in beef cattle using a patented antimethanogen[C]//ECKARD R.Proceedings of the 2nd Joint Australia and New Zealand Forum on non-CO2greenhouse gas emissions from agriculture.Canberra:Cooperative Research Centre for Greenhouse Accounting,2003.
[22] VAN ZIJDERVELD S M,GERRITS W J J,APAJALAHTI J A,et al.Nitrate and sulfate:effective alternative hydrogen sinks for mitigation of ruminal methane production in sheep[J].Journal of Dairy Science,2010,93(12):5856 -5866.
[23] LEE S Y,YANG S H,LEE W S,et al.Effect of 2-bromoethanesulfonic acid on in vitro fermentation characteristics and methanogen population[J].Asian-Australasian Journal of Animal Sciences,2009,22(1):42 -48.
[24] IWAMOTO M,ASANMA N,HINO T.Effects of pH and electron donors on nitrate and nitrite reduction in ruminal microbiota[J].Journal of Animal Science,2001,72(2):117 -125.
[25] RUSSELL JB.The importance of pH in the regulation of ruminal acetate to propionate ratio and methane production in vitro[J].Journal of Dairy Science,1998,81(12):3222-3230.
[26] LUND P,DAHL R,YANG H J,et al.The acute effect of addition of nitrate on in vitro and in vivo methane emission in dairy cows[J].Animal Production Science,2014,54(9):1432 -1435.
[27] MAMVURA C I,CHO S,MBIRIRI D T,et al.Effect of encapsulating nitrate in sesame gum on in vitro rumen fermentation parameters[J].Asian-Australasian Journal of Animal Sciences,2014,27(11):1577 -1583.

