饲料中糊精水平对乌克兰鳞鲤生长及糖代谢的影响
高 妍 李静辉 方珍珍 程镇燕 乔秀亭 白东清
(天津农学院水产学院,天津 300384)
糖是鱼类最廉价的无氮供能物质[1],饲料中糖水平会影响鱼类的生长和体内相关代谢活动,可起到节约蛋白质的作用[2]。现有研究表明,肉食性鱼类如翘嘴红鲌摄食低糖水平饲料后能够达到最大生长[3]。草食性鱼类如草鱼则能够耐受饲料中较高水平的[4]。多糖和寡糖通常比二糖和单糖更容易被鱼类吸收利用[5-6]。
乌克兰鳞鲤(Cyprinus carpio),又名俄罗斯鲤,是我国引进的养殖品种[7],与普通鲤鱼相比生长快、个体大、抗病力强、出肉率高[8]。目前有关饲料糖水平对乌克兰鳞鲤生长,消化酶活性和糖代谢的影响还未见报道。基于此,本研究以糊精为糖源,设计不同糖水平饲料,养殖8周后,测定肝胰脏和肠道中的消化酶活性、血清和肝胰脏中糖代谢酶活性以及肝胰脏和肠道中代谢酶的表达量,旨在探讨饲料糊精水平对乌克兰鳞鲤生长、消化和糖代谢的影响,为杂食性鱼类饲料研发提供参考。
1 材料与方法
1.1 试验设计
乌克兰鳞鲤购自天津市西青区水产技术推广站,运至天津农学院校内实践基地,用商业饲料(粗蛋白质32%,粗脂肪≥10%,粗灰分15.0%,钙0.5% ~1.5%,总磷 0.7%)驯化 1周后,挑选体表无外伤、健康活泼、大小均匀的幼鱼随机分配于6个方形塑料箱(78 cm×58 cm×46 cm)内。将塑料箱随机分为2组,每组3个重复(塑料箱),每个重复50尾试验鱼,试验鱼平均体重为3.92 g,平均体长为6.44 cm。以鱼粉、豆粕、酪蛋白、花生粕、棉籽粕、菜籽粕为蛋白质源,大豆油为脂肪源,糊精为糖源,配制糖水平分别为15%和25%,蛋白质水平为30%的2种试验饲料。所有饲料原料均过80目筛,原料逐级放大混匀后,用双螺杆制粒机制成颗粒饲料,饲料自然风干后保存备用。试验饲料组成及营养水平见表1。粗蛋白质含量采用ThermoFisher scientific FLASH-2000全自动蛋白质测定仪测定,粗脂肪含量采用Gerhadt Soxtherm索氏浸提系统测定。
1.2 饲养管理
试验期间水温为29~31℃,溶氧浓度 >6 mg/L,氨氮含量≤0.05 mg/L,自然光照,并连续充气。投饲率为体重的3% ~4%,每日投喂时间为08:30和15:30,投饵1 h后,用虹吸法吸去排泄物,换水1/3~1/2,养殖时间为8周。
1.3 样品采集
饲养结束后,禁食48 h,逐箱称重,随机从每箱取10尾鱼,从尾静脉采血,并以4 500 r/min的转速离心15 min,制得血清样品。采完血样的鱼,立即在冰上解剖,取肝胰脏及前肠、中肠、后肠。血清和组织样品在液氮中速冻后,转入-80℃低温冰箱中保存,待测。
余下的鱼禁食48 h后,进行再投喂,之后在0、3、6、12、24、48 h 时取其肝胰脏和全肠液氮速冻后,转入-80℃低温冰箱中保存,用于糖代谢酶基因表达的测定。
1.4 生长指标计算公式

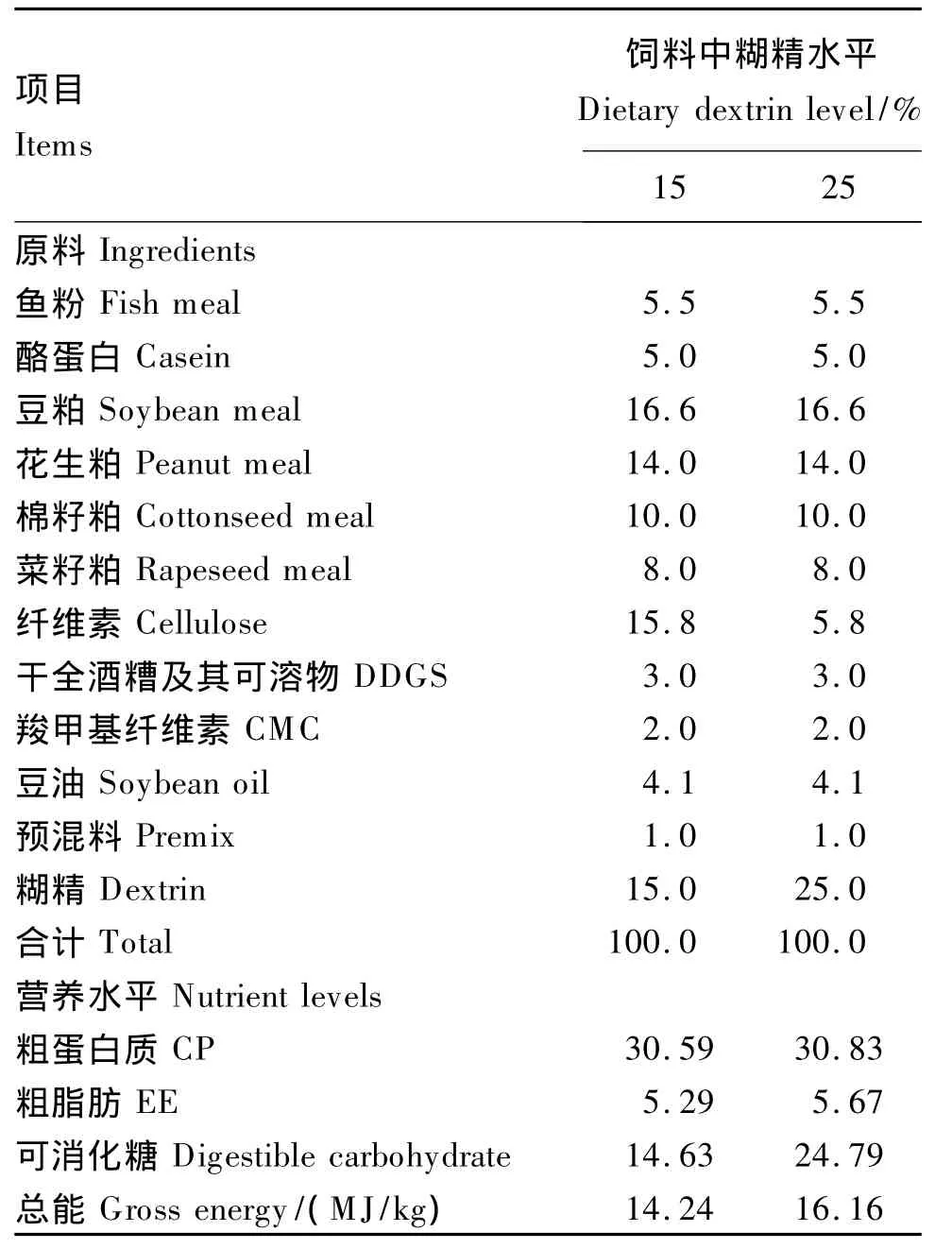
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.5 生化指标的测定
肝胰脏、肠道解冻后用预冷的生理盐水冲洗干净并用滤纸吸干后称重。组织与预冷的生理盐水按1∶9的比例冰浴匀浆,然后在4℃下3 000 r/min离心15 min,取上清液待测。脂肪酶(lipase,LPS)所用粗酶液制备时组织与预冷生理盐水按1∶4的比例冰浴匀浆。
组织中蛋白质含量(A045-2),血清中葡萄糖(F006)、甘油三酯(F001-2)和胆固醇(F002-2)含量,肝胰脏和肠道中淀粉酶(amylase,AMS)(C016)、LPS(A054)活性,肝糖元(A03)、肌糖元(A03)含量由南京建成生物工程研究所生产的试剂盒测定。胰蛋白酶(trypsin,TRY)活性测定采用福林酚法[9]。
1.6 糖代谢酶活性的测定
采用南京建成生物工程研究所试剂盒测定的指标如下:己糖激酶(HK)(A077)、丙酮酸激酶(PK)(A076)、苹果酸脱氢酶(MDH)(A021)。采用上海通蔚生物公司试剂盒测定的指标有:葡萄糖激酶(GK)(ml025826)和葡萄糖-6-磷酸酶(G6Pase)(ml025824)。
1.7 糖代谢酶基因表达的分析
1.7.1 总RNA的提取及cDNA第1链合成
采用 RNAiso Plus(9108,TaKaRa公司)提取乌克兰鳞鲤的总RNA。试验用的所有离心管、枪头等用具均经过去RNA酶处理,再经过高温高压处理后烘干备用。提取操作按试剂盒说明书所示步骤操作。使用PrimeScriptTM1st strand cDNA Synthesis Kit(6110A,TaKaRa公司)反转录试剂盒,按照说明书所示步骤进行。
1.7.2 GK和G6Pase mRNA表达的半定量分析
GK[10]和 G6Pase[11]引物均由生物工程(上海)股份有限公司合成。基于β-肌动蛋白(β-actin)的mRNA水平在多数器官组织中稳定表达,以β-actin作为内参基因。以乌克兰鳞鲤肝胰脏、肠道的cDNA为模板,采用rTaq DNA聚合酶(DRR001A,TaKaRa公司)以上述引物进行 PCR扩增,扩增体系为25 μL,含 10×PCR Buffer、GK上游引物(10μmol/L)或 G6Pase上游引物(20μmol/L),GK 下 游 引 物(10 μmol/L)或G6Pase下游引物(20 μmol/L)各 0.5 μL,rTaq酶、cDNA 1μL。95℃预变性5 min;94℃变性30 s,59 ℃ 退火 45 s,72 ℃ 延伸 1 min,30 个循环;最后72℃延伸5 min。β-actin基因片段的扩增除引物为β-actin上游引物和下游引物[12]外,其余均与上述反应相同。根据目的基因与内参基因PCR产物量的比值计算样品中GK和G6Pase mRNA的相对表达量。
1.8 数据处理与统计分析
采用SPSS18.0统计软件进行,采用单因素方差分析(one-way ANOVA)方法,组间试验数据用独立t检验进行显著性比较。同组不同时间段基因表达量数据,用Duncan氏法多重检验分析试验结果平均值的显著性,结果均用平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 饲料中糊精水平对乌克兰鳞鲤生长的影响
如表2所示,25%糊精组的SGR显著高于15%组(P<0.05)。25% 糊精组的 PER、CF和HSI均高于15%糊精组,但差异不显著(P>0.05)。25%糊精组的FCR低于15%糊精组,但差异不显著(P >0.05)。
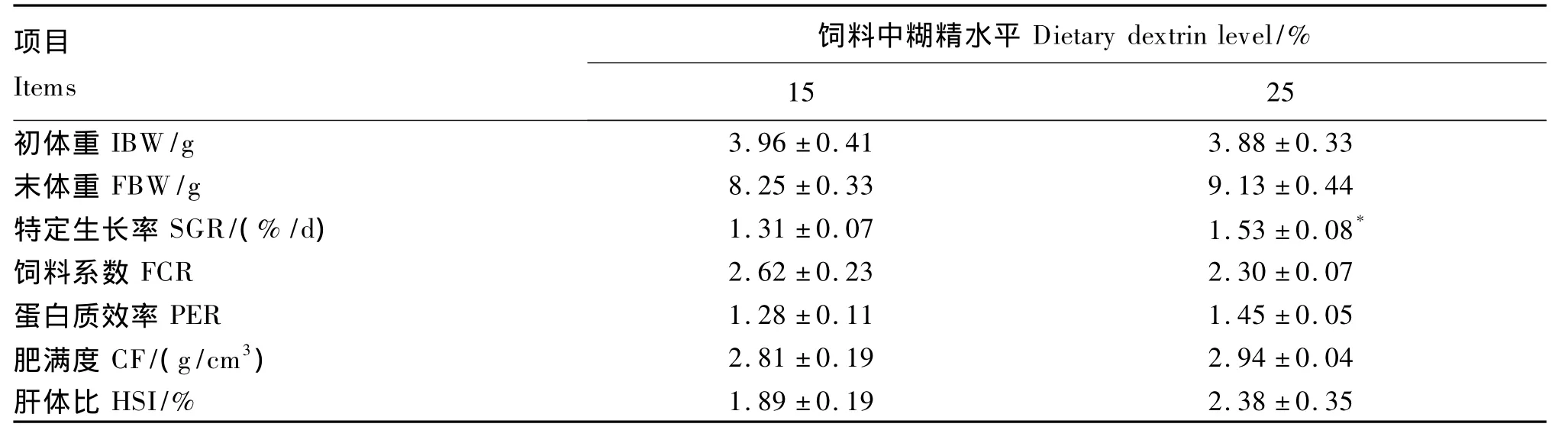
表2 饲料中糊精水平对乌克兰鳞鲤生长的影响Table 2 Effects of dietary dextrin level on growth of Ukraine scaly carp(Cyprinus carpio)
2.2 饲料中糊精水平对乌克兰鳞鲤肝糖元、肌糖元及血清甘油三酯、胆固醇、葡萄糖含量的影响
如表3所示,25%糊精组的肝糖元含量高于15%组,而肌糖元含量则低于15%糊精组,但差异均未达显著水平(P>0.05)。25%糊精组的血清甘油三酯、胆固醇和葡萄糖含量显著高于15%糊精组(P <0.05)。
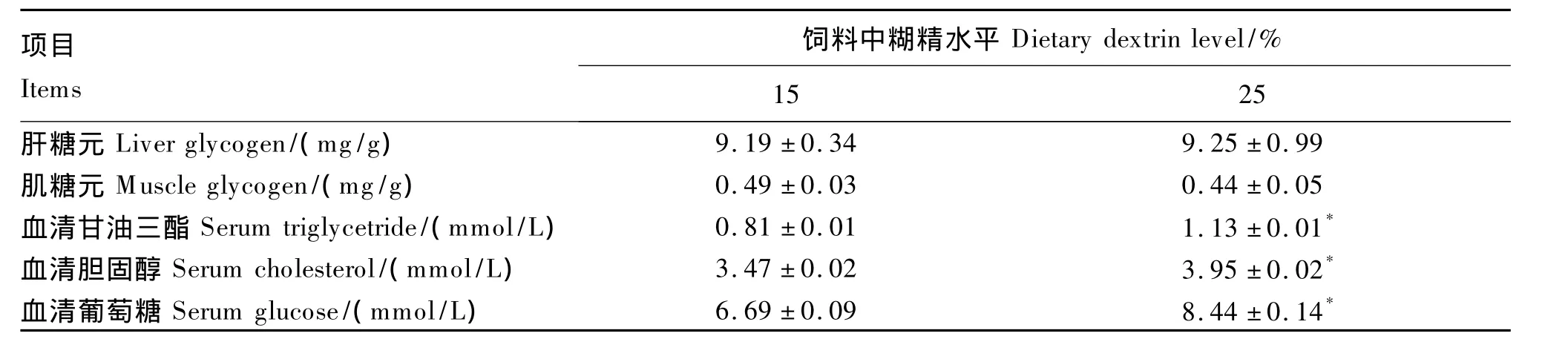
表3 饲料中糊精水平对乌克兰鳞鲤糖元、甘油三酯、胆固醇和葡萄糖含量的影响Table 3 Effects of dietary dextrin level on glycogen,triglycetride,cholesterol and glucose contentsof Ukraine scaly carp(Cyprinus carpio)
2.3 饲料中糊精水平对乌克兰鳞鲤消化酶活性的影响
如表4所示,15%糊精组肝胰脏、前肠、中肠AMS活性显著高于 25%糊精组(P<0.05)。15%糊精组前肠和后肠LPS活性显著高于25%糊精组(P<0.05)。15%糊精组肝胰脏、前肠、中肠TRY活性均显著高于25%糊精组(P<0.05),而后肠TRY活性则显著低于25%糊精组(P<0.05)。
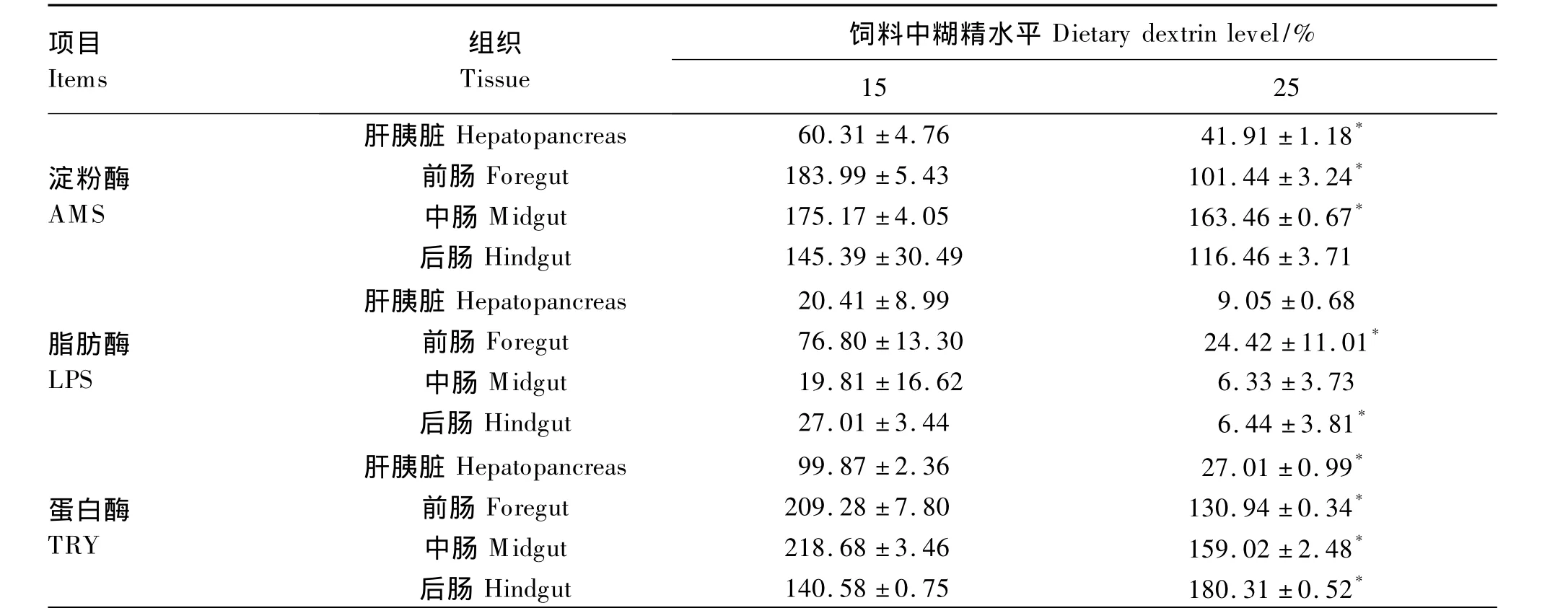
表4 饲料中糊精水平对乌克兰鳞鲤消化酶活性的影响Table 4 Effects of dietary dextrin levels on digestive enzyme activities of Ukraine scaly carp(Cyprinus carpio) U/g prot
2.4 饲料中糊精水平对乌克兰鳞鲤糖代谢酶活性的影响
如表5所示,25%糊精组血清和肝胰脏HK和GK活性显著高于15%糊精组(P<0.05)。25%糊精组血清PK和MDH活性显著高于15%糊精组(P<0.05)。25%糊精组肝胰脏MDH活性显著低于15%糊精组(P<0.05),而肝胰脏G6Pase活性与之相反,显著高于15%糊精组(P<0.05)。
2.5 禁食再投喂后饲料中糊精水平对乌克兰鳞鲤糖代谢酶基因表达的影响
如表6所示,从禁食48 h到再投喂48 h,2组试验鱼肝胰脏中GK mRNA的表达量均是先升高后降低的趋势,在12 h时,表达丰度达到最高。其中12 h时15%糊精组GK mRNA的表达量显著高于0、3、6、24和48 h时(P<0.05);而12 h时25%糊精组GK mRNA的表达量显著高于0、3、6和48 h时(P <0.05),且12 h 时GK mRNA的表达量是48 h时的3.5倍左右。在24 h时25%糊精组GK mRNA的表达量显著高于15%糊精组(P<0.05)。由此可见,提高饲料中糊精水平虽能诱导肝胰脏 中GK基因的表达,但效果并不太明显。
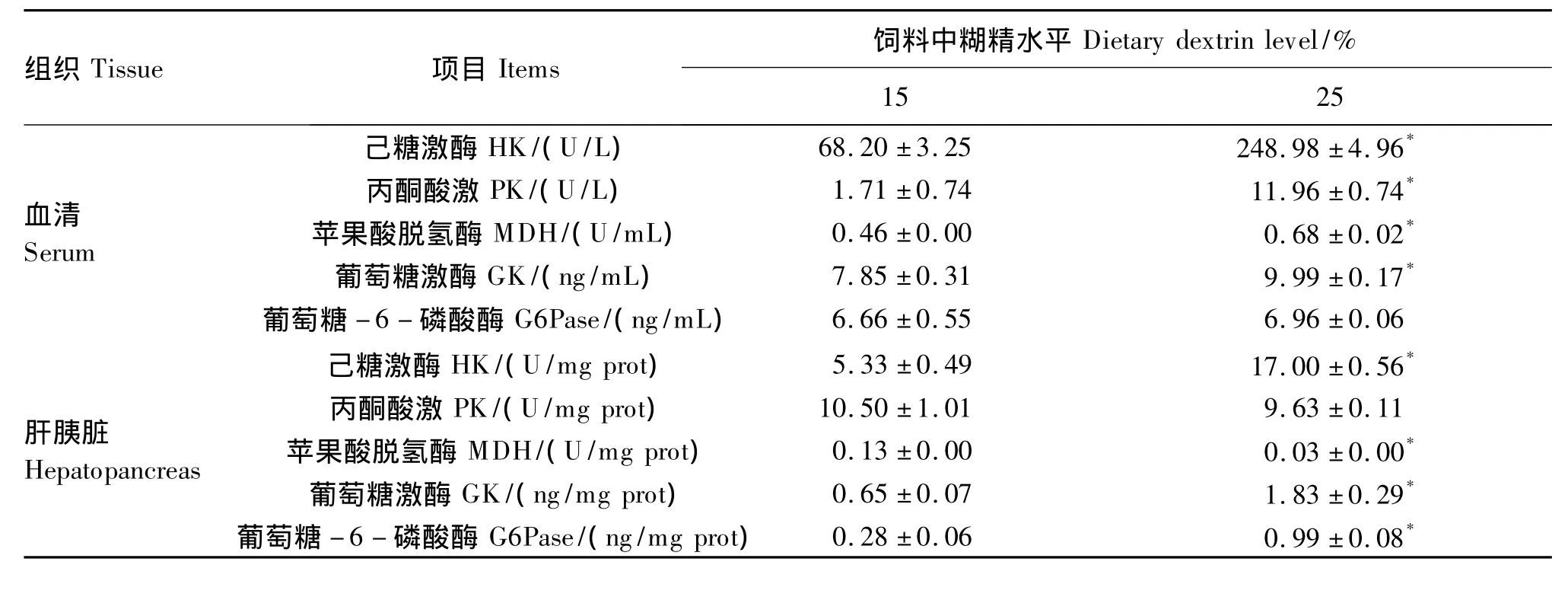
表5 饲料中糊精水平对乌克兰鳞鲤糖代谢酶活性的影响Table 5 Effects of dietary dextrin level on carbohydrate metabolism enzyme activities of Ukraine scaly carp(Cyprinus carpio)
GK mRNA的表达量在肠道中随时间的变化趋势与在肝胰脏中相似,但在肠道中25%糊精组GK mRNA的表达量低于15%糊精组,并在12 h时有显著差异(P<0.05),其他各时间段均无显著差异(P >0.05)。在12 h时GK mRNA的表达量显著高于3、48 h时(P <0.05),与6、24 h时无显著差异(P>0.05)。由此可见,饲料中糊精水平的提高并未诱导鱼类肠道中GK基因的表达,反而在低糊精水平时GK基因的表达更高些。
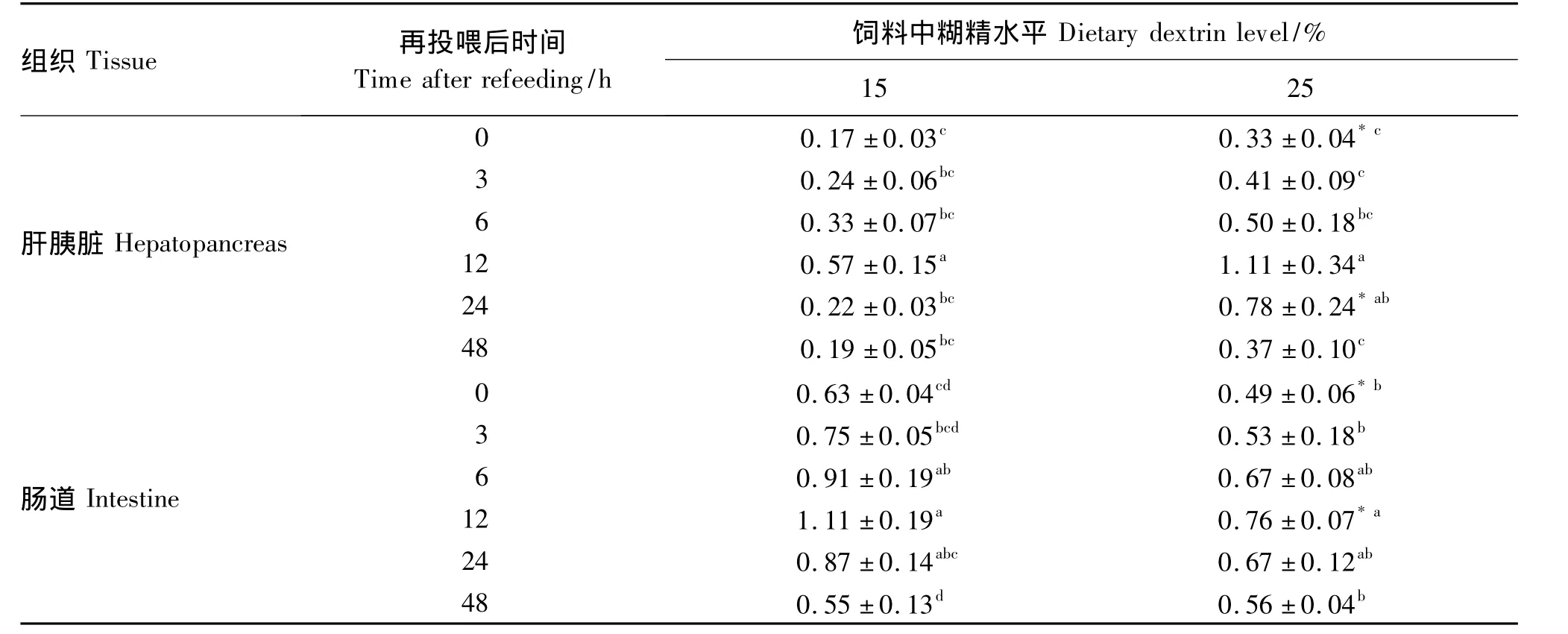
表6 禁食再投喂后饲料中糊精水平对乌克兰鳞鲤GK mRNA表达的影响Table 6 Effects of dietary dextrin level on GK mRNA expression level of Ukraine scaly carp(Cyprinus carpio)after fasting and refeeding
如表7所示,从禁食48 h到再投喂48 h,2组试验鱼肝胰脏G6Pase mRNA的表达量变化趋势均是先升高后降低,25%糊精组在6 h时达到最大值,15%糊精组在24 h时达到最大值,均显著高于同一糊精水平其他时间点的表达量(P<0.05)。在3和6 h时,2组试验鱼肝胰脏G6Pase mRNA的表达量有显著差异(P <0.05)。
肠道中2组试验鱼G6Pase mRNA的表达量变化趋势与在肝胰脏中相同,均是先升高后降低,且都在24 h时达到最大值。各时间点25%糊精组肠道中G6Pase mRNA的表达量均高于15%糊精组,但差异不显著(P >0.05)。
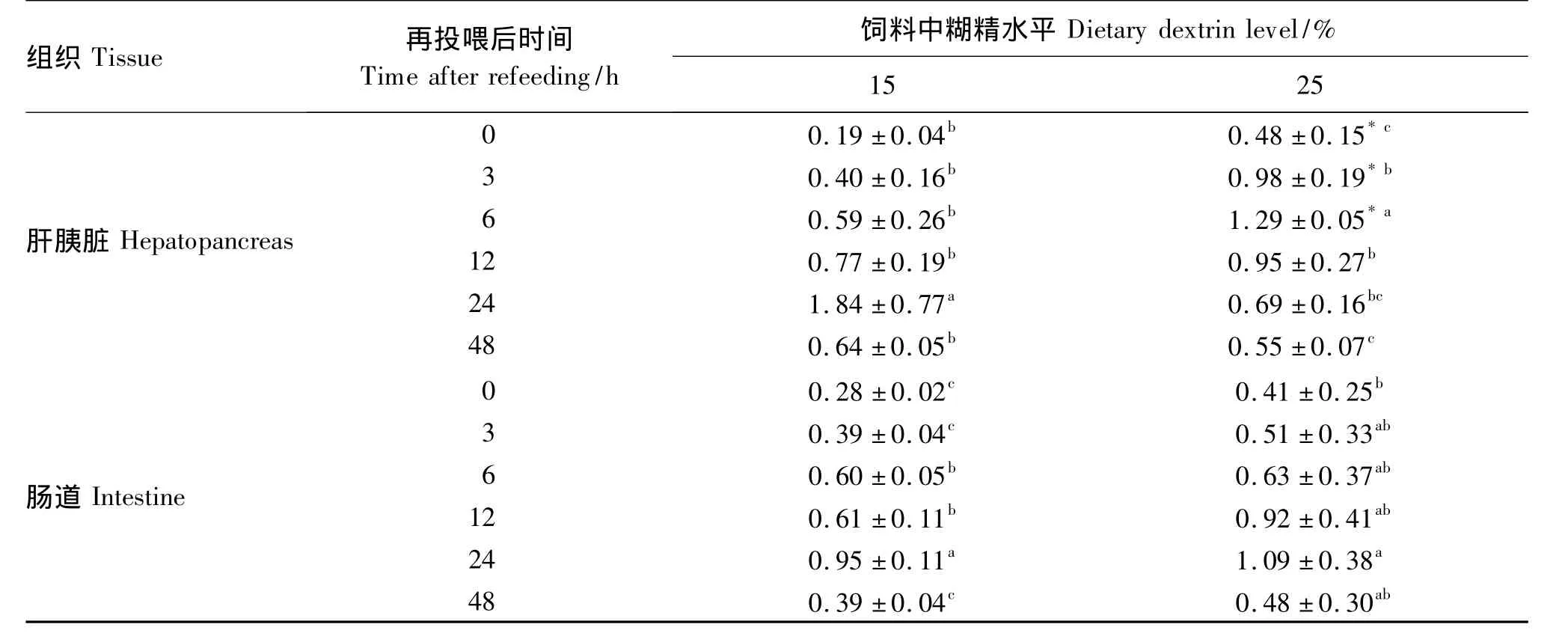
表7 禁食再投喂后饲料中糊精水平对乌克兰鳞鲤G6Pase mRNA表达量的影响Table 7 Effects of dietary dextrin level on G6Pase mRNA expression level of Ukraine scaly carp(Cyprinus carpio)after fasting and refeeding
3 讨论
3.1 饲料中糊精水平对乌克兰鳞鲤生长的影响
杂食性鱼类对糊精的利用能力要好于葡萄糖[13],因此本试验选用糊精作为乌克兰鳞鲤饲料中糖的主要来源。本研究结果表明,在饲料蛋白质水平为30%时,25%糊精组SGR显著高于15%糊精组,说明提高饲料中糖水平能够促进乌克兰鳞鲤的生长,对饲料中的蛋白质有节约作用。鱼类由糖类合成脂肪的场所主要位于肝脏[14],本试验中25%糊精组HSI高于15%糊精组,可能原因是糖类在鱼体内转化成脂肪,蓄积在肝胰脏导致肝体指数上升。
饲料中的糖类除被鱼体氧化分解供能外,还可转化合成糖元或通过磷酸戊糖途径提供合成脂肪的材料[2]。本试验中,饲料中糊精水平对肝糖元和肌糖元含量无显著影响,但25%糊精组血清甘油三酯、胆固醇和葡萄糖含量均显著高于15%糊精组,说明提高饲料中糖水平可以促进鱼体内糖代谢和脂肪合成过程。
3.2 饲料中糊精水平对乌克兰鳞鲤消化酶活性的影响
消化酶是指由消化系统和消化腺分泌的,起营养消化作用的酶类,消化酶活性大小与食物组成比例有一定的关系[15]。AMS是把淀粉分解成糖的碳水化合物分解酶[16]。TRY在蛋白质分解中起到重要作用,在幽门盲肠细胞中合成无活性的胰蛋白酶原,分泌到肠腔后被内切蛋白酶激活[17]。
本试验中,15%糊精组各组织消化酶活性均高于25%糊精组,并且肝胰脏中TRY和AMS活性低于肠道中相应酶活性,由此可见肠道是乌克兰鳞鲤蛋白质和淀粉的主要消化器官。强俊等[18]研究不同水平糊化玉米淀粉对奥尼罗非鱼仔稚鱼生长的影响时发现,18%组TRY活性显著高于24%组,与本研究结果相近。有研究表明,杂食性鱼类AMS活性与饲料中糖水平呈正相关[19],任鸣春等[20]认为鱼体大小可能影响饲料中淀粉利用率,大规格团头鲂能够耐受饲料中较高水平的淀粉,并且能够将其转化为能量。而本试验中15%糊精组肝胰脏、前肠和中肠中AMS活性显著高于25%糊精组,其原因可能与鱼体大小有关。刘襄河等[13]研究了饲料糊精水平从10%提高至30%对暗纹东方鲀消化酶活性的影响,结果表明,肝脏和肠道LPS活性不受饲料糊精水平的影响,但15%糊精组肠道LPS活性高于25%糊精组,这与本研究结果相似。
3.3 饲料中糊精水平对乌克兰鳞鲤糖代谢酶活性的影响
糖酵解和糖异生是鱼体内糖代谢的主要途径。糖酵解的第1步是葡萄糖磷酸化生成6-磷酸葡萄糖,催化这个反应的酶有HK和GK。HK和GK活性对维持动物体血糖动态平衡,增加对糖的利用有重要意义[21-22]。PK可催化磷酸烯醇式丙酮酸生成丙酮酸,丙酮酸可生成乙酰CoA进入三羧酸循环。糖酵解过程中产生的磷酸二羟丙酮可生成3-磷酸甘油,3-磷酸甘油与乙酰CoA是合成甘油三酯的直接原料[23]。MDH普遍存在于动物、植物、细菌中,是生物糖代谢的关键酶之一,能催化苹果酸和草酰乙酸之间的转换[24],草酰乙酸的浓度是决定三羧酸循环速度的关键因素之一。三羧酸循环中的一些中间产物是合成氨基酸的前体物质。G6Pase作为糖异生途径的第1个限速酶,对氧化6-磷酸葡萄糖去磷酸化生成葡萄糖从而保持血糖的恒定有着重要的作用[25]。
本试验中,25%糊精组血清和肝胰脏HK和GK活性显著高于15%糊精组,说明提高饲料中糖水平可以诱导糖代谢酶活性增强,促进鱼体对糖的转化利用,这与本试验中25%糊精组血清中甘油三酯和胆固醇含量升高的结果相互印证。张世亮等[26]研究了不同糖与脂肪比例对瓦氏黄颡鱼肝脏糖酵解酶活性的影响,发现GK活性随着饲料糖水平的升高而增强。本试验中,25%糊精组肝胰脏MDH活性显著低于15%糊精组,Kumar等[27]研究糊化淀粉和未糊化淀粉对南亚野鲮三羧酸循环的调节时发现MDH活性随淀粉水平的升高而下降,与本研究结果一致。此外,25%糊精组肝胰脏G6Pase活性显著高于15%糊精组,有关饲料营养成分对鱼体内G6Pase活性的影响比较复杂,存在不同的调控机制[28],对欧洲舌齿鲈的研究表明饲料中糖水平对肝脏G6Pase活性无显著影响[29],而饲料高糖水平对金头鲷的G6Pase活性有抑制作用[30]。
3.4 饲料中糊精水平对乌克兰鳞鲤糖代谢酶基因表达的影响
GK和G6Pase都是糖代谢的关键酶,Polakof等[31]在虹鳟胰腺中的研究中表明高糖组GK的表达水平高于对照组,杨莹等[32]研究了瓦氏黄颡鱼肝脏中GK的表达情况,结果表明糖水平能诱导GK基因的表达,这些均与本研究的结果相似。在乌克兰鳞鲤肝胰脏中,GK mRNA的表达量在25%糊精组要高于15%糊精组,而肠道中的结果与肝胰脏中相反。再摄食后12 h时,2组乌克兰鳞鲤肝胰脏和肠道中GK mRNA的表达量均达到最高,这表明在此时间段,饲料中的糖被充分消化吸收,与戈贤平等[33]在翘嘴红鲌中的研究结果相一致。
王广宇等[11]在对翘嘴红鲌的研究中发现饲料糖水平对G6Pase的表达没有显著影响,这与本试验中 G6Pase的表达情况相似。Panserat等[34]用含20%碳水化合物的饲料喂食鲤鱼、金头鲷时其体内的G6Pase表达量降低,这与本研究结果相反,虽然本试验中的饲料糊精水平对肠道G6Pase mRNA的表达量没有产生显著影响,但随糊精水平的增加有上升趋势。2组乌克兰鳞鲤肝胰脏中G6Pase mRNA的表达量达到最大的时间不同,且再投喂后3、6 h时2组的肝胰脏G6Pase mRNA的表达量有显著差异。这可能是由于不同的鱼种和组织,其糖代谢调节机制不同,具体还需进一步深入研究。
4 结论
综合分析,在本试验条件下,25%的饲料糊精水平对乌克兰鳞鲤生长和糖代谢的促进作用好于15%的饲料糊精水平。
[1] ZHOU C,LIU B,GE X,et al.Effect of dietary carbohydrate on the growth performance,immune response,hepatic antioxidant abilities and heat shock protein 70 expression of Wuchang bream,Megalobrama amblycephala[J].Journal of Applied Ichthyology,2013,29(6):1348-1356.
[2] 窦兵帅,梁萌青,郑珂珂,等.饲料中碳水化合物水平对鲈鱼生长、生理状态参数及体组成的影响[J].渔业科学进展,2014,35(1):46-54.
[3] LIU B,XIE J,GE X P,et al.Effect of high dietary carbohydrate on growth,serum physiologicalresponse,and hepatic heat shock cognate protein 70 expressionof the top-mouth culter Erythroculter ilishaeformis Bleeker[J].Fisheries Science,2012,78(3):613-623.
[4] TIAN L X,LIU Y J,YANG H J,et al.Effects of different dietary wheat starch levels on growth,feed efficiency and digestibility in grass carp(Ctenopharyngodon idella)[J].Aquaculture International,2012,20(2):283-293.
[5] ENES P,PERES H,COUTO A,et al.Growth performance and metabolic utilization of diets including starch,dextrin,maltose or glucose as carbohydrate source by gilthead sea bream(Sparus aurata)juveniles[J].Fish Physiology Biochemistry,2010,36(4):903-910.
[6] 聂琴,苗惠君,苗淑彦,等.不同糖源及糖水平对大菱鲆糖代谢酶活性的影响[J].水生生物学报,2013,37(3):425-433.
[7] 商华.优良养殖新品种——乌克兰鳞鲤[J].农村百事通,2013(6):45-46,81.
[8] 王金雨.乌克兰鳞鲤二、三倍体部分生物学性状的比较研究[D].硕士学位论文.天津:天津农学院,2010.
[9] 桂远明.水产动物动物机能学实验[M].北京:中国农业出版社,2004:113-116,119-124.
[10] PANSERAT S,FONTAGNÉ S,BERGOT P,et al.Ontogenesis of hexokinaseⅠ and hexokinaseⅣ (glucokinase)gene expressions in common carp(Cyprinus carpio)related to diet[J].British Journal of Nutrition,2001,85(6):649-651.
[11] 王广宇.日粮碳水化合物水平对翘嘴红鲌生长、血液指标及 GK、G6Pase、HSC70基因表达的影响[D].硕士学位论文.南京:南京农业大学,2009.
[12] 程汉良,姬南京,彭永兴,等.彭泽鲫葡萄糖激酶基因全长cDNA克隆及表达分析[J].动物营养学报,2011,23(7):1167-1175.
[13] 刘襄河,叶超霞,郑丽勉,等.饲料糊精水平对暗纹东方鲀幼鱼生长、消化酶活性和血液生化指标的影响[J].水产学报,2013,37(9):1359-1368.
[14] 蒋利和,吴宏玉,黄凯,等.饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响[J].水产学报,2013,37(2):245-255.
[15] 许明珠,张琴,童万平,等.饲料糖水平对方格星虫稚虫生长、体组成和消化酶活性的影响[J].动物营养学报,2013,25(3):534-542.
[16] YI T,SUN J,LIANG X,et al.Effects of polymorphisms in pepsinogen(PEP),amylase(AMY)and trypsin(TRY)genes on food habit domestication traits in mandarin fish[J].International Journal of Molecular Sciences,2013,14(11):21504-21512.
[17] MARCUSCHI M,ESPOSITO T,MACHADO M,et al.Purification,characterization and substrate specificity of a trypsin from the Amazonian fish tambaqui(Colossoma macropomum)[J].Biochemical and Biophysical Research Communications,2010,396(3):667-673.
[18] 强俊,王辉,彭俊,等.饲料碳水化合物水平对奥尼罗非鱼仔稚鱼生长的影响[J].饲料工业,2009,30(14):32-35.
[19] KROGDAHL Å,HEMRE G I,MOMMSENT P.Carbohydrates in fish nutrition:digestion and absorption in post larval stages[J].Aquaculture Nutrition,2005,11(2):103-122.
[20] 任鸣春,贾文锦,戈贤平,等.饲料不同淀粉水平对团头鲂成鱼生长性能、消化酶活性及肌肉成分的影响[J].水产学报,2014,38(9):1494-1502.
[21] 范国燕,李英文.饥饿胁迫对南方鲇幼鱼糖代谢的影响[J].重庆师范大学学报:自然科学版,2011,28(3):22-27.
[22] BOUCHARD-MERCIER A,RUDKOWSKA I,Lemieux S,et al.An interaction effect between glucokinase gene variationand carbohydrate intakes modulates the plasma triglycerideresponse to a fish oil supplementation[J].Genes and Nutrition,2014,9(3):395.
[23] 王镜岩.生物化学:下册[M].3版.北京:高等教育出版社,2002.
[24] 汪福保,罗莉,文华,等.镁对草鱼生长、形体、肝功能和糖代谢的影响[J].淡水渔业,2011,41(2):57-62,68.
[25] 张颂,蒋明,文华,等.饲料碳、脂比例对胭脂鱼幼鱼生长及糖代谢的影响[J].华南农业大学学报,2014,35(3):1-7,23.
[26] 张世亮,艾庆辉,徐玮,等.饲料中糖/脂肪比例对瓦氏黄颡鱼生长、饲料利用、血糖水平和肝脏糖酵解酶活力的影响[J].水生生物学报,2012,36(3):466-473.
[27] KUMAR V,SAHU N P,PAL A K,et al.Modulation of key enzymes of glycolysis,gluconeogenesis,amino acid catabolism,and TCA cycle of the tropical freshwater fish Labeo rohita fed gelatinizedand non-gelatinized starch diet[J].Fish Physiology and Biochemistry,2010,36(3):491-499.
[28] 刘波,唐永凯,俞菊华,等.饲料脂肪对翘嘴红鲌生长、葡萄糖激酶和葡萄糖-6-磷酸酶活性与基因表达的影响[J].中国水产科学,2008,15(6):1024-1033.
[29] ENES P,PANSERAT S,KAUSHIK S,et al.Effect of normal and waxy maize starch on growth,food utilization and hepatic glucose metabolism in European sea bass(Dicentrarchus labrax)juveniles[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2006,143(1):89-96.
[30] ENES P,PANSERAT S,KAUSHIK S,et al.Hepatic glucokinase and glucose-6-phosphatase responses to dietary glucose and starch in gilthead sea bream(Sparus aurata)juveniles reared at two temperatures[J].Comparative Biochemistry and Physiology Part A:Molecular& Integrative Physiology,2008,149(1):80-86.
[31] POLAKOF S,SKIBA-CASSY S,KAUSHIK S,et al.Glucose and lipid metabolism in the pancreas of rainbow trout is regulated at the molecular level by nutritional status and carbohydrate intake[J].Journal of Comparative Physiology Part B:Biochemical Systemic and Environmental Physilogy,2012,182(4):507-516.
[32] 杨莹.日粮糖水平对瓦氏黄颡鱼幼鱼生长和糖代谢相关酶基因表达的影响[D].硕士学位论文.上海:华东师范大学,2011.
[33] 戈贤平.不同糖、脂含量日粮对翘嘴红鲌相关糖代谢酶的调节研究[D].博士学位论文.南京:南京农业大学,2006.
[34] PANSERAT S,PLAGNES-JUAN E,KAUSHIK S.Gluconeogenic enzyme gene expressions is decreased by dietary carbohydrate in common carp(Cyprinus carpio)and gilthead seabream(Sparus aurata)[J].Biochimica et Biophysica Acta:Gene Structure and Expression,2002,1579(1):35-42.

