外周血检测中国非小细胞肺癌患者EGFR基因突变的Meta分析
荆 超,陈 龙,胡艳芬,谢贤和,3
2.福建医科大学 附属第一医院重症医学科,福州350005;
3.福建医科大学 附属第一医院化疗科,福州 350005
肺癌是发病率和死亡率最高的癌症之一。2010年,我国肺癌的发病率和死亡率分别占所有恶性肿瘤的19.59%和24.87%[1],其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的85%左右[2]。近年来针对特定肿瘤细胞或分子的靶向药物的研发逐渐成为NSCLC治疗的研究热点。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种细胞膜表面的糖蛋白受体。在正常肺组织中低表达或不表达,但在NSCLC中表达较高(40%~80%)。EGFR基因的突变状态与表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)的 疗 效 密 切 相 关[3-4]。 研 究 表 明,EGFR基因突变阳性患者对吉非替尼的有效率为50%~80%,而野生型患者的治疗有效率仅为15%[5]。因此,EGFR基因突变状态的准确筛查,对于NSCLC患者的个体化治疗具有重要意义。但NSCLC患者确诊时往往已经失去手术机会,肿瘤组织的获取较为困难,于是相对易于采集的外周血成为了肿瘤组织的替代品[6]。然而,许多专家学者也对外周血能否成为肿瘤组织检验的有效替代品提出质疑。本研究拟通过Meta分析方法对国内NSCLC患者肿瘤组织与外周血中EGFR基因突变的相关性研究做出系统评价,希望能对相关的临床实践起到一定的参考作用。
1 材料与方法
1.1 文献检索策略 以中国期刊全文数据库、维普数据库、中国生物医学文献库、万方期刊数据库、PubMed、Medline、EMBase为主要文献来源。中文检索词为“非小细胞肺癌”、“外周血”、“血浆”、“血清”、“表皮生长因子受体”等,英文检索词为“peripheral blood”、“plasma”、“serum”、“non-small cell lung cancer”、“lung cancer”等,语种为中文和英文,检索方法为主题词检索。同时利用Google Scholar、学位论文全文数据库和会议论文全文数据库补充查找文献。
1.2 纳入标准 研究对象为经病理证实的中国NSCLC患者,同时取得肿瘤组织和对应的外周血样本且分析对象为外周血游离DNA;以组织检验作为金标准,使用相同技术对外周血EGFR基因突变进行检测。检测突变位点至少包括外显子19和21。
1.3 排除标准 非国内患者、组织样本与外周血样本不匹配或检测后未做一致性比对,重复发表文献。
1.4 文献筛选与资料提取 由2位研究者根据以上检索关键词分别进行独立文献检索,通过阅读文献标题和摘要进行初步筛查,剔除非针对国内患者的实验和未进行组织与外周血匹配检测的文献。之后进一步排除重复文献,阅读全文并依据上述纳入与排除标准最终确定纳入本研究的文献。最后将2位研究者的检索结果进行交叉核对,如有分歧则由第3位研究者确定是否纳入。
1.5 统计学处理 异质性检验:若异质性检验结果提示各研究异质性显著(P≤0.10,I2>50%),采用DerSimonian-Laird随机效应模型(D-L法)计算。反之,若异质性检验提示异质性不显著(P>0.10,I2<50%),则采用Mantel Haenszel固定效应模型计算合并的比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)。
SROC曲线分析:绘制SROC曲线并计算曲线下面积(AUC值)和Q*指数。AUC值越接近1表明诊断越准确,一般认为AUC>0.9表明具有较高的诊断价值。Q*指数为SROC曲线与直线(敏感度=特异度)的交点,Q*指数越大表明诊断准确性越高。
以上分析使用Meta-DiSc 1.4软件完成。发表偏倚使用RevMan 5.1软件绘制漏斗图进行评价。
2 结 果
2.1 检索结果 通过检索期刊数据库,共检索到相关文献347篇。通过阅读标题及摘要进行初筛,排除组织样本与外周血样本不匹配以及研究对象为非国内患者的文献285篇。针对初筛获得的62篇文献进一步阅读全文,排除重复文献以及未做组织与外周血相关结果一致性比对的文献共49篇,最终纳入可供Meta分析的研究共计13项[7-19]。文献筛选流程见图1。
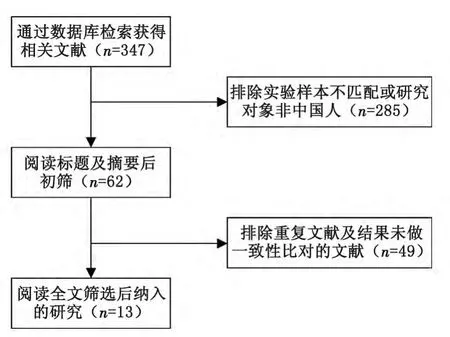
图1 文献筛选流程Fig 1 Flowsheet of RCT collection
2.2 纳入研究的基本特征 文献发表时间为2008-2014年,共纳入样本1 105例。每项研究均至少包含对EGFR外显子19,21突变的检测(表1)。

表1 纳入研究的基本特征Tab 1 Characteristics of included RCTs
2.3 Meta分析结果 随机效应模型分析结果显示,汇总后的敏感度为66% (95%CI=0.61~0.71,I2=81.6%);特异度为96%(95%CI=0.94~0.97,I2=61.9%),灵敏度对数与(1-特异度)对数的Spearman相关系数为-0.022,P=0.943,不存在阈值效应;诊断优势比为54.78(95%CI=28.11~106.75,I2=31.2%)(图2)。绘制SROC曲线,AUC=0.963 1,Q*=0.909 1(图3)。通过漏斗图分析显示没有明显的发表偏倚(图4)。

图2 敏感度、特异度、诊断优势比森林图分析Fig 2 Forest plot analysis of the sensitivity,specificity and DOR
3 讨 论
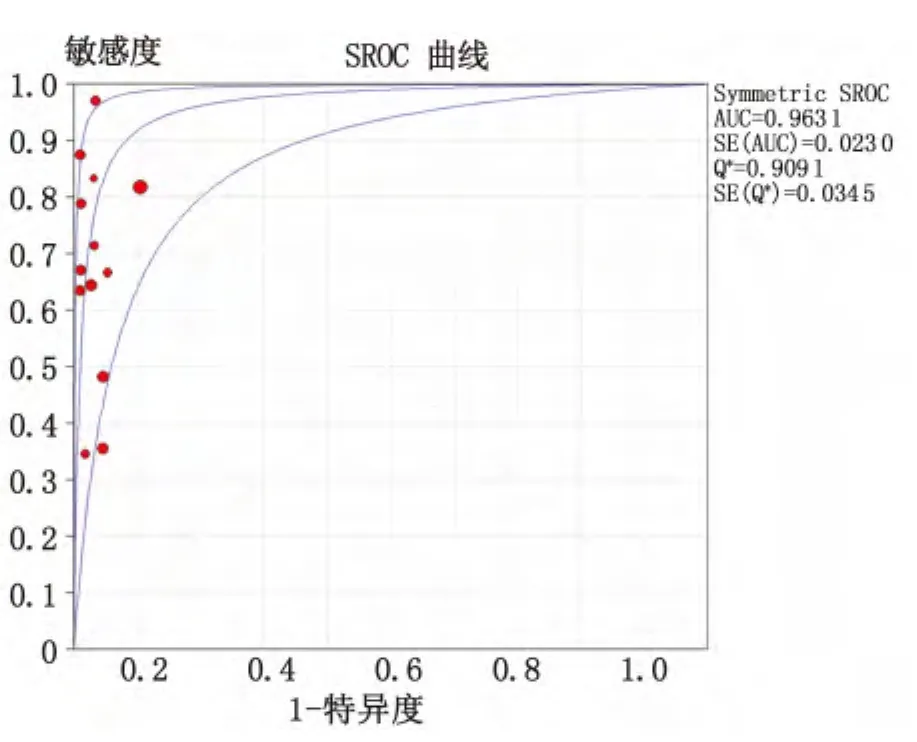
图3 纳入研究的SROC曲线分析Fig 3 SROC analysis of the included studies

图4 纳入研究的漏斗图分析Fig 4 Funnel plot analysis of the included studies
近年来,靶向酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)用于EGFR突变的NSCLC的治疗取得了诸多进展并得到了广泛应用。过去的研究已经证实,EGFR-TKI的疗效与EGFR的敏感突变之间存在关联,存在敏感突变的患者经TKI治疗的客观缓解率在30%以上,而无突变者仅为10%[20]。因此,对患者进行EGFR突变情况的准确检测成为了相关治疗的重要前提,这对于靶向治疗的个体化和节约社会医疗成本具有重要意义。一直以来,EGFR突变检测都以组织检查作为金标准,但相关组织检测存在着一定局限性。例如NSCLC患者确诊时往往已经失去手术机会,肿瘤组织的获取较为困难。由于通过穿刺方法获取的组织量不足或组织位置不准确而得到错误的结论,且在个体化治疗的过程中也有必要持续检测是否有相关敏感突变的发生[21],反复穿刺活检会给患者带来很大痛苦。因此,相关学者一直致力于寻找组织检测的有效替代品。
研究发现,肿瘤在发展过程中会有部分细胞脱落进入血液循环,当这些细胞裂解后,其中的遗传物质便会释放进循环血中,而且这些外周血中的游离核酸与肿瘤组织基因组具有相同的变异状态[22]。本研究通过Meta分析方法对国内NSCLC患者的外周血与肿瘤组织EGFR基因突变的对照研究进行了汇总分析,试图明确外周血DNA在替代组织检测方面的价值。
本研究按照纳入标准,共收纳国内外13篇相关文献,包括1 105例对照实验。从统计结果看,资料异质性检验P<0.05,I2>50%,表明研究之间存在异质性,因此采用随机效应模型进行分析。结果显示,以外周血代替组织进行EGFR基因突变检测的特异度较高而敏感度偏低。分析其可能的原因,由于外周血内的游离核酸多来自于肿瘤组织内脱落并裂解的细胞,若组织细胞内EGFR基因未发生突变,外周血中的游离DNA自然检测不出突变,因此特异度较高。而当肿瘤组织内有部分细胞发生EGFR基因突变时,脱落并进入血液循环的肿瘤细胞可能大多来自于未发生突变的组织,或者来自于突变组织的细胞数量过少因而无法检出,导致假阴性结果的出现,因此以外周血代替肿瘤组织进行EGFR基因突变检测存在一定漏诊的可能。本组中灵敏度对数与(1-特异度)对数的Spearman相关系数为-0.022,P=0.943,提示不存在阈值效应。绘制SROC曲线,得到AUC=0.963 1,Q*=0.909 1。AUC>0.9说明外周血DNA用于检测EGFR基因突变具备一定的临床价值,Q*指数较大同样说明了其在诊断上的准确性。
在本分析中,纳入的各项研究采取了不同的基因突变检测手段。在目前的突变检测中,测序法被认为是“金标准”,但其敏感度并不高。其余不同的检测手段之间存在着敏感度的差异,这可能是导致研究间异质性的重要原因。
本研究尚存在以下不足:各项研究中外周血采集时间未有统一标准,例如外周血采集是在手术前还是手术后,采血前是否经历过相关化疗等;不同研究中所采取的检测手段不尽相同,不同检测技术之间的敏感性差异可能会在结果中有所反映,以上原因均可能对最终结果产生一定的影响。
总之,本次Meta分析研究提示,外周血尚无法完全替代肿瘤组织进行EGFR基因突变检测,但可以成为组织检测的有效补充,尤其是在肿瘤组织的获取较为困难的情况下。但当外周血检测提示EGFR基因突变为阴性时,应充分考虑到可能产生的漏诊。由于外周血中提取的DNA数量较少,因此对于检测技术的敏感性要求更加苛刻。随着技术的发展,将来也可能诞生具有更强敏感性的检测手段,外周血作为组织检测的补充势必会具有广阔的应用前景。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CACancerJClinicians,2013,63(1):11-30.
[2]Group N M C.Preoperative chemotherapy for non-small-cell lung cancer:a systematic review and meta-analysis of individual participant data[J].Lancet,2014,383(9928):1561-1571.
[3]Amendt C,Staub E,Friese-Hamim M,etal.Association of EGFR expression level and cetuximab activity in patient-derived xenograft models of human non-small cell lung cancer[J].ClinicalCancerResearch,2014,20(17):4478-4487.
[4]Kobayashi K,Hagiwara K.Treatment guideline for advanced NSCLC based on driver gene mutations[J].JGenetSyndr GeneTher,2014,5(212):2.
[5]Qin B M,Xiao C,De Zhu J,etal.Identification of EGFR kinase domain mutations among lung cancer patients in China:implication for targeted cancer therapy[J].CellResearch,2005,15(3):212-217.
[6]Haber D A,Velculescu V E.Blood-based analyses of cancer:circulating tumor cells and circulating tumor DNA[J].Cancer Discovery,2014,4(6):650-661.
[7]惠福海,童向东,孙玉坤,等.23例非小细胞肺癌患者肺癌组织和血浆中EGFR外显子21的基因突变检测[J].沈阳药科大学学报,2010,27(11):928-932.
[8]白 桦,赵 军,王书航,等.变性高效液相色谱法检测非小细胞肺癌患者外周血及肿瘤组织表皮生长因子受体突变[J].中华结核和呼吸杂志,2008,31(12):891-896.
[9]吴海凤.扩增阻滞突变系统法检测非小细胞肺癌患者外周血EGFR突变的研究[D].南昌:南昌大学医学院,2013.
[10]安超伦,陆辉辉,施 海,等.非小细胞肺癌患者肿瘤组织及外周血EGFR基因突变研究[J].交通医学,2010,24(6):612-616.
[11]彭群新,赵 瑾,秦华龙,等.肺癌外周血EGFR突变检测及其临床意义[J].中国肿瘤临床,2011,38(5):263-267.
[12]杨 锦,于忠和,刘慧龙,等.实时荧光定量PCR检测非小细胞肺癌患者外周血和肿瘤组织表皮生长因子受体突变的研究[J].国际肿瘤学杂志,2011,38(6):468-471.
[13]万莉娟,邹俊韬,罗 慧,等.实时荧光定量法检测晚期NSCLC恶性胸腔积液及血液肿瘤细胞EGFR基因突变的研究[J].山东医药,2013,53(1):53-55.
[14]陈佳艳,樊 旼.智能扩增检测法检测非小细胞肺癌患者血浆及肿瘤组织中表皮生长因子受体突变的研究[J].中华结核和呼吸杂志,2012,35(8):619-620.
[15]Zhang H,Liu D,Li S,etal.Comparison of EGFR signaling pathway somatic DNA mutations derived from peripheral blood and corresponding tumor tissue of patients with advanced non-small-cell lung cancer using liquidchip technology[J].JMolecularDiagnostics,2013,15(6):819-826.
[16]Li X,Ren R,Ren S,etal.Peripheral blood for epidermal growth factor receptor mutation detection in non-small cell lung cancer patients[J].TranslationalOncology,2014,7(3):341-348.
[17]Jing C W,Wang Z,Cao H X,etal.High resolution melting analysis for epidermal growth factor receptor mutations in formalin-fixed paraffin-embedded tissue and plasma free DNA from non-small cell lung cancer patients[J].AsianPacJ CancerPrev,2013,14:6619-6623.
[18]Liu X,Lu Y,Zhu G,etal.The diagnostic accuracy of pleural effusion and plasma samples versus tumour tissue for detection of EGFR mutation in patients with advanced non-small cell lung cancer:comparison of methodologies[J].JClinical Pathology,2013,66(12):1065-1069.
[19]Zhao X,Han R B,Zhao J,etal.Comparison of epidermal growth factor receptor mutation statuses in tissue and plasma in stage I-IV non-small cell lung cancer patients[J].RespirationInternationalReviewThoracicDiseases,2012,85(2):119-125.
[20]Paez J G,J nne P A,Lee J C,etal.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[21]Jakobsen J N,Santoni-Rugiu E,Srensen J B.Changes in epidermal growth factor receptor expression during chemotherapy in non-small cell lung cancer[J].CancerChemotherapy andPharmacology,2014,73(1):131-137.
[22]Swaminathan R,Butt A N.Circulating nucleic acids in plasma and serum[J].AnnalsNewYorkAcademySciences,2006,1075(1):1-9.

