载药磁纳米微粒在荷瘤小鼠体内的靶向性实验研究
胡 瑛,郝 欢,秦 庆,于增国
载药磁纳米微粒在荷瘤小鼠体内的靶向性实验研究
胡瑛,郝欢,秦庆,于增国
目的:应用高效液相色谱法考察在外磁场协同下载阿霉素金磁复合微粒于荷瘤小鼠体内靶向分布特性。方法:建立小鼠肝细胞癌动物模型,并分成空白对照组、单纯磁阿霉素组和磁阿霉素加磁场组。空白对照组经尾缘静脉注射生理盐水,单纯磁阿霉素组和磁阿霉素加磁场组分别注射同等剂量的载阿霉素金磁复合微粒溶液,注射后于磁阿霉素加磁场组肿瘤靶区体表施加磁场固定(5 000 Gs、1 h)。然后移去磁场并立即处死各组小鼠,分别采集血液并完整摘取心、肝、肾和肿瘤组织标本。应用高效液相色谱法测定各组小鼠血液及各组织中阿霉素浓度,评价其在小鼠体内的靶向性。结果:经外置磁场固定作用后,靶区肿瘤组织中阿霉素浓度明显高于其他非靶区组织,而其他非靶区组织中(除心脏外)阿霉素浓度与空白对照组相当。在没有外置磁场作用时,阿霉素则在体内各组织中呈弥散性分布,但肝脏和肿瘤组织中阿霉素浓度较高。结论:磁纳米微粒作为药物载体具有明显的磁控靶向性,能将药物有效富聚于靶区肿瘤组织中。磁靶向药物有望成为最有效的抗肿瘤药物新剂型而用于临床。
磁靶向给药系统;肝细胞癌;阿霉素;金磁复合微粒;高效液相色谱法
0 引言
近年来,随着药物靶向治疗恶性肿瘤技术的不断研究与探索,诞生了一种以磁纳米材料为药物载体的新型靶向给药系统——磁靶向给药系统(magnetic targeted drugs delivery system,MTDS)[1]。该给药系统既有固体材料的强磁性,又具有液体材料的流动性,能在体外磁场导向作用下实现其靶向性作用,改变药物在肿瘤组织与非肿瘤组织间的分布,最大限度地将药物精确控制在靶区肿瘤组织中,并在细胞或亚细胞水平上发挥药效作用,从而达到提高化疗效果和降低毒副作用的目的[2-3]。为考察载阿霉素金磁复合微粒的靶向性,本文建立了以高效液相色谱法测定荷瘤小鼠血液及各组织器官中阿霉素浓度的方法,并对其在外磁场协同作用下的体内靶向分布特性进行了实验研究。
1 材料和方法
1.1材料
1.1.1试药
纳米金磁复合微粒(规格:30 μm,西安金磁纳米生物技术有限公司产品);阿霉素(北京华锋有限公司产品);载阿霉素金磁复合微粒溶液(载药量:10.12%,按西安金磁纳米生物技术有限公司产品配方制备);甲醇、乙腈均为色谱纯。
1.1.2仪器
高效液相色谱仪(1100型),包括四元梯度泵、二极管阵列检测器、G137PA自动脱气机、色谱工作站(日本岛津公司)等;KG21E型低温冰箱(德国Siemens公司);台式微量离心机(德国Thermo公司);WH-1漩涡振荡器(上海沪西分析仪器厂);铆铁硼稀土永久磁铁(规格:10 mm(直径)×10 mm(高)圆柱体;磁场强度为5 000 Gs,西安金磁纳米生物技术有限公司提供)。
1.1.3动物
实验采用大连大学医学院实验动物中心提供的健康昆明种小鼠30只,雌雄兼有,体质量18~22 g。
1.2方法
1.2.1荷瘤小鼠模型的建立
无菌条件下,抽取接种7 d的肝癌(H22)小鼠腹水细胞(即指数增殖期肝癌细胞),于显微镜下计数并用生理盐水将其稀释至l×107个/ml肝癌细胞悬液,然后将肝癌细胞悬液按0.15 ml/只接种至小鼠右前肢腋部皮下。正常条件下饲养,待接种7 d后即可见小鼠腋下实体瘤形成,用游标卡尺测量瘤体的长径,达到1.0 cm左右即可进行实验(如图1、2所示)。

图1 小鼠肝癌腹水细胞腋下接种
图2 1周后在腋下体表可见肿瘤凸起
1.2.2荷瘤小鼠体内靶向性实验
将30只瘤体长径约1.0 cm左右的荷瘤小鼠随机分为空白对照组、单纯磁阿霉素组和磁阿霉素加磁场组,每组10只。其中空白对照组经尾缘静脉注射生理盐水0.15 ml;单纯磁阿霉素组和磁阿霉素加磁场组各注射同等剂量载阿霉素金磁复合微粒溶液0.15 ml(10 mg/ml,相当于阿霉素0.82 mg/ml)。注射后,即刻将磁阿霉素加磁场组小鼠用戊巴比妥钠麻醉,并在体表肿瘤靶区部位施加磁场(5 000 Gs)固定(如图3、4所示)。1 h后移去磁场,将各组小鼠立即处死,并分别采集小鼠血液,完整摘取心脏、肝、肾和肿瘤组织(如图5所示),置液氮中保存。

图3 小鼠尾缘静脉注射给药
图4 小鼠肿瘤部位磁铁固定方法

图5 处死小鼠并摘取肿瘤组织
1.2.3荷瘤小鼠血液、心脏、肝、肾和肿瘤组织中的阿霉素含量测定
(1)色谱前样品预处理:①血液样品前处理:将采集的小鼠全血制备成肝素抗凝血,以5 000 r/min离心5 min,取上清血浆200 μl,加入甲醇200 μl,漩涡振荡混匀1 min;预处理后,取50 μl进样。②组织样品的处理:取出小鼠肿瘤、心脏、肝、肾待检组织,用生理盐水将残血洗净,吸干并称重,研磨成粉,加入组织质量4倍的生理盐水制成组织匀浆;取组织匀浆200 μl加入甲醇200 μl,漩涡振荡混匀1 min;预处理后取50 μl进样。
(2)色谱条件:①色谱柱ZorbaxSB-C18(250mm× 4.6 mm,5 μm);②柱温25℃;③流动相:乙腈-0.1%乙酸(28∶72,v/v);④流速0.8 ml/min;⑤检测波长:254 μm;⑥进样量50 μl。
(3)阿霉素标准储备液:200 μg/ml甲醇标准储备液,4℃保存。
(4)标准曲线的制备:应用甲醇(色谱纯)将阿霉素标准储备液依次稀释成100、10、1、0.5、0.1、0.05μg/L的标准阿霉素应用液各50 μl。在150 μl空白血浆或空白组织提取液中加入阿霉素标准应用液,配制成标准溶液。经色谱前预处理后,进样测定,记录色谱。以峰面积(Y)为纵坐标,阿霉素浓度(X)为横坐标进行线性回归,得回归方程为:Y=27 697X+5 756.8,R2= 0.999 5。样品浓度线性范围为50~1 000 ng/ml,最低检测限为5 ng/ml(S/N=3)。
1.2.4统计学方法
所有原始数据输入计算机中,应用SPSS13.0统计软件进行统计处理,以均数±标准差(±s)表示,2组间均数的比较采用t检验,当P<0.01时有显著差异。
2 结果
荷瘤小鼠血液、主要器官和肿瘤组织中阿霉素浓度比较结果见表1。
表1 小鼠血液、主要器官和肿瘤组织中阿霉素浓度比较(±s)ng/ml
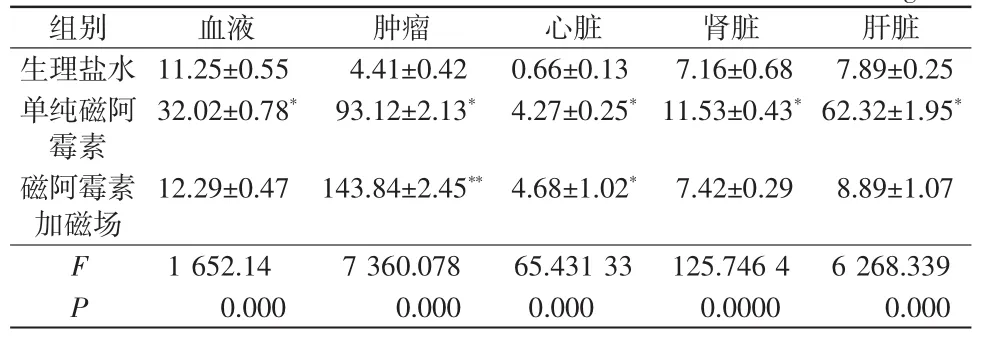
表1 小鼠血液、主要器官和肿瘤组织中阿霉素浓度比较(±s)ng/ml
注:*表示与生理盐水组比较,**表示与单纯磁阿霉素组比较
组别 血液 肿瘤 心脏 肾脏 肝脏生理盐水 11.25±0.55*004.41±0.42** 0.66±0.13*07.16±0.68*07.89±0.25*单纯磁阿霉素32.02±0.78*093.12±2.13** 4.27±0.25*11.53±0.43*62.32±1.95*磁阿霉素加磁场12.29±0.47*143.84±2.45** 4.68±1.02*07.42±0.29*08.89±1.07*F 1 652.140 7 360.078 65.431 33 125.746 4 6 268.339 P 00 00.000 00 00.000 00.000 00 000.0000 00 00.000
由表1可以看出,在血液中,单纯磁阿霉素组的药物浓度明显高于磁阿霉素加磁场组,而磁阿霉素加磁场组与生理盐水组相当;肿瘤组织中,磁阿霉素加磁场组的药物浓度远高于单纯磁阿霉素组,单纯磁阿霉素组的药物浓度亦明显高于生理盐水组;心脏组织中,单纯磁阿霉素组与磁阿霉素加磁场组间的药物浓度相当,且2组均高于生理盐水组;肾脏组织中,单纯磁阿霉素组药物浓度略高于磁阿霉素加磁场组,磁阿霉素加磁场组与生理盐水组相当;肝脏组织中,单纯磁阿霉素组的药物浓度明显高于磁阿霉素加磁场组,磁阿霉素加磁场组与生理盐水组间无差异。
3 讨论
众多研究表明,以磁纳米微粒作为药物载体的MTDS因其具有传统药物输送体系所不具备的诸如在外磁场作用下的良好靶向性、减少用药剂量及毒副作用等独特优势,而受到全球医药界的普遍关注与高度重视,已成为靶向抗肿瘤药物新剂型的研究热点[4-7]。
本实验研究显示(见表1),当载阿霉素金磁复合微粒联合外磁场给药后,其靶区肿瘤组织中的阿霉素浓度较比其他非靶向组织显著增高(P=0.000),亦远高于单纯载阿霉素金磁复合微粒给药时肿瘤组织中阿霉素浓度(P=0.000)。而其他非靶向组织中(除心脏外)阿霉素浓度却明显低于单纯载阿霉素金磁复合微粒给药,并与生理盐水组相当。这一实验结果证明,以磁纳米微粒作为药物载体的磁靶向药物具有极强的磁响应性,能在外磁场协同作用下形成物理靶向[8],有效地将药物聚集于靶区肿瘤组织中,显著提高了药物浓度并最大限度地在病灶靶部位发挥抗肿瘤作用。而且还能大幅度地改变药物在体内的分布状态,使非靶向组织中的药物含量得以极大的降低,有效地减小了药物的毒副作用。因此,相比于传统化疗的给药方式,磁靶向给药系统的应用将会获得更加理想的抗肿瘤效果。
当单纯给予载阿霉素金磁复合微粒而无外磁场协同作用时,药物则弥散分布在荷瘤小鼠的各组织中(见表1),表明载阿霉素金磁复合微粒在体内具有良好的组织扩散性与渗透性,这种特性不仅保证了载药磁性微粒在体内不发生聚集、不堵塞血管,并能均匀扩散到肿瘤组织中[9],这对提高药物的抗肿瘤效果是非常关键的。但从我们的实验中可以看出,阿霉素在荷瘤小鼠体内各组织器官及血液中的分布亦不相同,其肿瘤、肝脏、血液、肾脏、心脏组织中的阿霉素浓度呈依次性减低,即肿瘤和肝脏中的阿霉素浓度明显高于血液及其他组织。肿瘤组织中阿霉素浓度增高,表明载阿霉素金磁复合微粒除具有良好的靶向性外,对肿瘤组织具有一定的选择性[10],并且肿瘤组织中血管密度较高,可达正常肝脏的2~6倍[11],这是导致肿瘤组织中阿霉素浓度远高于正常肝脏及其他组织的主要原因。肝脏组织中阿霉素浓度高于血液及其他组织,与药物主要在肝脏中进行代谢以及肝脏中单核巨噬细胞丰富,使更多的载阿霉素金磁复合微粒被拦截或吞噬有关[12]。
此外,从本实验结果还发现,在外置磁场的协同作用下心脏组织中阿霉素浓度与没有外置磁场作用而单纯磁阿霉素给药时的药物浓度相当,且两者均明显高于生理盐水对照组,分析造成这一结果的主要原因,是由于心脏距离外置固定磁体较近所形成的非特异靶向性所致。
总之,通过对本实验研究结果的直观分析与靶向性评价,表明以磁纳米微粒作为药物载体所构建的磁靶向药物,能在外磁场作用下显示出独特磁响应性、良好靶向可控性和组织扩散性等诸多优势,有望成为最理想的抗肿瘤药物新剂型应用于临床。
[1]张景京力,张志荣,谭群友.磁靶向给药系统的研究进展[J].中国医药工业杂志,2001,32(12):564-567.
[2]成党校,唐敏章.阿霉素磁微球的制备及在家兔肺内的靶向定位[J].第四军医大学学报,1996,17(1):39-41.
[3]赵玉莹,谢忠艳,薛凡.磁性药物微球治疗恶性肿瘤的进展[J].黑龙江医学,2010,34(10):745-748.
[4]王艳萍,徐维平,苏育德,等.纳米磁性材料在肿瘤治疗中的应用研究进展[J].亚太传统医药,2012,8(3):183-184.
[5]Hofman M A,Purba J S,Swaab D F.Annual variations in the vasopressin neuron population of the human suprachiasmatic nucleus[J]. Neuroscience,1999,53(4):1 103-1 112.
[6]凌丽,张武雄,朱亮.抗肿瘤靶向微粒给药系统的研究进展[J].广东药学院学报,2010,26(1):107-110.
[7]赵志娟,丁红,罗斌华.肺靶向多柔比星微球小鼠体内组织分布特性研究[J].中国药学杂志,2012,47(5):354-357.
(▶▶▶▶)(◀◀◀◀)
[8]何强芳,李国明,朱洁民.磁性氟尿嘧啶壳聚糖微球的制备及其释药性能[J].应用化学,2006,23(2):209-211.
[9]李艳,赵玲,路西明,等.磁性微粒靶向给药系统治疗消化道恶性肿瘤的基础研究与临床初探[J].中国现代应用药学杂志,2006,23(9):925-928.
[10]龚连生,张德阳,刘恕.磁性阿霉素白蛋白纳米粒在移植性肝癌模型中的磁靶向性[J].中华肝胆外科杂志,2003,9(9):543-546.
[11]Ensminger W D,Gyves J W.Regional cancer chemotherapy[J].Cancer Treat Rep,1984,68:101-105.
[12]叶鹏,宋金春,李娟.氟尿嘧啶脂质体在小鼠体内的组织分布及靶向性评价研究[J].中国药房,2011,22(13):1 168-1 170.
(收稿:2015-01-20修回:2015-06-01)
Targeting experiment of drug-bearing magnetic nano-particle in tumor-bearing mice
HU Ying1,HAO Huan2,QIN Qing1,YU Zeng-guo2
(1.Department of Clinical Laboratory,the 210th Hospital of the PLA,Dalian 116021,Liaoning Province,China; 2.Medical College of Dalian University,Dalian 116622,Liaoning Province,China)
Objective To investigate the targeting distribution of adriamycin-bearing gold magnetic particle in the tumorbearing mice by using high-performance liquid chromatography and external magnetic field.Methods Mouse hepatocellular carcinoma models were established and then divided into a control group(group A),a group with adriamycin-bearing magnetic nano-particles(group B)and a group with external field and adriamycin-bearing magnetic nano-particles(group C).The mice in group A were administrated with physiological saline in the tail veins,and the ones in group B and C were infused with the solution of adriamycin-bearing gold magnetic particles.Some external magnetic field(5 000 Gs,1 h) was posed on the target areas of the mice in group C and then removed after a while.All the mice in the three groups were killed,and the blood and the specimens of the hearts,livers,kidneys and tumor tissues were collected.The concentrations of adriamycin in the blood and tissues were detected with high-performance liquid chromatography to evaluate in vivo targeted distribution in mice.Results External field made the adriamycin concentrations in the targeted tumor areas significantly higher than those in non-targeted areas,and the non-targeted areas except the heart had the concentrations equivalent to those in the control group.When the external field was absent,adriamycin had diffused distribution in the tissues while high concentrations in the liver and tumor tissues.Conclusion Magnetic nano-particle shows magnetically controlled targeting when used as drug-bearing carrier and can concentrate the drug in the targeted tumor tissues.Magnetically targeted drug may be popularized clinically as a new-type antineoplastic agent.[Chinese Medical Equipment Journal,2015,36(10):14-16,20]
magnetic targeted drugs delivery system;hepatocellular carcinoma;adriamycin;gold magnetic nano-particle; high-performance liquid chromatography
[中国图书资料分类号]R318;R730.53A
1003-8868(2015)10-0014-04
10.7687/J.ISSN1003-8868.2015.10.014
2014辽宁省(国家)大学生创新创业训练计划项目(201411258)
胡瑛(1983—),女,主管检验师,主要从事检验诊断学方面的研究工作,E-mail:huying_may@163.com。
116021辽宁大连,解放军210医院检验科(胡瑛,秦庆);116622辽宁大连,大连大学医学院(郝欢,于增国)
于增国,E-mail:yuzengguo@163.com

