IL-6和IGF-1在非小细胞肺癌组织的表达与临床意义
刘 涓 孙 威
(1武汉大学人民医院老年病科;2华中科技大学同济医学院附属同济医院胸外科,武汉 430030)
肺癌是全球癌症中导致死亡的最常见原因,其中非小细胞肺癌(NSCLC)占肺癌总数85%左右[1]。虽然外科手术、放疗、化疗等传统治疗NSCLC的方法有所改进,但其治疗的疗效并不令人满意。肺癌的发病除了与吸烟、环境等因素有关外,机体免疫失衡、生长因子通路失调也起着重要作用[2]。
有研究提示白介素-6(interleukin-6,IL-6)是NSCLC中关键的促肿瘤细胞因子。NSCLC患者血清中的IL-6水平较健康对照组明显升高,肿瘤组织中IL-6表达水平与总生存率相关,IL-6是NSCLC患者预后不良的指标;另外,在NSCLC细胞增殖、侵袭、迁移、血管形成中IL-6均发挥促进作用[3]。胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)是一种多肽类生长因子,能刺激肿瘤细胞增殖、抑制肿瘤细胞凋亡[4]。有研究证实在肺癌发展中,IGF-1与其受体IGF-1R结合、通过自分泌或旁分泌,促进肺癌细胞分化、生长[4]。多项研究表明IGF-1可作为多种肿瘤如乳腺癌、前列腺癌、胃癌、结直肠癌的诊断标志物[3]。有研究提示IL-6与IGF-1在多种肿瘤发生、发展中存在相互作用[5],IL-6通过激活IGF-1受体促进前列腺癌进展[6]。然而,IL-6和IGF-1在肺癌组织是否具有表达相关性尚无研究。
本研究采用免疫组织化学技术,检测IL-6、IGF-1在非小细胞肺癌组织和癌旁组织的表达,分析IL-6、IGF-1表达的相关性、及与临床病理特征的关系。
材料和方法
1.材料
武汉大学人民医院病理科收集150例非小细胞肺癌组织蜡块,所有患者符合非小细胞肺癌临床诊断标准,术前未行放疗、化疗及靶向治疗史,临床资料和手术记录完整。癌旁组织取自距肿瘤组织远端>5cm肺组织共100例。150例肺癌患者中,男86例,女64例;腺癌74例,鳞癌76例;I-II期79例,IIIIV期71例。
2.检测方法
2.1 试剂
IL-6兔多克隆抗体(21865-1-AP),IGF-1兔多克隆抗体(20214-1-AP)购自Proteintech公司,免疫组化试剂盒购自武汉谷歌生物科技公司。
2.2 苏木精-伊红(HE)染色及免疫组织化学染色
所有组织标本收集后4%多聚甲醛固定,石蜡包埋制成蜡块存档,常规连续切片4张后,1张进行HE染色以判断诊断和组织类型,2张进行IL-6、IGF-1免疫组织化学染色,留1张备用。免疫组织化学严格按试剂盒操作说明进行,切片脱水后放入抗原修复液,微波加热至沸腾,加热修复10-15分钟,室温冷却后PBS冲洗,5%BSA封闭1小时,4℃下一抗孵育过夜。复温后PBS冲洗,二抗室温孵育1小时,PBS冲洗,DAB显色,梯度酒精脱水,二甲苯透明。设立PBS溶液代替一抗作为阴性对照组。
2.3 免疫组织化学结果判定
由2位经验丰富的病理医师进行双盲阅片。IL-6、IGF-1阳性反应均为细胞和(或)胞浆深黄色或棕黄色染色,在400倍镜下随机挑取5个视野,采用半定量结果判断,分别对镜下阳性细胞的百分比和染色强度给予评分。(1)阳性着色细胞数:每张切片上观察5个高倍视野(400×),计数阳性细胞百分比,阳性细胞数<5%为0分,5% ~25%为1分,26% ~50%为2分,51% ~75%为3分,76% ~100%为4分。(2)阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。(3)两者计分相乘即为阳性等级:0分为阴性(-),1-4分为弱阳性(+),5-8分为阳性(++),9-12分为强阳性(+++)。
3.统计学方法
应用SPSS19.0软件进行分析,计量资料采用t检验,计数资料组间比较采用χ2检验,相关分析采用Spearman检验。
结 果
1.IL-6、IGF-1在非小细胞肺癌组织的蛋白表达
肺癌组IL-6阳性表达率(84.00%)显著高于癌旁正常组织(77.00%,P<0.01),肺癌组IGF-1阳性表达率(80.00%)显著高于癌旁正常组织(72.00,P<0.01),差异有统计学意义(图1,表1)。
2.IL-6、IGF-1在非小细胞肺癌组织的表达与临床病理特征的关系
(1)吸烟指数≥400的患者肿瘤组织IL-6表达率显著高于吸烟指数<400者,差异有统计学意义,IL-6在腺癌阳性表达率93.24%,显著高于鳞癌阳性表达率77.63%。(2)肿瘤低分化患者肿瘤组织IGF-1表达率显著高于中、高分化水平肿瘤组织,差异有统计学意义。(3)III、IV期患者肿瘤组织IGF-1表达率显著高于I、II期患者,差异有统计学意义。(4)IL-6表达与年龄、性别、组织类型、分化程度、TNM分期均无明显关系(P>0.05)。(5)IGF-1表达与年龄、性别、吸烟指数、组织类型均无明显关系(P >0.05)。
3.IL-6、IGF-1在非小细胞肺癌组织的表达的相关性
非小细胞肺癌组织中,IL-6阳性表达与IGF-1阳性表达之间呈正相关,差异有统计学意义。

表1 IL-6、IGF-1在150例非小细胞肺癌组织和100例癌旁正常组织的表达Table 1 Expression of IL-6 and IGF-1 in 150 NSCLC and 100 para-carcinoma samples.
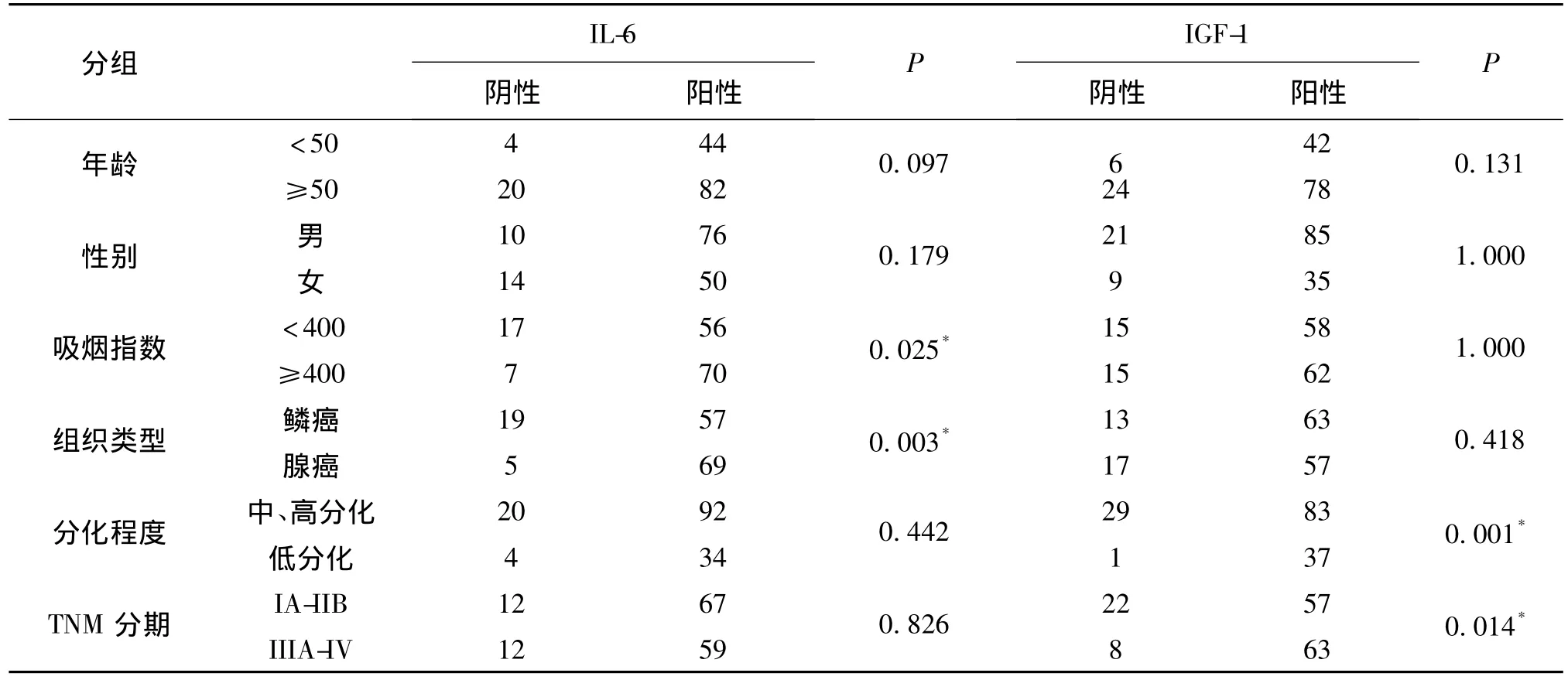
表2 IL-6、IGF-1在150例非小细胞肺癌组织表达与临床病理特征的相关性Table 2 Correlation between the expression of IL-6,IGF-1 and the clinicopathological characteristics of NSCLC

表3 IL-6、IGF-1在150例非小细胞肺癌组织表达相关性Table 3 Correlation between the expression of IL-6,IGF-1 in 150 NSCLC.(Spearman’test)
讨 论
肺癌目前仍是死亡率最高的恶性肿瘤[1],目前肺癌的免疫治疗和针对生长因子通路的靶向治疗是研究的热点,近年来的研究发现IL-6在多种恶性肿瘤组织中高表达,并且与NSCLC的发生、发展以及预后密切相关[7]。IL-6通过JAK激活STAT蛋白家族的磷酸化,其中STAT3是IL-6的信号传递的主要下游通路分子[7]。包括肺癌在内的多种肿瘤细胞均可分泌IL-6从而促进肿瘤的发生与发展[8]。在本研究中我们发现IL-6在包括肺腺癌和肺鳞癌的非小细胞肺癌组织中表达程度均较癌旁正常组织明显增高,吸烟指数≥400的患者肿瘤组织IL-6表达率显著高于吸烟指数<400者,提示吸烟有可能促进肺癌组织IL-6的分泌和表达,这与Chen等关于烟草所致肺癌中IL-6的作用研究结论是相似的[9]。
以表皮样生长因子受体酪氨酸激酶抑制剂为代表针对生长因子通路的靶向治疗也是日前肺癌非手术治疗的研究热点,而IGF-1通路是生长因子通路中一个重要的明星通路[10],已有多项研究提示IGF1通路异常与肺癌发生发展相关[11]。本研究检测了150例非小细胞肺癌组织和100例癌旁正常组织发现,IGF-1在肺癌组织的阳性表达率和表达强度均显著高于良性肺组织。肿瘤低分化患者肿瘤组织IGF-1表达率显著低于中、高分化水平肿瘤组织,III、IV期患者肿瘤组织IGF-1表达率显著低于I、II期患者,说明IGF-1在肿瘤组织局部的高表达提示了肿瘤更低的分化程度和更晚的分期,这提示IGF-1在肺癌组织过表达可能与肿瘤的恶性行为有关。
更重要的是,我们首次发现非小细胞肺癌组织中,IL-6阳性表达与IGF-1阳性表达之间具有明显的正相关,这提示IL-6通路和IGF-1通路之间可能存在重要的交叉作用。IGF-1与受体结合后,能磷酸化激活下游Akt通路,而有文献报道Akt信号的下游分子NF-κB可以直接结合到IL-6的启动子,进而激活IL-6的基因表达[12],这提示IL-6通路与IGF-1通路之间的交叉作用可能通过PI3K/Akt通路的激活实现,而这也是本课题组下一步的研究方向。另有研究发现,IL-6通过激活IGF-1R进而激活IGF-1通路,促进前列腺癌的成瘤与进展,而IL-6下游的STAT3通路是重要的交叉媒介[6]。这些证据结合我们的研究均提示,IL-6和IGF-1通路之间可能存在广泛而复杂的正向调控关系。
综上,我们发现IL-6、IGF-1蛋白在非小细胞肺癌组织中明显高表达,IL-6高表达与更高的吸烟水平相关,IGF-1高表达与更低的肿瘤分化程度和更晚的TNM分期有关,更重要的是,IL-6阳性表达与IGF-1阳性表达正相关,提示IL-6和IGF-1通路可能并非两条独立的促肿瘤通路,两者之间可能存在重要交叉作用。许多研究[5,13]提示单一靶点的肿瘤分子治疗无法提供有效的抑制效果,在非小细胞肺癌中,针对可能相互作用IL-6和IGF-1通路采取双靶点甚至多靶点治疗能为肺癌的非手术治疗提供更有效的抑制策略。
[1]Siegel RL,Miller KD,Jemal A.CA Cancer JClin.2015,65(1):5-29
[2]Lee JJ,Kim HJ,Yang CS,et al.A high - affinity protein binder that blocks the IL-6/STAT3 signaling pathway effectively suppresses non - small cell lung cancer.Mol Ther.2014,22(7):1254-1265
[3]Zarogoulidis P,Yarmus L,Darwiche K,et al.Interleukin-6 cytokine:amultifunctional glycoprotein for cancer.Immunome Res.2013,9(62):16535
[4]游良琨,廖永德,付圣灵,等.胰岛素样生长因子家族在肺癌中的研究.肿瘤,2010(4),356-360
[5]Liu C,Zhang Z,Tang H,et al.Crosstalk between IGF-1R and Other Tumor Promoting Pathways.Curr Pharm Des.2014,20(17):2912-2921
[6]Rojas A,Liu G,Coleman I,et al.IL-6 promotes prostate tumorigenesis and progression through autocrine cross-activation of IGF-IR.Oncogene.2011,30(20):2345-2355
[7]Yao X,Huang J,Zhong H,et al.Targeting interleukin-6 in inflammatory autoimmune diseases and cancers.Pharmacol Ther.2014,141(2):125-139
[8]Sasser AK,Sullivan NJ,Studebaker AW,etal.Interleukin-6 is a potent growth factor for ER-alpha-positive human breast cancer.FASEB J.2007,21(13):3763 -3770
[9]Chen W,Xu X,Bai L,et al.Low-dose gamma-irradia-tion inhibits IL-6 secretion from human lung fibroblasts that promotes bronchial epithelial cell transformation by cigarette- smoke carcinogen.Carcinogenesis.2012,33(7):1368-1374
[10]Baserga R,Peruzzi F,Reiss K.The IGF-1 receptor in cancer biology.Int JCancer.2003,107(6):873 -877
[11]Werner H,Bruchim I.The insulin-like growth factor-I receptor as an oncogene.Arch Physiol Biochem.2009,115(2):58-71
[12]Ahmad A,Biersack B,Li Y,et al.Targeted regulation of PI3K/Akt/mTOR/NF-kappaB signaling by indole compounds and their derivatives:mechanistic details and biological implications for cancer therapy.Anticancer Agents Med Chem.2013,13(7):1002-1013
[13]Fagan DH,Yee D.Crosstalk between IGF1R and estrogen receptor signaling in breast cancer.JMammary Gland Biol Neoplasia.2008,13(4):423-429

