油茶籽粕分离蛋白及其超滤组分的功能特性研究
李 旭 邓俊琳 申世安 刘 露 丁春邦
(四川农业大学生命科学学院,雅安 625014)
油茶籽粕分离蛋白及其超滤组分的功能特性研究
李 旭 邓俊琳 申世安 刘 露 丁春邦
(四川农业大学生命科学学院,雅安 625014)
分析了油茶籽粕分离蛋白(茶籽蛋白)及其超滤组分(≥10 ku和<10 ku)的化学组成与功能特性,探讨了pH和温度对其功能特性的影响。结果表明:茶籽蛋白及其超滤组分≥10 ku和<10 ku的蛋白质量分数分别为85.7%、89.3%和84.2%,还含有少量的多糖、多酚及皂苷;超滤组分<10 ku拥有良好的持油性,但持水性较差,而超滤组分≥10 ku则相反。超滤组分<10 ku拥有良好的蛋白溶解性,泡沫稳定性较差;茶籽蛋白及其超滤组分≥10 ku显示出良好的泡沫稳定性和乳化性;pH和温度对其功能特性的影响因分子量差异而不同,超滤组分<10 ku的温度耐性较强,80℃下依然拥有良好的乳化稳定性,但酸性环境中其乳化稳定性和泡沫稳定性较弱。茶籽蛋白及其超滤组分在60℃表现出最好的蛋白溶解性和乳化性。
油茶籽粕分离蛋白 超滤组分 功能特性 蛋白溶解性
油茶(Camellia oleiferaAbel.)属于山茶科(Theaceae)山茶属(Camellia)植物,与油橄榄、油棕、椰子并称世界四大木本油料作物,是我国特有的木本油料树种。茶籽油富含不饱和脂肪酸,拥有优良的营养品质和药用价值,誉有“东方橄榄油”之称[1]。茶籽油性凉,具有清热、解毒、润燥、明目等功效,此外对心脑血管和神经系统疾病有一定的康复治疗和预防效果[2],已被中国药典收载[3]。为满足国内市场需求,国家林业局推出了“全国油茶产业发展规划(2009~2020)”。随着油茶产业的大力发展,将产生大量的油茶副产物。油茶籽粕作为主要副产物之一,目前主要用作燃料、有机肥或动物饲料,甚至被当作垃圾丢弃,不仅没有带来经济价值,反而给环境增加了一定的压力。因而,充分开发和利用油茶籽粕具有一定的实际意义。
油茶籽粕中含有丰富的蛋白质、多糖、皂苷等。油茶籽蛋白含有丰富的氨基酸且种类全面,可作为食品添加剂[4]。目前,种子储存蛋白如大豆蛋白、花生蛋白和菜籽蛋白等具有良好的营养价值与功能特性,已被广泛用于食品工业。随着人们对植物蛋白需求量的增加,一些新的植物蛋白源也被开发利用,如麦芽蛋白[5]、棉籽蛋白[6]、荞麦蛋白[7]等。功能特性是蛋白在食品工业中所需的一些理化性能,如溶解性、乳化性、泡沫性等。蛋白功能特性与其构象、分子质量、分子表面疏水性及电荷分布密切相关[8]。提取的天然蛋白虽具有一定的生物活性和功能特性,但成分复杂,分子质量分布范围广,往往不能得到理想的功能特性。膜分离技术具有无相变、操作简单、分离系数大等优点。应用膜分离纯化蛋白或多肽,可以提高蛋白或多肽的生物活性[9]。
本研究以油茶籽粕为原料提取茶籽粕分离蛋白(茶籽蛋白),应用超滤膜截留不同分子量的茶籽蛋白,分析其基本化学组成,并探讨pH和温度对茶籽蛋白及其超滤组分功能特性的影响,为开发利用茶籽蛋白提供参考。
1 材料与方法
1.1 材料和试剂
油茶籽粕:雅安太时生物科技有限公司,原料经干燥、粉碎,过60目筛,备用。
超滤管(10 ku):美国Millipore公司;小牛血清蛋白、重蒸酚:北京Solarbio公司;茶皂苷、没食子酸、葡萄糖:上海Aladdin公司。
1.2 仪器设备
紫外分光光度计UV-1750、荧光分光光度计RF-5301PC:日本岛津公司;FSH-2型可调高速匀浆机:江苏省金坛市环宇科学仪器厂;离心机:美国Thermo Fisher公司。
1.3 茶籽蛋白及其超滤组分的制备
油茶籽粕粉末经正己烷浸提24 h以除去残余油脂(脱脂油茶籽粕),再经75%乙醇浸提5次,每次1 h,以除去皂苷、多酚等物质,干燥备用。称取100 g处理过的粉末,按料液比1∶20加入碱液,使其保持在pH 10下于40℃水浴提取3 h,于转速5 000 g离心15 min。上清液用1 mol/L HCl调至pH 4~4.5,于转速8 000 g离心20 min,得沉淀,用75%乙醇洗涤5次,离心,真空干燥,即茶籽蛋白。将茶籽蛋白溶解在双蒸水中(1 mg/mL),置于超滤管中于转速4 000 g离心50 min,截留分子质量10 ku的蛋白,将茶籽蛋白分成分子质量<10 ku和≥10 ku 2部分,然后冷冻干燥,备用。
1.4 基本化学成分的测定
蛋白含量测定采用Lowery法[10],以小牛血清蛋白为标准品。多糖含量测定采用苯酚-硫酸法[11],以葡萄糖为标准品。多酚含量测定采用Folin-Ciocalteu法[12],以没食子酸为标准品。皂苷含量测定采用乙酸-香草醛法[13],以茶皂苷为标准品。灰分和脂肪酸含量的测定分别采用国家标准GB/T 5009.4—2010和GB/T 14772—2008。含水量的测定通过将样品烘至恒重,测量烘干前后样品的质量之差与烘干前的质量百分比来表示。
1.5 内源荧光扫描
蛋白内源荧光扫描采用Zhang等[14]的方法,略有改变。蛋白溶液(500μg/mL)用 10 mmol/L磷酸缓冲液(pH 7.0)配制。采用激发光波长290 nm,发射光波长范围300~550 nm,进行荧光扫描。
1.6 蛋白功能特性的测定
1.6.1 持水性与持油性
茶籽蛋白及其超滤组分的持水性和持油性测定采用曾志红等[15]的方法,稍有修改。0.5 g样品加入10 mL双蒸水或大豆油,于室温震荡20 min,然后于转速3 000 g离心10 min,测定沉淀的质量或上清液体积。持水性为蛋白吸水前后质量差与蛋白吸水前质量的比值;持油性为蛋白吸油体积与蛋白质量的比值。
1.6.2 溶解性
茶籽蛋白及其超滤组分在不同pH和温度(50 mmol/L磷酸缓冲液,pH 7)下的溶解度测定采用Castellani等[16]的方法,稍有修改。100 mg样品溶于8 mL双蒸水,然后用1 mol/L NaOH或HCl调至相应的pH(3~11)或通过水浴锅调至相应的温度(20~100℃),定容到10 mL,然后于相应环境中震荡30 min,于转速8 000 g离心10 min,取上清,蛋白含量测定用 Lowery法[10]。
1.6.3 起泡性与泡沫稳定性
茶籽蛋白及其超滤组分在不同pH和温度(50 mmol/L磷酸缓冲液,pH 7)下起泡性和泡沫稳定性的测定采用 Shahidi等[17]的方法,略有修改。200 mg样品溶于10 mL双蒸水,用1 mol/L NaOH或HCl调至相应的pH值(3~11)或通过水浴锅调至相应的温度(20~100℃),定容至20 mL,然后于相应环境中震荡30 min,于转速5 000 r/min下搅拌2 min。分别在10 s和30 min后,测定总体积。
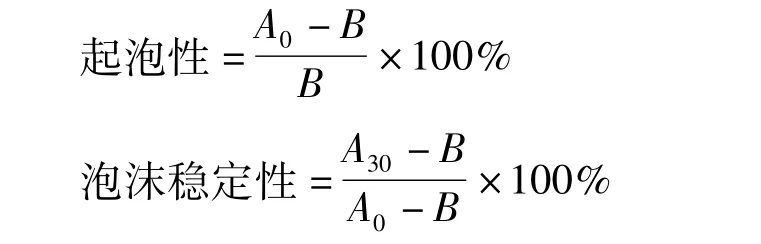
式中:A0、A30分别为搅拌后静置10 s和30 min时的总体积;B为搅拌前的体积。
1.6.4 乳化性与乳化稳定性
茶籽蛋白及其超滤组分在不同pH和温度(50 mmol/L磷酸缓冲液,pH 7)下的乳化性和乳化稳定性测定采用 Pearce等[18]的方法,略有修改。200 mg样品溶于17 mL双蒸水,用1 mol/L NaOH或HCl调至相应的pH值(3~11)或通过水浴锅调至相应的温度(20~100℃),定容至20 mL,然后于相应环境中震荡30 min。取6 mL蛋白溶液,加入2 mL大豆油,于转速5 000 r/min下搅拌2 min。分别在静止10 s和10 min后,取下层乳状液,用0.1%SDS溶液稀释100倍,充分混匀,于500 nm下测定OD值。
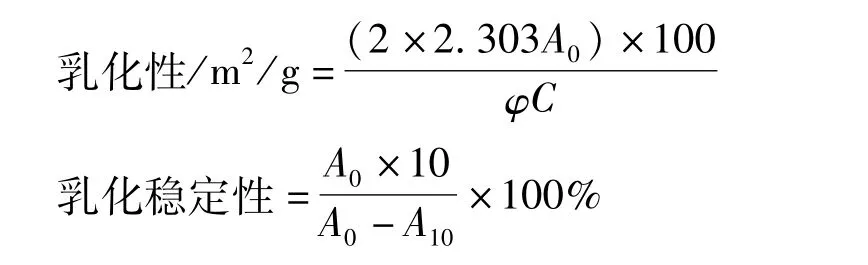
式中:A0为10 s时的OD值;A10为10 min时的OD值;C为蛋白浓度;φ为油的体积分数。
1.7 统计与分析
所有试验均3次重复,用Excel和origin pro 8.0进行统计分析。
2 结果与分析
2.1 基本化学组成
脱脂油茶籽粕,茶籽蛋白及其超滤组分的基本化学组成如表1所示。脱脂油茶籽粕中的主要化学成分是多糖,其次是蛋白与皂苷。提取得到的茶籽蛋白的蛋白质量分数达85.7%,含少量的多糖、皂苷和多酚,表明在蛋白提取过程中能有效去除多糖、皂苷和多酚等杂质。分子质量≥10 ku占茶籽蛋白的81.4%,而分子质量<10 ku占17.3%,表明茶籽蛋白主要由大分子量的蛋白质组成。
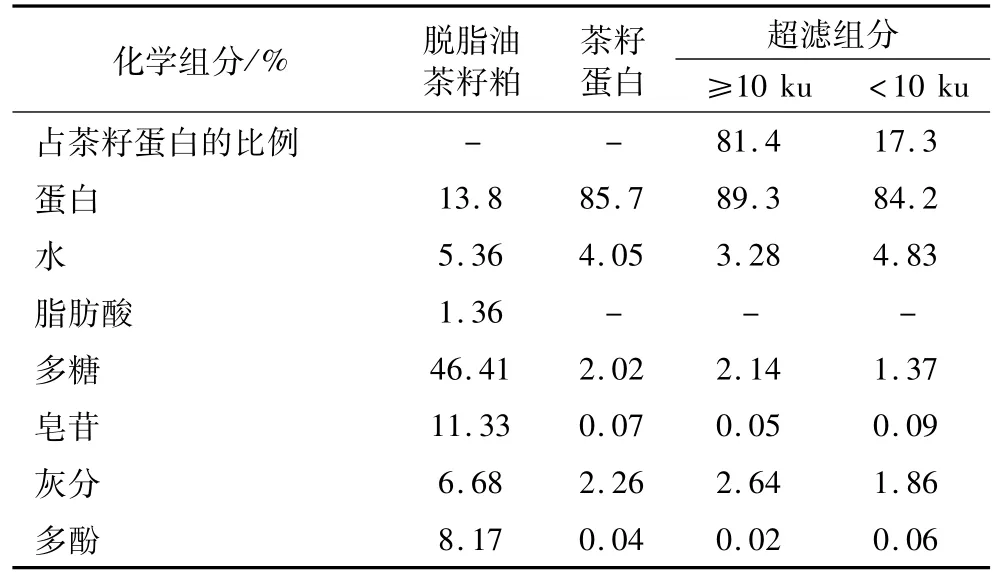
表1 基本化学组成
2.2 内源荧光扫描
蛋白内源荧光依赖于蛋白色氨酸/酪氨酸的极性环境或色氨酸/酪氨酸的特殊相互作用[19]。色氨酸在280 nm左右被激发,于发射波长340 nm左右有最大荧光强度[19]。当蛋白展开时,蛋白内部的生色基团暴露出来,增加蛋白的荧光强度[20]。茶籽蛋白及其超滤组分的内源荧光扫描如图1所示。茶籽蛋白与其超滤组分≥10 ku的最大荧光强度均在353 nm处。超滤组分<10 ku在300~400 nm范围内没有内部荧光强度,在429 nm后有弱的荧光强度。引起这种现象的原因可能是小分子量的茶籽蛋白生色基团较少。

图1 蛋白内源荧光扫描
2.3 紫外光谱
茶籽蛋白及其超滤组分的紫外光谱如图2所示。茶籽蛋白及其超滤组分≥10 ku在紫外波长280 nm处有最大吸收峰,表明含有芳香族氨基酸,这与其在353 nm处有最大荧光强度的分析结果一致。超滤组分<10 ku对紫外光虽有吸收,但在紫外区270~290 nm无最大吸收峰,并且在300~400 nm内无荧光强度,这可能是小分子量茶籽蛋白的色氨酸/酪氨酸含量较低引起的。
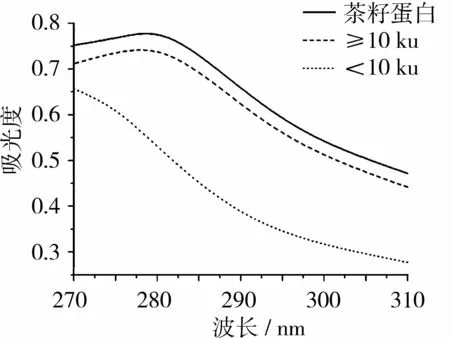
图2 蛋白紫外光谱扫描
2.4 持水性与持油性
茶籽蛋白及其超滤组分的持水性与持油性如图3所示。超滤组分<10 ku拥有最低的持水性和最高的持油性,而超滤组分≥10 ku则相反,拥有最高持水性和最低的持油性。蛋白持水性和持油性的不同可能与蛋白分子的构象特征、表面疏水性、亲脂基团不同有关[21]。持油性是蛋白重要的品质之一,影响着蛋白乳化性。茶籽蛋白的持油性(2.73 mL/g)较大豆分离蛋白[22]的持油性(3.29 mL/g)低。
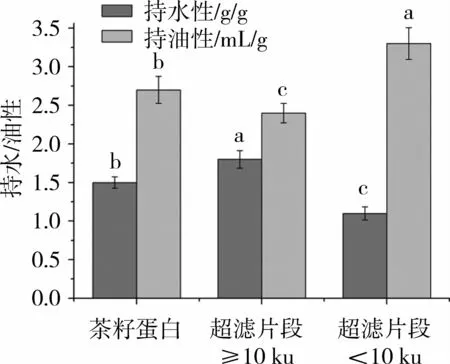
图3 蛋白持水性与持油性
2.5 pH和温度对蛋白溶解性的影响
pH对茶籽蛋白及其超滤组分溶解性的影响如图4a所示。茶籽蛋白及其超滤组分的溶解度随着pH增加呈先降后升的趋势,达到最大值后,随pH继续增加,溶解度趋于平缓。茶籽蛋白及其超滤组分≥10 ku在pH 4.5左右有最小的溶解度,约为20%;超滤组分<10 ku的蛋白在pH 4.0处有最小溶解度(56.5%)。在酸性与中性条件下,超滤组分<10 ku的溶解性比茶籽蛋白和超滤组分≥10 ku的溶解性强,特别是在pH 4.5处,其溶解度约为茶籽蛋白及其超滤组分≥10 ku的3倍;在pH≥9的碱性环境中,茶籽蛋白及其超滤组分的溶解性基本一致,均在95%左右。中性条件下,茶籽蛋白溶解度较其超滤组分低,表明经超滤膜分离的茶籽蛋白拥有更高的蛋白溶解性。
温度对茶籽蛋白及其超滤组分溶解度的影响如图4b所示。茶籽蛋白及其超滤组分的溶解性随温度的增加而缓慢增加,在60℃附近有最大溶解度,而后则随温度增加而迅速降低。此外,茶籽蛋白超滤组分在20~100℃内的溶解性较茶籽蛋白的溶解性好。
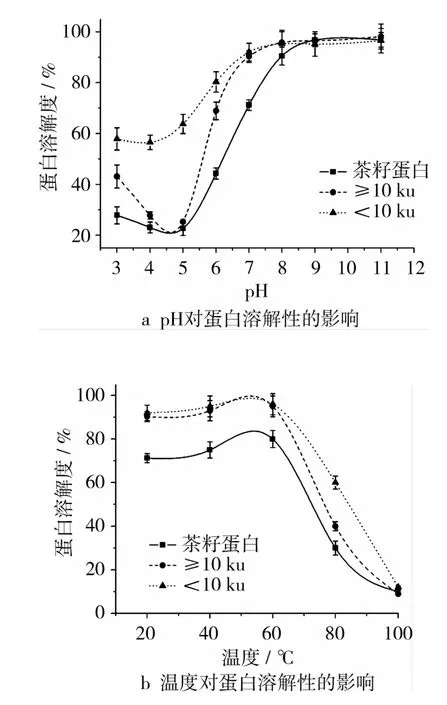
图4 pH和温度对蛋白溶解度的影响
2.6 pH和温度对蛋白起泡性与泡沫稳定性的影响
pH对茶籽蛋白及其超滤组分起泡性的影响如图5a所示。茶籽蛋白及其超滤组分的起泡性随pH值的变化趋势与其溶解度变化趋势相似:先降后升,在pH 9时达最大值;随着pH值继续增加,蛋白静电排斥力增强,导致了起泡性的下降。茶籽蛋白及其超滤组分≥10 ku在pH 5处有最低的起泡性,而超滤组分<10 ku在pH 3处有最低的起泡性。许多蛋白在其等电点附近容易凝结而导致其起泡性下降[23]。在远离等电点的环境中,蛋白拥有更好的溶解性和表面活性,从而表现出良好的起泡性能[21]。
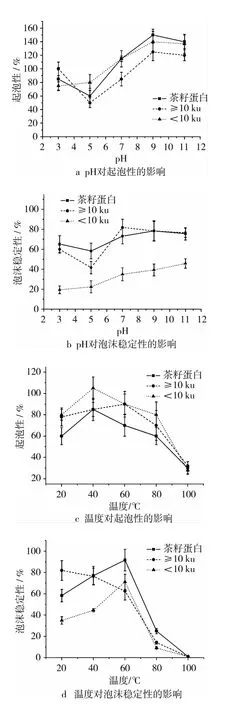
图5 pH和温度对蛋白起泡性和泡沫稳定性的影响
pH对茶籽蛋白及其超滤组分泡沫稳定性的影响如图5b所示。茶籽蛋白及其超滤组分≥10 ku的泡沫稳定性呈现与其起泡性相似的变化趋势,但最高泡沫稳定性分别在pH 9和pH 7处。超滤组分<10 ku的泡沫稳定性随pH值的增加而增加。在pH 3~11范围内,小分子质量<10 ku茶籽蛋白泡沫稳定性较大分子质量≥10 ku低。
温度对茶籽蛋白及其超滤组分起泡性的影响如图5c所示。茶籽蛋白及其超滤组分的起泡性随温度的上升呈先升后降的趋势;茶籽蛋白及其超滤组分<10 ku在40℃拥有最高的起泡性,超滤组分≥10 ku则在60℃拥有最高的起泡性。在20~100℃范围内,茶籽蛋白的起泡性比其超滤组分低。
温度对茶籽蛋白及其超滤组分泡沫稳定性的影响如图5d所示。茶籽蛋白及其超滤组分<10 ku的泡沫稳定性随温度的上升呈先升后降趋势,在60℃拥有最高的泡沫稳定性;超滤组分≥10 ku的泡沫稳定性则随温度增加呈下降趋势,在常温(20℃)下拥有最好泡沫稳定性(81%)。在40~100℃时,茶籽蛋白的泡沫稳定性比其超滤组分高。
2.7 pH和温度对蛋白乳化性与乳化稳定性的影响
pH对茶籽蛋白及其超滤组分乳化性的影响如图6a所示。随着pH值的增加,茶籽蛋白及其超滤组分的乳化性先缓慢下降,随后迅速上升,在pH 9处达到最大,而后略有下降。在pH 3~9的环境中,茶籽蛋白及其超滤组分的乳化性没有显著差异,且随pH的变化趋势与其溶解性的变化趋势相似,表明蛋白乳化性与其溶解性密切相关。
如图6b所示,茶籽蛋白的乳化稳定性随pH值的增加呈先降后升趋势,在pH 5处乳化稳定性最低(11%);超滤组分的乳化稳定性则随pH值增加而增加,在酸性阶段增加迅速,随后在碱性阶段则缓慢增加。在pH≥5的环境中,茶籽蛋白的乳化稳定性都比其超滤组分低。
温度对茶籽蛋白及其超滤组分乳化性的影响如图6c、图6d所示。随着温度增加,茶籽蛋白及其超滤组分的乳化性和乳化稳定性呈先升后降的趋势。在60℃时,茶籽蛋白及其超滤组分的乳化性最好,高于60℃时,乳化性快速下降,100℃时,乳化性基本一致。茶籽蛋白及其超滤组分≥10 ku在40℃有最高的乳化稳定性(分别68%和96%);超滤组分<10 ku在60℃时拥有最高的乳化稳定性(118%),在80℃依然拥有良好的乳化稳定性(82%)。在20~100℃范围内,茶籽蛋白的乳化稳定性比其超滤组分低。
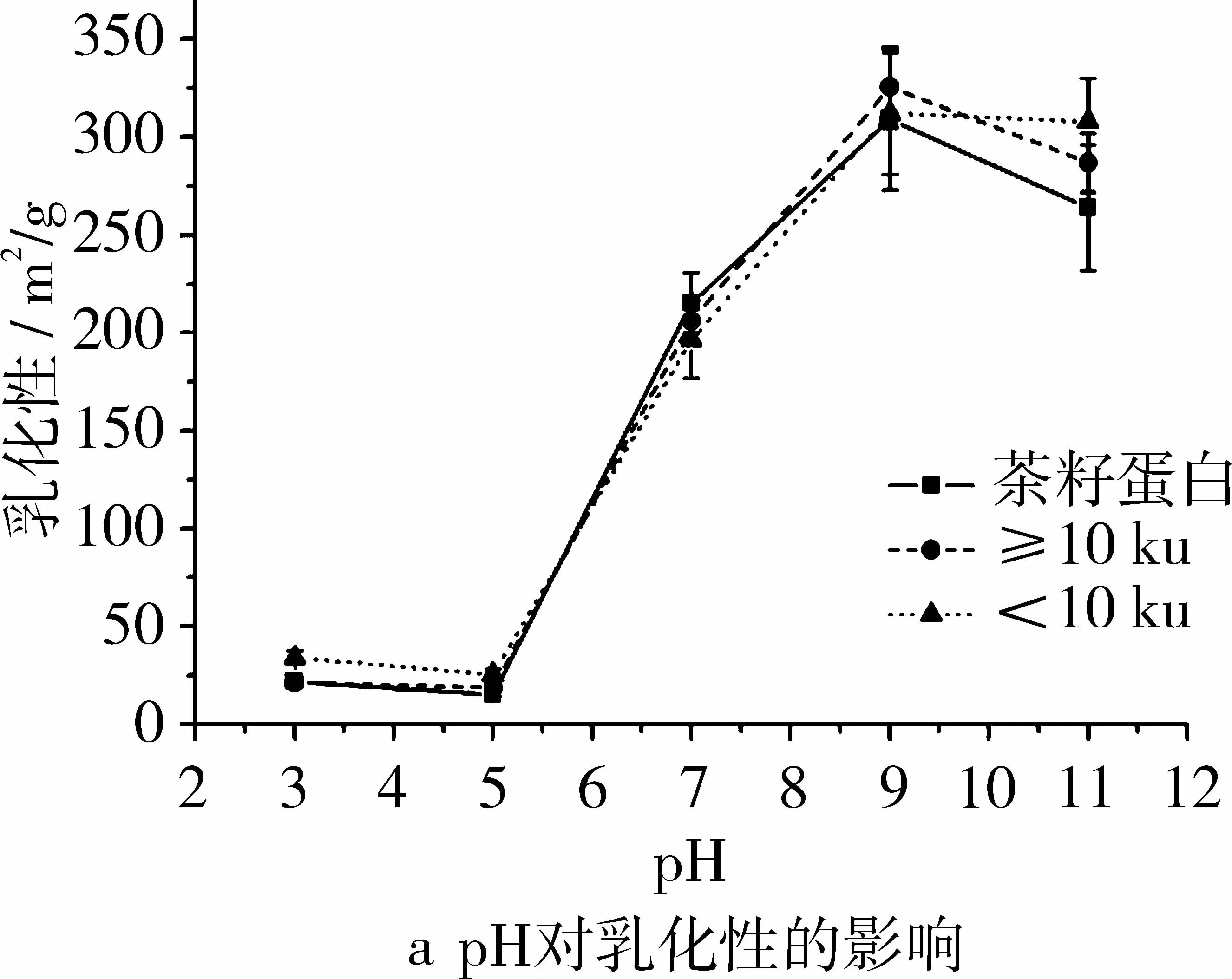

图6 pH和温度对蛋白乳化性和乳化稳定性的影响
3 结论
小分子质量茶籽蛋白(<10 ku)的内源荧光强度和紫外吸收均较茶籽蛋白及其超滤组分(≥10 ku)弱,但这并不影响其拥有良好的溶解性、持油性和乳化性;大分子质量茶籽蛋白(≥10 ku)拥有良好的持水性和泡沫稳定性。茶籽蛋白及其超滤组分在pH 9处拥有最好的起泡性和乳化性,此时其溶解度高达95%。pH和温度对茶籽蛋白功能特性的影响因分子量的不同而不同,小分子量茶籽蛋白的乳化稳定性对温度变化较大分子量茶籽蛋白的敏感度低,在60℃和80℃依然拥有良好的乳化稳定性(分别为118%和82%);在酸性环境中,小分子量茶籽蛋白的起泡稳定性和乳化稳定性则不如大分子量蛋白。
[1]罗晓岚,朱文鑫.油茶籽油加工和油茶资源综合利用[J].中国油脂,2010,35(9):13-17
[2]沈建福,姜天甲.山茶油的营养价值与保健功能[J].粮食与食品工业,2006,13(6):6-8,21
[3]国家药典委员会.中华人民共和国药典[M].北京,中国医药科技出版社,2010,386-387
[4]丁丹华,彭光华,何东平.HPLC法测定油茶籽多肽相对分子质量分布及氨基酸组成[J].中国油脂,2010,35(11):68-71
[5]肖连冬.酶法改性麦芽蛋白功能特性的研究[J].中国食品学报,2009,9(5):151-156
[6]崔志芹,王志祥,史美仁.棉籽蛋白功能特性的研究[J].中国油脂,2009,31(9):24-26
[7]米宏伟,唐传核,杨晓泉.加工工艺对荞麦蛋白功能特性的影响[J].食品与发酵工业,2006,32(2):128-131
[8]Deng Q,Wang L,Wei F,et al.Functional properties of protein isolates,globulin and albumin extracted fromGinkgo bilobaseeds[J].Food Chemistry,2011,124(4):1458-1465
[9]Rong H,Abraham TG,Sunday A,et al.Antioxidant activities of enzymatic rapeseed protein hydrolysates and themembrane ultrafiltration fractions[J].Journal of Functional Foods,2013,5(1):219-227
[10]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurementwith the Folin phenol reagent[J].The Joural of Biological Chemistry,1951,193(1):265-275
[11]Dubois M,Gilles K A,Hamilton JK,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356
[12]张艳军,杨途熙,魏安智,等.花椒果皮中总黄酮与多酚的积累及其抗氧化活性研究[J].西北植物学报,2013,33(3):620-625
[13]曾超珍,刘志祥,李军龙.大孔树脂纯化枸骨叶总皂苷及其油脂抗氧化活性研究[J].中国粮油学报,2011,26(8):45-49
[14]Zhang Q T,Tu Z C,Xiao H,et al.Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J].Food and Bioproducts Processing,2014,92(1):30-37
[15]曾志红,王强,林伟静,等.绿豆蛋白营养及功能特性分析[J].中国粮油学报,2012,27(6):51-55
[16]Castellani O,Martinet V,David-Briand E,et al.Egg yolk phosvitin:preparation of metal-free purified protein by fast protein liquid chromatography using aqueous solvents[J].Journal of Chromatography B,2003,791(1):273-284
[17]Shahidi F,Han X Q,Synowiecki J.Production and characteristics of protein hydrolysates from capelin(Mallotus villosus)[J].Food Chemistry,1995,53(3):285-293
[18]Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723
[19]Lakowicz JR.Principles of fluorescence spectroscopy[M].Springer,2007,15-17
[20]Pallarès I,Vendrell J,Avilés F X,et al.Amyloid fibril formation by a partially structured intermediate state ofαchymotrypsin[J].Journal ofMolecular Biology,2004,342(1):321-331
[21]Deng Q,Wang L,Wei F,et al.Functional properties of protein isolates,globulin and albumin extracted fromGinkgo bilobaseeds[J].Food Chemistry,2011,124(4):1458-1465
[22]Sánchez-Vioque R,Clemente A,Vioque J,et al.Protein isolates from chickpea(Cicer arietinumL.):chemical composition,functional properties and protein characterization[J].Food Chemistry,1999,64(2):237-243
[23]Mwasaru M A,Muhammad K,Bakar J,et al.Influence of altered solvent environment on the functionality of pigeonpea(Cajanus cajan)and cowpea(Vigna unguiculata)protein isolates[J].Food Chemistry,2000,71(2):157-165.
Functional Properties of Camellia Oleifera Seed Cake Separated Protein and Its Ultrafiltration Fractions
Li Xu Deng Junlin Shen Shian Liu Lu Ding Chunbang
(College of Life Science,Sichuan Agricultural University,Yaan 625014)
The chemical composition and functional properties ofCamelliaseed cake's separated protein and its ultrafiltration factions(≥10 ku and<10 ku)have been investigated in the paper.The influence of temperature and pH onCamelliaseed cake's separated protein's functional properties has also been evaluated.The protein content of Camellia seed cake's separated protein and its fractions(≥10 ku and<10 ku)were 85.7%,89.3%and 84.2%respectively in the samples which containing a handful of sugar,polyphenol and saponin.Fraction<10 ku had an excellent oil-holding capacity but lesswater-holding capacity;while fraction≥10 ku had an opposite behavior.In addition,fraction<10 ku expressed a prominent protein solubility,while a poor foaming stability.Fraction≥10 ku andCamelliaseed separated protein exhibited an excellent emulsifying capability and foaming stability.The effects of pH and temperature on functional property were different according to the altered protein molecular weight.Fraction<10 ku had a strong tolerance to temperature,further it could maintain good emulsifying stability and protein solubility at80℃.But its emulsifying and foaming stability were poor in acidic environment.Camelliaseed cake separated protein and its ultrafiltration fractions had the best protein solubility and emulsifying capability at 60℃.
Camelliaseed cake separated protein,ultrafiltration fraction,functional property,protein solubility
TQ936.2
A
1003-0174(2015)10-0037-07
四川省科技厅科技支撑计划(2013NZ0047)
2014-05-28
李旭,男,1986年出生,硕士,植物天然产物应用
丁春邦,女,1966年出生,教授,植物资源开发与利用

