牛DKK2基因pcDNA3.1表达载体的构建
陶虎 熊琪 李晓峰 索效军 张年 杨前平 刘洋 陈明新

摘要:DKK2基因是Wnt信号通路的关键抑制因子,在胚胎发育、颗粒细胞生成等过程中发挥重要作用。扩增了牛DKK2基因CDS序列,构建了DKK2基因pcDNA3.1真核表达载体;为进一步验证载体在细胞内的表达效果,将表达质粒瞬时转染CHO细胞,利用qRT-PCR和Western blot检测DKK2的表達情况。结果表明,在CHO细胞中转染DKK2基因的真核表达载体质粒,其mRNA和蛋白质表达量均显著上升,表明已成功构建了DKK2基因表达载体,为下一步开展DKK2基因功能研究奠定了基础。
关键词:牛;DKK2基因;pcDNA3.1表达载体;细胞转染;基因超表达
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2015)22-5751-03
Abstract:DKK2 gene is the key inhibitory factor of the Wnt signaling pathways, and plays an important role in the process of embryonic development, granular cell generation and so on. This study amplified the CDS sequence of cow DKK2 gene and built its pcDNA3.1 eukaryotic,then verified the correctness by enzyme digestion and sequencing. In order to further verified the expressing effect of this expression vector in cells, the vector was transfected into CHO cells transiently, then DKK2 expression was detected by using qRT-PCR and Western blot. The results showed that the mRNA and protein expressions of DKK2 gene were significantly increased in CHO cells, and indicated the pcDNA3.1 of DKK2 gene had been successfully constructed. This laid the foundation of the next step of DKK2 gene function research.
Key words: cow; DKK2 gene; pcDNA3.1 expression vector; infected cells; gene overexpression
哺乳动物卵泡的发育过程非常复杂,并且与家畜的繁殖性能紧密关联。利用超声扫描等手段,对家畜卵泡的发育模式进行了较为深入的研究,但对卵泡发育的调控机理仍需进一步的研究。对调控规律的研究有助于分析家畜繁殖性能的分子机制,对于生产具有重要的指导意义。
DKK蛋白家族包含DKK1、DKK2、DKK3和DKK4,均为分泌性糖蛋白[1]。DKK蛋白通过结合LRP5/6,抑制Wnt信号通路来发挥调控作用[2,3]。DKK2基因与胚胎着床及子宫内膜蜕膜化过程密切相关[4,5]。DKK2基因敲除的小鼠能正常生育,但个体小于同窝的其他小鼠[6,7]。此外,DKK2基因可调控上皮细胞和间质细胞的转化,可作为蜕膜的标记物[8]。由此可见,DKK2基因在雌性哺乳动物繁殖过程中发挥重要调控作用,但尚未见到该基因调控卵泡发育分子机制的相关报道。本研究采用基因工程技术,构建了牛DKK2基因pcDNA3.1表达载体,为开展DKK2基因功能研究奠定基础。
1 材料与方法
1.1 试验材料
样本取自牛肌肉组织;大肠杆菌(Escherichia coli)DH5α和pcDNA3.1表达载体由湖北省农业科学院畜牧兽医研究所保存;质粒pMD18-T Vector购自宝生物工程(大连)有限公司;限制性内切酶Nhe Ⅰ和Hind Ⅲ、T4 DNA连接酶及高保真DNA聚合酶购自NEB公司;DKK2抗体购自Abcam公司;凝胶回收试剂盒和质粒提取试剂盒均购自Omega公司。
1.2 试验方法
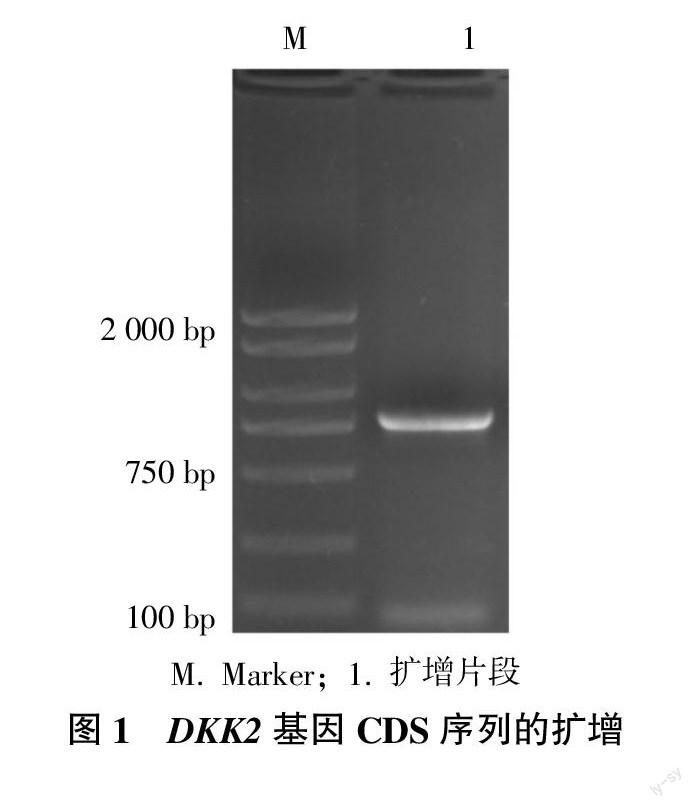
1.2.1 DKK2基因CDS序列的扩增 根据GenBank中DKK2基因cDNA已知序列,设计合成引物,并在引物5端和3端分别引入了NheⅠ和Hind Ⅲ的酶切位点。正向引物为5-CTAGCTAGCGCCACCATGGCCGTGTTGATGCGG-3,反向引物为5-CCCAAGCTTTCATATTTTCTGGCATACATGGA-3,以DKK2基因cDNA为模板。引物由生工生物工程(上海)股份有限公司合成,预期扩增片断大小为780 bp。PCR扩增反应程序:94 ℃预变性4 min; 94 ℃变性30 s + 62 ℃变性30 s + 72 ℃变性1 min,35个循环;72 ℃延伸7 min;4 ℃保存。所用酶为Taq Plus DNA Polymerase。PCR仪为Mini CyclerTM基因扩增仪。对PCR产物进行琼脂糖凝胶电泳,利用DNA快速纯化回收试剂盒回收目的片段,具体操作按产品说明书进行。
1.2.2 克隆载体的构建 所用载体为pMD18-T Vector,可进行酶切鉴定和测序。连接反应体系为:8 μL纯化后的PCR产物、1 μL 10×Ligation Buffer、 1 μL pMD18-T Vector,于16 ℃金属浴条件下连接4 h。取10 μL连接产物,加入50 mL DH5α感受态细胞,轻轻吸打混匀,冰浴5 min,42 ℃热击45 s。将混合体系用无菌涂布棒均匀涂布于含Amp(氨苄)的LB固体培养基上,将培养皿倒置于37 ℃培养箱中过夜。
1.2.3 表达载体的构建与鉴定 在培养皿上随机挑取10个单菌落,分别接种于1.5 mL LB液体培养基中,于37 ℃,200 r/min条件下振荡培养4 h。挑选阳性克隆提取质粒,和pcDNA3.1质粒一并进行NheⅠ和Hind Ⅲ双酶切。利用凝胶回收试剂盒回收酶切产物,16 ℃条件下连接4 h后转化至DH5α感受态细胞中,利用含有Amp的LB培养基筛选阳性克隆。以菌液为模板,利用通用引物经PCR扩增检测目的片段大小,将阳性菌液送至北京奥科生物科技公司测序,测序正确的克隆提取质粒备用。
1.2.4 细胞培养及DKK2表达质粒转染 CHO(中国仓鼠卵巢细胞系)细胞系由湖北省农业科学院畜牧兽医研究所保存,细胞培养基为DMEM-F12中加入10%的胎牛血清,培养箱条件为5% CO2、37 ℃。待细胞培养至80%的融合度,使用胰酶消化后均匀接种于6孔板中。每孔加入100 μL的lipofectmin 2 000和DKK2表达质粒的复合物于细胞培养箱中培养,24 h后提取RNA,48 h提取总蛋白,均-80 ℃保存备用。
1.2.5 DKK2基因表达分析 将RNA反转录为cDNA,并设计定量引物DL-PF:5ATCTGCGGGCACATACCA3,DL-PR:5CTCCCAACTTCACATTCCT TA3;采用qRT-PCR检测超表达DKK2基因的CHO细胞中该基因表达量。将总蛋白质进行SDS-PAGE凝胶电泳,电泳完毕后将蛋白质转印至硝酸纤维膜上50 g/L脱脂奶粉封闭2 h,DKK2抗体4 ℃孵育过夜,与辣根过氧化物酶标记的二抗室温孵育1 h,洗膜后经ECL试剂盒曝光显影。
2 结果与分析
2.1 牛DKK2基因编码区扩增
取牛肌肉组织提取总RNA后,反转录成cDNA作为模板,通过PCR扩增DKK2基因的CDS序列。经凝胶电泳结果显示,片段长度与预期结果相符(DKK2的CDS长度为780 bp),并未出现非特异性条带(图1)。
2.2 DKK2基因表达载体的构建
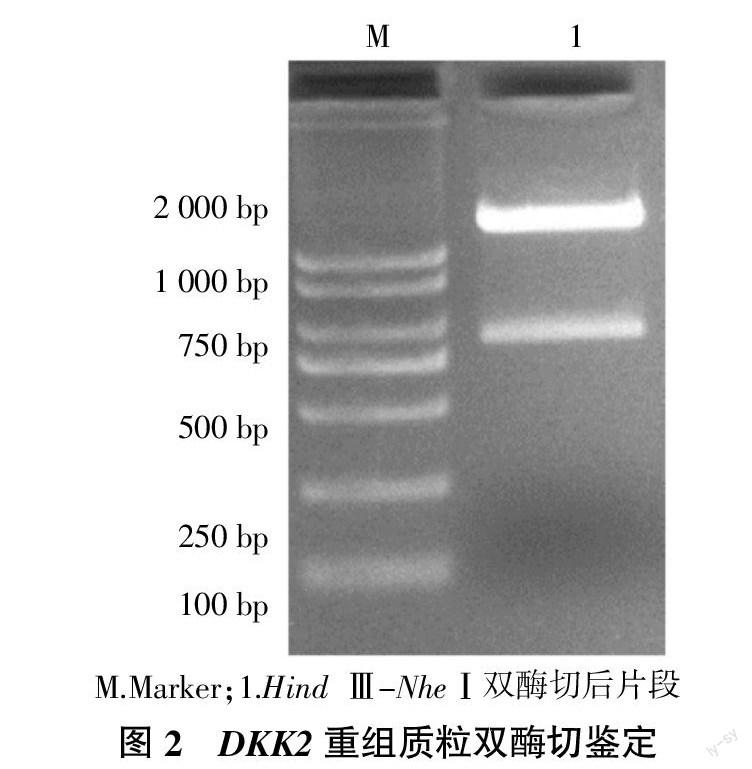
DKK2基因CDS序列的PCR产物和pcDNA3.1载体经NheⅠ和Hind Ⅲ双酶切后,切胶回收。利用T4连接酶,连接载体和CDS序列的双酶切产物,并克隆转化入DH5α,培养过夜后挑选阳性克隆进行鉴定。
2.2.1 双酶切鉴定 阳性克隆质粒采用NheⅠ和Hind Ⅲ进行双酶切,酶切后分别释放出相应大小的特异性条带(图2),结果与预期相符。
2.2.2 测序鉴定 将阳性菌液送公司测序,所得结果通过序列比对软件BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgiCMD=Web&PAGE_TYPE=BlastHome)
进行比对分析,结果表明,目的片段与NCBI数据库中提交的片段序列完全一致(图3)。
2.3 qRT-PCR和Western blot检测重组质粒表达
将表达载体pc-DKK2瞬时转染CHO细胞,转染后24 h提取RNA,48 h后提取总蛋白质,分别利用qRT-PCR和Western blot检测重组质粒表达情况。结果表明,过表达DKK2基因后,CHO细胞中DKK2基因的mRNA表达量升高了17 782倍,效果极显著(P<0.001),在蛋白质水平较之于pcDNA3.1空载体组显著升高(P<0.05),说明表达载体构建成功,可用于后续试验。
3 小结与讨论
本研究通过扩增牛DKK2基因的CDS全长序列,通过双酶切并回收目的序列,利用基因工程技术构建了DKK2基因的pcDNA3.1表达载体;然后利用双酶切凝胶电泳和测序技术验证扩增序列的正确性;最终在CHO细胞中进行了质粒的表达验证,所得到的质粒可用于后续DKK2基因功能的试验研究。
综合前人研究,卵泡颗粒细胞可分泌性腺激素,具有支持卵泡的作用,能够维持卵巢正常功能[9,10]。围绕卵丘的颗粒细胞构建了细胞调控网络,与卵泡进行物质和信号交换,其中雌激素的分泌最为重要[11]。由此可见,颗粒细胞在卵泡发育过程中发挥着重要作用。Wnt信号通路极为保守,在哺乳动物生长发育、疾病、衰老等過程中发挥重要作用[12,13]。Wnt信号通路在颗粒细胞增殖分化和母性生殖过程中发挥重要的调控作用[14]。Li等[15]研究表明,Wnt信号通路对卵泡发育起负调控作用,其通过对转录因子Foxo3的激活影响颗粒细胞凋亡和卵泡类固醇的合成。
DKK2作为Wnt信号通路重要的抑制因子,在哺乳动物繁殖过程中发挥重要调控作用,但尚未见到DKK2基因调控牛颗粒细胞增殖分化的相关报道。DKK2基因在物种中保守性很高,在人、小鼠、牛、山羊和猪中CDS序列相似度高。本研究通过成功构建牛DKK2基因的pcDNA3.1表达载体,可为研究DKK2调控牛颗粒细胞发育的具体机制奠定基础。
参考文献:
[1] NIEHRS C. Function and biological roles of the Dickkopf family of Wnt modulators[J]. Oncogene, 2006, 25: 7469-7481
[2] BROTT B K, SOKOL S Y. Regulation of Wnt/LRP signaling by distinct domains of Dickkopf proteins[J]. Mol Cell Biol, 2002,22:6100-6110.
[3] DING Y, SHEN S Q, LINO A C, et al. Beta-catenin stabilization extends regulatory T cell survival and induces anergy in nonregulatory T cells[J]. Nature Medicine,2008,14:162-169.
[4] ZHANG Y, PENG S, KUANG H, et al. Expression and regulation of Dickkopf-2 during periimplantation in mice[J]. J Reprod Dev,2009,55:17-22.
[5] CHEN L, WANG K, SHAO Y, et al. Structural insight into the mechanisms of Wnt signaling antagonism by Dkk[J]. J Biol Chem, 2008, 283: 23364-23370.
[6] LI X, LIU P, LIU W, et al. Dkk2 has a role in terminal osteoblast differentiation and mineralized matrix formation[J]. Nat Genet, 2005, 37: 945-952.
[7] MUKHOPADHYAY M, GORIVODSKY M, SHTROM S, et al. Dkk2 plays an essential role in the corneal fate of the ocular surface epithelium[J]. Development,2006,133:2149-2154.
[8] BODINE P V, KOMM B S. Wnt signaling and osteoblastogenesis[J]. Rev Endocr Metab Disord,2006,7:33-39.
[9] FAN HY, LIU Z, SHIMADA M, et al. MAPK3/1 (ERK1/2) in ovarian granulosa cells are essential for female fertility[J]. Science,2009,324(5929):938-941.
[10] VAN DEN HURK R, ZHAO J. Formation of mammalian oocytes and their growth, differentiation and maturation within ovarian follicles[J]. Theriogenology,2005, 63(6):1717-1751.
[11] NELSON L R, Bulun SE. Estrogen production and action[J]. J Am Acad Dermatol, 2001, 45:8116-8124.
[12] MILLER J R. The Wnts[J]. Genome Biol,2002,3(1):3001.
[13] HUANG H, HE X. Wnt/beta-catenin signaling: New (and old) players and new insights[J].Curr Opin Cell Biol, 2008, 20(2):119-125.
[14] WANG S B, XING B S, YI L, et al. Expression of Frizzled 2 in the mouse ovary during oestrous cycle[J]. J Anim Physiol Anim Nutr (Berl), 2010, 94(4):437-445.
[15] LI L, JI SY, YANG J L, et al. Wnt/β-catenin signaling regulates follicular development by modulating the expression of Foxo3a signaling components[J]. Mol Cell Endocrinol, 2014, 382(2):915-925.
(責任编辑 屠 晶)

