浅谈干燥剂在中学化学中的应用
浅谈干燥剂在中学化学中的应用
吴仪婷衷明华
(韩山师范学院化学系,广东 潮州 521041)
摘要:中学化学教材中常见的干燥剂,在高考中常以某物质某一具体性质的方式零星呈现。历年各地高考卷中也常出现考查干燥剂的选择及实验装置等内容的试题,且一般出现在选择题和无机化工流程题中,这就要求学生掌握一定的知识,如干燥剂的分类、干燥原理及其应用等,并牢记一些特殊例子,才能对干燥剂做出正确的选择。
关键词:干燥剂吸水性干燥效率酸碱性氧化还原性
一、干燥剂的基本概念
干燥剂是指能除去潮湿物质中水分的物质,也称吸附剂,化学吸附是其中一种常见的吸附方式,化学吸附干燥剂是通过化学方式吸收水分子并改变其化学结构,使其变成另一种物质的试剂。
二、干燥剂的分类
中学化学涉及到的干燥剂,若按其酸碱性可分为:
1、酸性干燥剂:浓硫酸、五氧化二磷、硅胶。
2、中性干燥剂:无水氯化钙、无水硫酸镁、硫酸钙、硫酸钠、氧化铝。
3、碱性干燥剂:碱石灰(主要成分CaO和NaOH)、生石灰、固体氢氧化钠、氢氧化钾、氧化钙、氧化钡。
若按其氧化还原性又可分为:
1、氧化性干燥剂:浓硫酸等。
2、还原性干燥剂:铁粉等。
三、干燥剂的选择原则及运用
不同干燥剂的干燥对象不同,需根据被干燥物质的性质选择合适的干燥剂。选择时既要考虑所选干燥剂不能与被干燥物质发生反应,又要注意干燥过程中不能引入新物质。
(一)当我们仅从物质酸碱性的角度分析时,考虑到酸性物质与碱性物质相遇会发生中和反应,可得结论:
酸性干燥剂不能干燥碱性气体,可干燥酸性和中性气体;
碱性干燥剂不能干燥酸性气体,可干燥碱性和中性气体;
中性干燥剂一般可干燥各种气体。
但物质除了具有酸碱性之外,可能还具有氧化还原性,即有还原性的物质不能选有氧化性的干燥剂,因干燥剂与被干燥物质可发生氧化还原反应,同理,若物质有络合性或加合性等性质,易生成络合物或加合物,也不宜用于干燥。
(二)常见干燥剂适合干燥的物质
1.总体来说:
酸性干燥剂可干燥CO2、SO2、HCl、Cl2、O2、CH4、H2等。
碱性干燥剂可干燥NH3、H2、O2、CH4等。
中性干燥剂可干燥O2、CH4、N2等。
2.具体介绍各干燥剂的性质和应用:
浓硫酸:有强烈的吸水性,可干燥N2、O2、H2、CH4、CO等中性气体和CO2、SO2、NO2、Cl2、HCl等非还原性的酸性气体,因其酸性故不能用来干燥NH3等碱性气体,又因其强氧化性故不能干燥H2S、HBr、HI、C2H4(烯烃)等还原性气体。
五氧化二磷:白色粉末,有“实验室最强的脱水剂”之说,可用来干燥O2、H2、N2、CO、CH4等中性气体和CO2、SO2、NO2、Cl2、HCl等酸性气体。
硅胶:化学性质稳定,不溶于水和任何溶剂,内部为极细的毛孔网状结构,对水有强烈的吸附作用,可做袋装食品的干燥剂,也常用来保持仪器的干燥,可干燥O2、N2、NH3等。
碱石灰和固体氢氧化钠:吸水快、是极佳的干燥剂,常用来干燥N2、O2、H2、CH4、CO等中性气体和NH3等碱性气体,不可干燥Cl2、HCl、H2S、SO2、CO2、NO2等酸性气体。
生石灰:白色固体,碱性氧化物,可用来干燥中性和碱性气体。
无水氯化钙:白色多孔固体,干燥能力强,一般用以填充干燥器,可干燥多种药品和N2、O2、H2、CH4、CO、CO2、SO2、NO2、Cl2、HCl等大多数气体,不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
无水硫酸镁:吸水作用迅速,干燥能力强,常用来干燥有机试剂。
硫酸钙:可干燥H2、O2、CO2、CO、N2、Cl、HCl、H2S、NH3、CH4等。
活性氧化铝:吸水量大,干燥速度快。
无水硫酸铜:具有一定的干燥性,吸水程度较小,一般用来检验水的存在,吸水后变蓝,不用来做干燥剂。
(三)常见物质适用的干燥剂
H2:CaCl2、H2SO4(浓)、CaO、P2O5、MgSO4、CaSO4
O2:CaCl2、H2SO4(浓)、P2O5、MgSO4、CaSO4
N2:P2O5、CaCl2、H2SO4(浓)、MgSO4、CaSO4
O3:P2O5、CaCl2
Cl2:CaCl2、H2SO4(浓)
CO:H2SO4(浓)、CaCl2、P2O5、MgSO4、CaSO4
CO2:H2SO4(浓)、CaCl2、P2O5、MgSO4、CaSO4
SO2:H2SO4(浓)、P2O5、CaCl2、MgSO4、CaSO4
CH4:P2O5、CaCl2、H2SO4(浓)、MgSO4、CaSO4、NaOH、Na、CaH2
NH3:碱石灰、CaO、KOH、Mg(ClO4)2、NaOH、MgSO4、CaSO4
HCl:CaCl2、H2SO4(浓)、ZnCl2
HBr:CaBr2、ZnBr2
HI:CaI2
H2S:CaCl2、P2O5
C2H4:P2O5
C2H2:P2O5、NaOH
NO:Ca(NO3)2、CaCl2、H2SO4(浓)、碱石灰、P2O5
酸性溶液:P2O5、MgSO4、CaSO4、硅胶
碱性溶液:NaOH、KOH、BaO、MgSO4、CaSO4
(四)干燥的特殊实例
1、干燥过程不能引入其他杂质
例:用Na2O2干燥N2时发生反应
2Na2O2+2H2O=4NaOH+O2,该过程虽除去了水蒸气,却也引入了杂质O2,故不能用Na2O2干燥N2。
2、干燥过程不应发生酸碱中和反应
例:不能用浓硫酸干燥氨水,因两者发生反应:2NH3+H2SO4=(NH4)2SO4
不能用五氧化二磷干燥氨水,因:
P2O5+H2O=2HPO3、
2HPO3+2H2O=2H3PO4、
3NH3+H3PO4=(NH4)3PO4
不能用碱石灰干燥硫化氢气体,因两者发生中和反应:H2S+2NaOH=Na2S+2H2O
3、不选用可与被干燥物质发生氧化还原反应的干燥剂
例:不能用浓硫酸干燥H2S、HBr、HI等强还原性的酸性气体,因为两者会发生氧化还原反应,如:
H2S+H2SO4=2H2O+SO2+S↓
4、不选用可与被干燥物质发生络合或加合反应的干燥剂
例:不能用无水硫酸铜干燥NH3,两者会反应生成络合物:CuSO4+NH3=[Cu(NH3)4]SO4
不能用无水CaCl2干燥NH3,两者会反应生成加合物:CaCl2+8NH3=CaCl2·8NH3
5、不选用可与被干燥物质发生沉淀反应的干燥剂
例:不能用无水硫酸铜干燥H2S气体,因两者反应生成沉淀:CuSO4+H2S=H2SO4+CuS↓
6、浓硫酸能干燥还原性气体SO2:SO2不能被浓硫酸氧化,SO2中S显+4价,浓硫酸中S显+6价,同种元素的不同价态之间若发生氧化还原反应,遵循归中而不交叉,而SO2与浓硫酸之间没有中间价态,故不发生归中反应。
7、浓硫酸能干燥还原性气体CO和H2:CO虽有较强的还原性,但它是等电子体,结构很稳定,难以被浓硫酸氧化;H2只有在高温时才能体现出还原性,常温下很稳定,可用浓硫酸干燥。
8、由以上部分实例可看出氨水只能用碱性干燥剂干燥。
四、常见的干燥装置
1、液态干燥剂一般装在带双孔橡皮塞的洗气瓶中,注意气体从长管进,短管出。

图 液态干燥剂
2、固态干燥剂一般装在球形干燥管或U形干燥管中,气体应从球形干燥管的大口进,小口出。
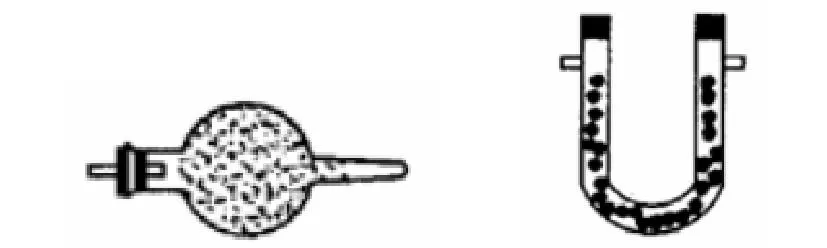
图 固态干燥剂
五、历年各地高考相关试题
1.(2012广东)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()。
C.Ⅰ浓硫酸有强氧化性Ⅱ浓硫酸可用于干燥H2和CO
解析:浓硫酸可用于干燥H2和CO是因为它的吸水性,故该选项错。
2.(2014天津)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是()。
A.NH3B.HIC.SO2D.CO2
解析:NH3是碱性气体,不能用浓硫酸或P2O5干燥;HI是具有还原性的酸性气体,可用P2O5干燥,但不能用浓硫酸干燥;SO2、CO2能用浓硫酸或P2O5干燥。综上选B。
3.(2012山东)无水AlCl3遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

图 实验装置
F中试剂的作用是(吸收水蒸气),用一件仪器装填适当试剂后也可起到F和G的作用,所填试剂为(碱石灰)。
解析:因氧化铝易水解,应防止空气中的水蒸气进入E装置,F盛装浓硫酸,G是吸收空气中的CO2,所以可加入碱石灰代替F和G的作用。
4.(2012重庆)氯离子插层镁铝水滑石〔Mg2Al(OH)6Cl·xH2O〕是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气,现用以下装置进行试验确定其化学式。
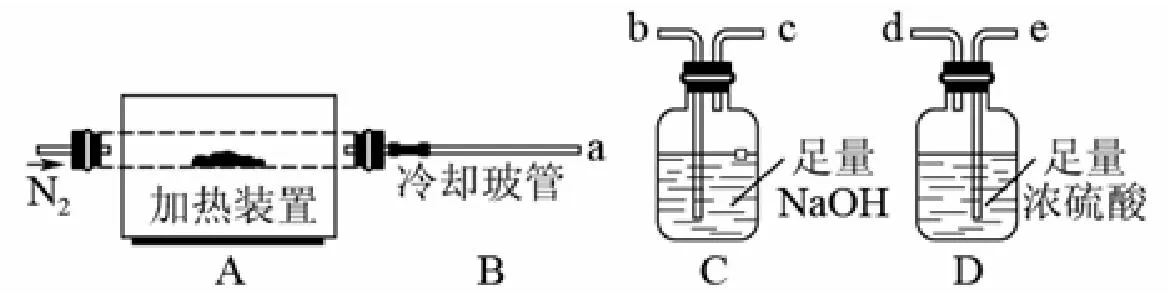
图 实验装置
完全分解后测得C增重3.65g、D增重9.90g,则x=(3)
解析:装置C、D的作用分别是吸收反应生成的HCl气体和水蒸气,应先通过D吸收水蒸气再通过C吸收HCl;气体通进洗气瓶时应从长导管通入,仪器连接顺序为a→e→d→b。
反应式2[Mg2Al(OH)6Cl·xH2O]=4MgO+Al2O3+ 2HCl↑+ (5+2x)H2O↑
73 18×(5+2x)
3.65g 9.90g
可解得x=3。

