减重平板训练联合甲基强的松龙对脊髓损伤大鼠运动功能的影响
李亚丽 夏 彬 刘合玉
郑州大学第二附属医院神经康复科 郑州 450014
脊髓损伤(spinal cord injury,SCI)是临床上常见但却无有效治疗的疾病,致残率高,所造成的功能障碍,尤其是运动功能障碍,严重影响患者的生活质量,因而SCI患者康复治疗的首要目标即改善和促进其运动功能。近年来大量研究表明减重步行训练(body weight support treadmill training,BSWTT)可促进脊髓损伤患者的运动功能[1-2]。也有动物实验及临床研究表明脊髓损伤后早期大剂量应用MP可明显促进神经功能的恢复[3]。本实验通过制作脊髓损伤大鼠模型,探讨减重平板联合MP是否比单纯平板训练更能促进SCI大鼠运动功能的恢复。
1 材料与方法
1.1 实验动物与分组 成年健康清洁级雄性SD大鼠48只,体质量360~400g,购于河南省实验动物中心。大鼠的体质量、窝别、月龄无显著性差异(P>0.05),采用完全随机法分为正常对照组(A组)、损伤对照组(B组)、单纯平板组(C组)、联合治疗组(D组)各12只。
1.2 SCI模型的制备 用10%水合氯醛按300mg/kg腹腔麻醉大鼠后,俯卧位固定于手术台上,剪毛后常规消毒,取后正中切口,切开皮肤,分离开筋膜、肌肉,切除T10椎板,使脊髓暴露。采用改良Allen's重锤打击法[4],通用型脊髓打击器5g的重锤自10cm的高处自由垂直落下,击中暴露脊髓,造成大鼠T10SCI模型。打击后可看到鼠尾出现不规则痉挛性摆动、双下肢回缩,脊髓硬膜表面充血水肿。术毕再用生理盐水冲洗,消毒后缝合。缝合后每日肌注青霉素20万U连续3d,每日2次人工按摩挤压膀胱以帮助排尿,至损伤大鼠能能自主排尿为止。
1.3 运动训练和给药方法 造模后,C组1周后进行减重平板训练,30min/次,1次/d,每周连续训练5d,共训练4周。D组缝合伤口后1h内给予甲基强的松龙琥珀酸钠30 mg/kg尾静脉15min缓慢注射,45min后再按5.4mg/kg计算23h总量,分3次腹腔内注射,1周后进行减重平板训练,30min/次,1次/d,每周连续训练5d,共训练4周。其中减重平板训练采用跑步机及减重装置联合,跑台速度设为0.8~1km/h,减重质量为第1周减体质量的40%,第2周35%,第3周30%,第4周20%。A组和B组不进行平板训练也不给予甲基强的松龙琥玻酸钠。其中造模后饲养时死去的模型大鼠,由备用大鼠模型补上,完成实验。
1.4 运动功能评定 分别于损伤前、损伤后1周、2周、3周、4周、5周对损伤对照组、减重平板组和联合治疗组进行运动功能评定。其中评定量表包括Basso、Beattie、Bresnahan(BBB)运动功能评分[5]、改良Tarlov评分[6]、斜板试验[7]。评定时间均定在10:00,由未参与实验但熟悉评定量表的3名实验人员采用双盲法评定,评分取3人评分均值。
1.5 统计学分析 所有数据应用SPSS 17.0统计软件进行分析,用t检验,多组均数比较采用单因素方差分析(LSD法),等级资料用非参数检验,P<0.05为差异有统计学意义。
2 结果
2.1 运动功能评定结果
2.1.1 BBB评分比较:脊髓损伤前,4组大鼠BBB评分为21.00分。损伤后1周,B、C、D 3组BBB评分均低于A组,但D组BBB评分高于B组和C组,但无显著性差异(P>0.05);随时间推移,B、C、D 3组BBB评分均呈增高趋势,训练2周时,D组和C组BBB评分显著高于B组(P<0.01),而D组和C组之间差异无统计学意义(P>0.05);从训练3周后开始,D组评分显著高于C组(P<0.05)和B组(P<0.01)。见表1。
2.1.2 改良Tarlov评分比较:脊髓损伤前,4组大鼠BBB评分均为5.00分。损伤后1周,B、C、D 3组Tarlov评分均低于A组,但3组评分差异无统计学意义(P>0.05);训练2周后,D组和C组评分均显著高于B组,差异有统计学意义,但D组和C组之间差异无统计学意义;从训练3周后开始,D组评分显著高于C组(P<0.05)和B组(P<0.01)。见表2。
2.1.3 斜板试验评分比较:损伤前,4组大鼠斜板最大角度42°~43°,损伤后1周,B、C、D组均明显低于A组,D组最大角度评分高于B和C组,但差异无统计学意义(P>0.05);而从训练2周后开始,D组和C组斜板评分均显著高于B组(P<0.01),且D组评分也高于C组,差异有统计学意义(P<0.05),见表3。损伤对照组大鼠5周与1周时评分相比,差异有统计学意义(P<0.01)。
表1 3组不同时间点BBB运动功能评分比较 (±s)
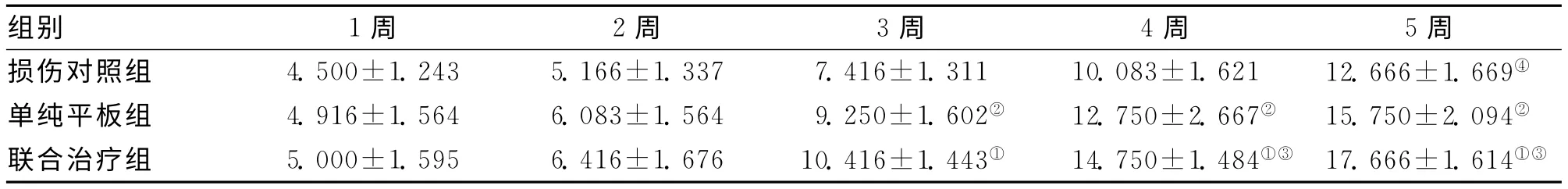
表1 3组不同时间点BBB运动功能评分比较 (±s)
注:与对照组,①P<0.01;与对照组,②P<0.01;③与平板组,P<0.05;与本组1周时比较,④P<0.01
组别 1周 2周 3周 4周 5周损伤对照组 4.500±1.243 5.166±1.337 7.416±1.311 10.083±1.621 12.666±1.669④单纯平板组 4.916±1.564 6.083±1.564 9.250±1.602② 12.750±2.667②15.750 ±2.094②联合治疗组 5.000±1.595 6.416±1.676 10.416±1.443① 14.750±1.484①③17.666 ±1.614①③
表2 3组不同时间点Tarlov评分比较 (±s)
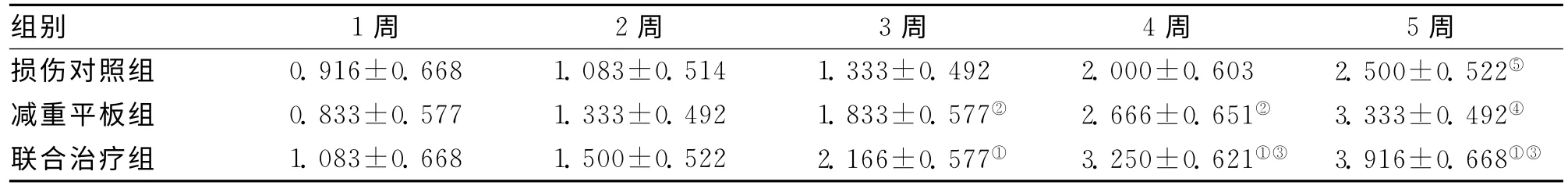
表2 3组不同时间点Tarlov评分比较 (±s)
注:与对照组,①P<0.01;与对照组,②P<0.05;与平板组,③P<0.05;与对照组,④P<0.01;与本组1周时比较,⑤P<0.01
组别 1周 2周 3周 4周 5周损伤对照组 0.916±0.668 1.083±0.514 1.333±0.492 2.000±0.603 2.500±0.522⑤减重平板组 0.833±0.577 1.333±0.492 1.833±0.577② 2.666±0.651② 3.333±0.492④联合治疗组 1.083±0.668 1.500±0.522 2.166±0.577① 3.250±0.621①③3.916 ±0.668①③
表3 3组不同时间点斜板试验评分比较 (±s)
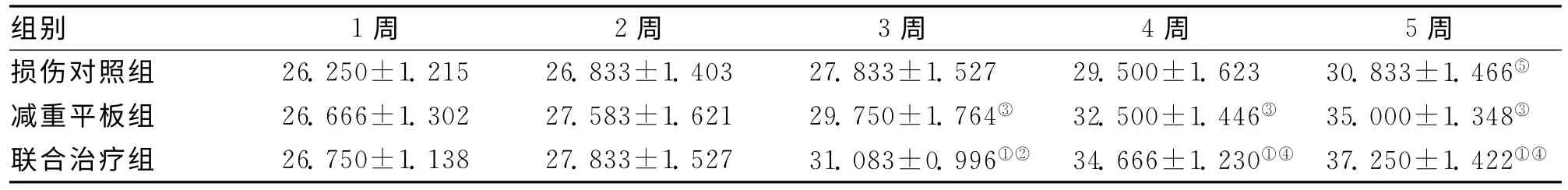
表3 3组不同时间点斜板试验评分比较 (±s)
注:与对照组,①P<0.01;与平板组,②P<0.05;与对照组,③P<0.01;与平板组,④P<0.01;与本组1周时比较,⑤P<0.01
组别 1周 2周 3周 4周 5周损伤对照组 26.250±1.215 26.833±1.403 27.833±1.527 29.500±1.623 30.833±1.466⑤减重平板组 26.666±1.302 27.583±1.621 29.750±1.764③ 32.500±1.446③35.000 ±1.348③联合治疗组 26.750±1.138 27.833±1.527 31.083±0.996①②34.666 ±1.230①④37.250 ±1.422①④
3 讨论
SCI按机制可分为原发性和继发性损伤。原发性损伤指由外力造成脊髓的直接机械性损伤。继发性损伤是在原发性损伤的基础上,又发生复杂的病理、生化反应,造成脊髓结构和功能的进一步损害。脊髓损伤后引起的功能障碍严重影响患者的生活质量,因此早期减轻脊髓的继发性损伤和后期的康复训练治疗是临床上脊髓损伤治疗的主要思考方向,本实验通过制作脊髓损伤大鼠模型,联合应用两种干预进行实验,从运动行为学角度评价干预效果,探讨减重平板训练联合早期应用MP是否能够更有效地促进脊髓损伤后大鼠运动功能的恢复,为临床更有效的康复治疗提供帮助。
由结果可知损伤早期,联合治疗组运动功能评分虽高于其余2组,但差异无统计学意义;而从随后每周的运动功能评分中看出,B、C、D 3组的运动功能评分呈增高趋势,训练2周后,联合治疗组和单纯平板组评分显著高于损伤对照组,差异有统计学意义,但联合治疗组与单纯平板组相比,差异无统计学意义(P>0.01),而从训练3周后开始,联合治疗组3项运动功能评分均显著高于单纯平板组和损伤对照组,且单纯平板组评分也显著高于损伤对照组;从损伤对照组自身前后评分比较,差异有统计学意义(P<0.01),表明脊髓损伤后不作任何治疗和处理,大鼠后肢运动功能也有较明显的恢复,其机制可能与中枢模式发生器(CPG)有关[8],是由脊髓中间神经元组成,其神经信号构成的网络可使脊髓在失去下行运动神经支配和上行感觉传入的情况下产生一些节律性运动。
本研究结果显示,单纯减重平板训练能促进脊髓损伤大鼠运动功能的恢复,其机制可能是平板训练刺激了SCI大鼠脊髓内神经生长因子的表达,保护了神经元,促进神经纤维的定向生长,减少了神经细胞的凋亡,促进神经功能的恢复[9-10];又显示减重平板训练联合早期应用MP较单纯平板训练更能促进脊髓损伤大鼠运动功能的恢复,其可能机制是脊髓损伤急性期应用大剂量MP通过减轻损伤脊髓的出血、水肿程度,减少神经细胞的凋亡,从而减轻了继发性损伤[11],这样在脊髓损伤较轻的前提下再进行减重平板训练,其运动功能恢复更好,为临床上脊髓损伤患者的康复治疗提供了新的参考依据和方法,但其联合应用的具体作用机制以及不同剂量的MP与不同减重量的最佳组合尚不完全清楚,还有待进一步研究。
[1]张缨,纪树荣,彭晓霞,等.慢性脊髓损伤患者步行训练有效性的Meta分析[J].中国康复医学杂志,2009,24,(2):153-157.
[2]丁晓晶,王红星,王彤.脊髓损伤大鼠运动训练方式的研究进展[J].中国康复医学杂志,2010,25(6):589-591.
[3]Stevens RD,Bhardwaj A,Kirsch JR,et al.Critical care and perioperative management in traumatic spinal cord injury[J].J Neurosurg Anesthesiol,2003,15(3):215-229.
[4]Halle D,Braughler JM,Mccall JM.Antioxidant effects on brain and spinal cord injury[J].J Neurotrauma,1992,9(Suppl 1):65-72.
[5]Basso DM,Beattie MS,Bbersnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1-21.
[6]Rivlin AS,Tator CH.Objective clinical assessment of motor function after experimental spinal cord injury in rat[J].J Neurosurg,1977,47(2):577-581.
[7]Cheng H,Cao YH,Olson L.Spinal cord repair in adult paraplegic rats:partial restoration of hind limb function[J].Science,1996,273(7):510-513.
[8]Marder E,Bucher D.Central pattern generators and the control of rhythmic movements[J].Curr Biol,2001,11(23):986-996.
[9]贺晓玉,周嘉嘉,邓京捷,黄霖,等.运动训练对脊髓损伤大鼠脊髓内神经生长因子及其受体TrkA表达的影响[J].海南医学,2014,25(11):1 563-1 566.
[10]黄俊红,谭翱勇,谭占国.神经生长因子在中枢神经功能修复中的研究进展[J].中国实用神经疾病杂志,2014,17(19):126-127.
[11]王涛,李露斯,刘雁平,等.真皮多能干细胞移植治疗大鼠脊髓损伤的实验研究[J].西南国防医药,2007,17(1):8-11.

