盐酸右美托咪啶对脑膜瘤患者围术期的脑保护效应
范伟卫
河北保定市第三医院麻醉科 保定 071000
脑膜瘤是常见的颅内良性肿瘤之一,发病率占颅内原发性肿瘤的15%,主要采用手术切除治疗。开颅行脑膜瘤切除术时,由于清除病灶的同时对周围相应区域的脑组织造成局部损伤,引起水肿、炎症等引起局部脑组织的代谢异常,加重脑组织的缺血、缺氧性损伤[1]。盐酸右美托咪啶(DEX)是一种新型的α2肾上腺素能受体激动剂,能抑制交感神经兴奋,产生有效镇痛、镇静作用,广泛应用于临床麻醉辅助用药[2]。在手术麻醉辅助用药中DEX的有效性和安全性较高,可通过多种生化途径发挥脑保护作用。本研究采用DEX作为脑膜瘤手术患者的麻醉用药,通过监测其IL-6和NSE水平变化探讨DEX对脑膜瘤围术期的脑保护作用。现报道如下。
1 资料与方法
1.1 一般资料 经我院伦理委员会批准,选取2012-06—2013-06我院就诊的择期行脑膜瘤切除术患者50例为研究对象,所有患者均签署知情同意书,均经CT、MRI或脑血管造影术确诊,且生命体征均平稳,无其他心、肝、肺、肾等基础疾病史。男28例,女22例;年龄36~65岁,平均(47.8±4.5)岁。采用随机数字法将50例患者分成对照组和DEX组,每组25例,2组性别、年龄、体质等方面差异无统计学意义(P>0.05),具有可比性。
1.2 麻醉方法 所有患者术前8h禁食、4h禁水,术前30 min予阿托品0.5mg肌内注射。进入手术室后行右颈内静脉穿刺置管采血,连续监测心电图、中心静脉压、平均动脉血压、脉搏、血氧饱和度。研究组:手术开始前静脉泵入右美托咪啶0.5μg/kg,以0.5μg/(kg·h)维持至手术结束。对照组:仅予同样剂量生理盐水泵入并维持至手术结束。2组手术开始前麻醉诱导一致:静脉注射芬太尼3μg/kg、丙泊酚1.5mg/kg,依托咪酯0.3mg/kg,阿曲库铵0.2mg/kg。麻醉诱导结束后5min行气管插管机械通气,设定潮气量为8 mL/kg,呼吸频率为12次/min,吸∶呼比为1∶2。手术结束后,患者意识清楚、呼吸恢复、呼吸频率>10次/min后拔除气管导管,予面罩吸氧并进行常规监测。
1.3 标本采集及检测方法 收集2组手术前24h(T1)、切开硬脑膜后(T2)、手术结束时(T3)和手术后24h(T4)4个时间点的静脉血5min,静置30min后,离心3 000r×10min,吸取上清存于EP管,并置于-80℃冰箱备测。采用电化学发光法对收集的血清样品进行神经元特异性烯醇化酶(NSE)检测,采用放射免疫法对血清样品中的白介素-6(IL-6)水平进行检测。
1.4 统计学处理 数据采用SPSS 15.0软件进行统计学处理,计量资料用±s表示,比较采用t检验,组内均数比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组不同时间点血清NSE水平比较 采用电化学发光法对2组不同时间点的血清NSE水平进行检测,其中对照组在T2、T3、T4时刻NSE水平均较T1的血清水平升高(P均<0.05);DEX组在T3、T4的NSE水平较T1升高,差异有统计学意义(P均<0.05)。DEX组血清NSE水平在T1与对照组相比无显著性差异(P>0.05),在T2、T3、T4时刻的NSE水平均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组不同时间点血清NSE水平比较 (±s,μg/L)
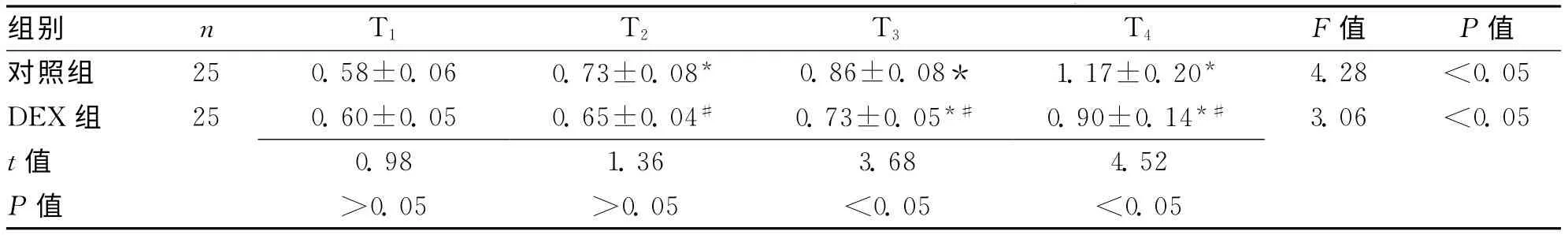
表1 2组不同时间点血清NSE水平比较 (±s,μg/L)
注:与T1比较,*P<0.05;与对照组比较,#P<0.05
组别 n T1 T2 T3 T4 F值 P值对照组 25 0.58±0.06 0.73±0.08* 0.86±0.08* 1.17±0.20* 4.28 <0.05 DEX组 25 0.60±0.05 0.65±0.04# 0.73±0.05*# 0.90±0.14*# 3.06 <0.05 t 值0.98 1.36 3.68 4.52 P值 >0.05 >0.05 <0.05 <0.05
2.2 2组不同时间点血清IL-6水平比较 采用放射免疫法对血清IL-6水平进行检测,对照组血清IL-6水平随着手术的进行明显升高,T3时最高,且T2、T3、T4时刻的血清水平均明显高于T1,差异有统计学意义(P均<0.05);DEX组IL-6水平亦随着手术的进行逐渐升高,T3最高,T2、T4的水平较T1无显著性差异(P>0.05),但明显低于对照组(P均<0.05)。见表2。
表2 2组在不同时间点血清IL-6水平比较 (±s,μg/L)
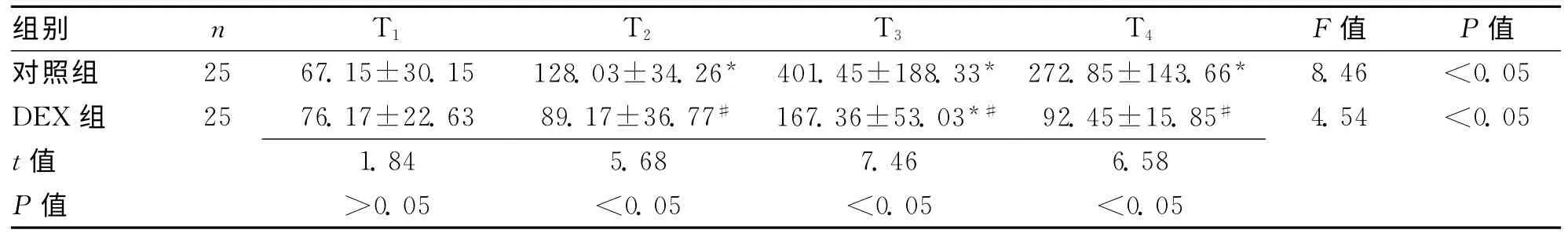
表2 2组在不同时间点血清IL-6水平比较 (±s,μg/L)
注:与T1比较,*P<0.05;与对照组比较,#P<0.05
组别 n T1 T2 T3 T4 F值 P值对照组 25 67.15±30.15 128.03±34.26*401.45 ±188.33*272.85 ±143.66* 8.46 <0.05 DEX组 25 76.17±22.63 89.17±36.77#167.36 ±53.03*#92.45 ±15.85# 4.54 <0.05 t 值1.84 5.68 7.46 6.58 P值 >0.05 <0.05 <0.05 <0.05
3 讨论
右美托咪啶作为一种高选择性的α2肾上腺素能受体激动剂,药代动力学特性稳定,不仅具有镇痛、镇静、催眠、抗交感兴奋作用,且多项研究表明DEX具有重要的脑保护作用。Sanders等[3]发现,DEX能抑制大鼠大脑缺血-再灌注损伤中神经元的凋亡。Maiert等[4]研究证实,DEX能明显减轻短暂脑缺血兔模型中的脑皮质损伤。在Goyagi的短暂性脑缺血模型中发现DEX能减小脑梗死面积[5]。DEX的脑保护作用在分子水平的变化尚待进一步研究。
本次研究结果表明,DEX组的血清NSE及IL-6水平在T2、T3、T4时均明显低于对照组,可能与其脑保护作用相关。脑膜瘤手术时造成的脑组织损伤诱发机体强烈的炎症反应[6]。炎症反应是机体的重要防御机制,适度的炎症反应能有效保护机体的正常生理功能,过量的炎症反应是继发性脑损伤的重要机制[7]。DEX具有强大的抗炎作用,能够有效抑制炎症因子的释放,降低其血清水平,其中IL-6是重要的炎症因子之一。本次研究结果表明,DEX组的血清IL-6水平均低于对照组,其机制可能与DEX通过抑制去甲肾上腺素能神经元的兴奋性,抑制儿茶酚胺的释放相关[8]。NSE是糖酵解途径中的关键酶,正常情况下血清NSE水平较低,当出现颅脑损伤时,神经元细胞水肿、损伤及轴索神经元被破坏,大量NSE释放入血[9]。Cooper等[10]试验证明NSE是判断神经元细胞死亡数量的有效参考指标,不仅特异性高,而且敏感性好。DEX通过抑制炎症因子的释放,减轻炎症反应对神经元细胞的损伤,发挥脑保护作用。
综上所述,右美托咪啶对于脑膜瘤围术期患者具有一定的脑保护作用,可能与抑制炎症因子的释放、减轻神经元细胞损伤相关,但具体作用机制尚待进一步研究。
[1]Luh C,Gierth K,Timaru-Kast R,et al.Influence of a brief episode of anesthesia during the induction of experimental brain trauma on secondary brain damage and inflammation[J].PLoS One,2011,6(5):e19 948.
[2]Nasrallah FA,Lew SK,Low AS,et al.Neural correlate of resting-state functional connectivity under alpha2adrenergic receptor agonist,medetomidine[J].Neuroimage,2014,84(2):27-34.
[3]Williams KA,Magnuson M,Majeed W,et al.Comparison of alpha-chloralose,medetomidine and isoflurane anesthesia for functional connectivity mapping in the rat[J].Magn Reson Imaging,2010,28(7):995-1 003.
[4]Duque FJ,Dominguez-Roldan JM,Martinez-Taboada F,et al.Effects of medetomidine and medetomidine-butorphanol on transcranial color-coded duplex ultrasonography in healthy dogs[J].Res Vet Sci,2013(2):95:648-653.
[5]Waelbers T,Peremans K,Vermeire S,et al.Effects of medetomidine and ketamine on the regional cerebral blood flow in cats:a SPECT study[J].Vet J,2012,192(1):81-88.
[6]Waelbers T,Peremans K,Vermeire S,et al.The effect of medetomidine on the regional cerebral blood flow in dogs measured using Technetium-99m-Ethyl Cysteinate Dimer SPECT[J].Res Vet Sci,2011,91(1):138-143.
[7]Ciobanu L,Reynaud O,Uhrig L,et al.Effects of anesthetic agents on brain blood oxygenation level revealed with ultra-high field MRI[J].PLoS One,2012,7(3):e32 645.
[8]Pawela CP,Biswal BB,Hudetz AG,et al.A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity[J].Neuroimage,2009,46(4):1 137-1 147.
[9]Nasrallah FA,Tay HC,Chuang KH.Detection of functional connectivity in the resting mouse brain[J].Neuroimage,2014,86(3):417-424.
[10]Kalthoff D,Po C,Wiedermann D,et al.Reliability and spatial specificity of rat brain sensorimotor functional connectivity networks are superior under sedation compared with general anesthesia[J].NMR Biomed,2013,26(6):638-650.

