无机盐对酶促大豆蛋白胶凝特性的影响
笪久香 胡亚云 栾广忠 严陇兵 辰巳英三
(西北农林科技大学食品科学与工程学院1,杨凌 712100)
(国家知识产权局专利局专利审查协作广东中心2,广州 510530)
(国家知识产权局专利局专利审查协作江苏中心3,苏州 215001)
(日本农林水产国际研究中心4,筑波,日本 305-8686)
无机盐对酶促大豆蛋白胶凝特性的影响
笪久香1,2胡亚云1栾广忠1严陇兵3辰巳英三4
(西北农林科技大学食品科学与工程学院1,杨凌 712100)
(国家知识产权局专利局专利审查协作广东中心2,广州 510530)
(国家知识产权局专利局专利审查协作江苏中心3,苏州 215001)
(日本农林水产国际研究中心4,筑波,日本 305-8686)
为了探究无机盐对大豆蛋白酶促胶凝过程热动力学特性及凝胶强度的影响规律,以大豆分离蛋白分散液(Dispersion of soybean protein isolate,DSPI,4%,m/m)为材料,以木瓜蛋白酶为凝固剂进行酶促胶凝试验,测定不同无机盐种类及浓度下的胶凝时间,并通过Arrhenius方程求出反应活化能;以凝胶强度为指标,利用Box-Behnken中心组合设计试验建立以Ca2+浓度、温度及酶添加量为参数的凝胶强度模型。结果表明添加无机盐(NaCl、KCl、CaCl2、MgCl2和MgSO4)可降低酶促DSPI凝胶的活化能,但Arrhenius曲线仍呈线性关系,说明无机盐可加快反应速度,但胶凝反应仍遵循同一机理;显著性检验及响应面分析表明所建凝胶强度模型拟合度较高,木瓜蛋白酶添加量对凝胶强度影响显著(P<0.05),CaCl2添加量与温度的交互作用对凝胶强度的影响极显著(P<0.01),CaCl2和温度同时较高或较低时,均不利于提高凝胶强度。
大豆分离蛋白 酶促胶凝 木瓜蛋白酶 活化能 无机盐 凝胶强度
大豆分离蛋白(soybean protein isolate,SPI)的胶凝性(Gelling ability)是其重要的功能特性之一,在增强食品的赋形性及改善食品质地和口感方面具有重要的作用[1],同时也是豆腐脑、豆腐等凝胶类豆制品研究的基础理论[1-2]。SPI在较高浓度下可形成热凝胶,但较低浓度的大豆蛋白分散液(Dispersion of SPI,DSPI)需在凝固剂(Coagulant)的作用下形成凝胶[3]。常用的凝固剂有氯化镁和硫酸钙等二价盐离子及酸(如乳酸发酵及 δ-葡萄糖酸内酯)[4-5]。一些蛋白酶具有凝固大豆蛋白的活性(Soybean protein coagulating activity,SPCA),形成酶促凝胶(enzymatic-induced DSPI gel,EDG),如无花果蛋白酶(ficin)、菠萝蛋白酶(bromelain)及木瓜蛋白酶(papain)等植物蛋白酶,胰凝乳蛋白酶(chymotrypsin)等动物蛋白酶[6],以及一些微生物,如枯草芽孢杆菌(Bacillus subtilis)、纳豆芽孢杆菌(bacillus natto)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、多黏芽孢杆菌(Bacillus polymyxa)、蜂蜜曲霉(Aspergillusmelleus)、地衣芽孢杆菌(Bacillus licheniformis)、灰色链霉菌(Streptomycesgriseus)、酱油曲霉(Aspergillus sojae)等所产蛋白酶均具有凝固 DSPI的能力[7-10];而胃蛋白酶(pepsin)、凝乳酶(rennin)不具有凝固 DSPI的能力[6-7]。
EDG形成的机理目前普遍认为是蛋白酶先将大豆蛋白分子水解成多肽片段,原来的球蛋白结构被破坏,内部疏水基团暴露,多肽片段通过疏水作用凝聚形成凝胶,氢键、范德华力等非共价结合是形成凝胶的主要分子间作用力[11-13]。影响EDG性质的因素很多,如酶用量、凝固温度、蛋白质浓度及离子种类和强度等[14]。这些因素可影响凝胶形成时间,从而影响凝胶网络的形成速度和结构,并表现在凝胶黏性、弹性力学性质上。研究表明,EDG的凝胶强度较弱[6,15],但 EDG的胶凝过程更易控制、口感细腻,且大豆蛋白被酶分解为更小段的肽或氨基酸,营养物质更易被吸收。
无机盐的种类及浓度对EDG胶凝速度及凝胶强度均有较大的影响[16],但相关热动力学特性及凝胶强度模型研究较少。本研究从不同温度和离子强度下EDG胶凝时间入手,探讨无机盐(NaCl、KCl、CaCl2、MgCl2和 MgSO4)对木瓜蛋白酶凝固 DSPI的热动力学特性影响。另外,以CaCl2为代表建立以温度、无机盐浓度及凝固剂用量为参数的EDG凝胶强度模型,为酶促大豆蛋白胶凝技术的应用提供参考。
1 材料与方法
1.1 材料与试剂
SPI:上海舒莱公司,蛋白质质量分数90%(干基);木瓜蛋白酶(木瓜乳冻干而得,EC:3.4.22.2):Sigma生物试剂有限公司,标称活力3 500 U/mg。
1.2 主要仪器
TA.XT2质构仪:英国Stable Micro System公司。
1.3 试验方法
1.3.1 DSPI的制备
将SPI粉末分散于去离子水中(4%,m/m),搅拌5min,使SPI分散均匀,置于沸水浴热处理15min后,立即在冰水混合物中冷却至4℃,补充加热时蒸发损失的水分,4℃冰箱中储藏备用。
1.3.2 不同无机盐对DSPI酶促胶凝时间的测定
取5mL预处理的DSPI溶液于试管中,在试验温度(35、40、50、55、60、70℃)下水浴保温 30min,按照下述离子强度(Ionic Strength,IS)的式(1)计算[17],加入一定量的 CaCl2、MgCl2、MgSO4、NaCl和KCl(事先配成 2mol/L,用时摇匀)溶液,用涡旋振荡器搅拌30 s后置于该温度下水浴,继续保温30min,再加入0.15%(m/m,5 g/100mL)的木瓜蛋白酶液,迅速搅匀,并计时。当管壁出现凝固颗粒时,即判断DSPI凝固,此间所用的时间即为胶凝时间,精确到秒。

式中:c为各离子的物质的量浓度/mmol/L;k为该离子的价数。
NaCl、KCl离子强度与物质的量浓度数值相同;CaCl2、MgCl2、离子强度分别为 6、15、30、40时所对应的物质的量浓度分别为 2、5、10、13.33 mmol/L;Mg-SO4离子强度分别为6、15、30、40时所对应的物质的量浓度分别为 1.5、3.75、7.5、10 mmol/L。无机盐配制成2.0mol/L的溶液,计算添加至DSPI中所需的无机盐溶液的体积。
1.3.3 不同无机盐对木瓜蛋白酶凝固DSPI的活化能计算
Arrhenius方程即化学反应速率常数随温度变化的经验公式 K=A e-Ea/RT,经过积分变换后,公式变成

式中:K为化学反应速率/S-1;E a为发生反应的所需的活化能/J/mol;R为摩尔气体常量(8.314 J/L);T为热力学温度/K;A为指前因子/S-1。由式(2)可知,对于不同温度T下的速率常数K值,ln K与1/T成线性关系,直线的斜率和截距分别为 -E a/R和ln A。通过线性拟合可计算出活化能E a。以离子强度为0作为空白对照。
DSPI的胶凝时间(单位:s)代表形成凝胶的速率,将时间的对数和温度的倒数作线性拟合,计算不同离子强度无机盐对木瓜蛋白酶凝固DSPI形成凝胶的活化能E a,通过活化能的比较,解释无机盐对木瓜蛋白酶凝固DSPI胶凝时间的差异。
1.3.4 EDG凝胶强度模型建立与数据分析
EDG的制备:取50mL上述DSPI于100mL烧杯中,于一定温度下水浴保温30min,加入适量的2mol/L CaCl2溶液,搅拌均匀,于该温度下继续保温30min,加入不同量(m/m)的木瓜蛋白酶,搅拌均匀后静置等待DSPI形成凝胶(即EDG)。凝胶形成30min后,将其取出置于冰水混合物中冷却,后于4℃冰箱中放置过夜。
凝胶强度测定:测前30min取出EDG恢复至室温,参照质构仪自带的反向挤压(back extrusion)程序进行测定。为了不破坏已形成的凝胶,测定未使用质构仪所配的标准杯,不对凝胶进行搅拌,而直接使用小烧杯进行测定。质构仪测定参数为:探头:A/BE(直径35mm);测试前速率:1mm/s;测试速率:1mm/s;测试后速率:10mm/s;测试深度:20mm;触发应力:0.5 g。所得质构曲线中,x轴上方曲线的最大峰所对应的力表示硬度F/g,代表凝胶强度。
单因素试验:以DEG的凝胶强度为指标,采用单因素试验,选取因素的合适水平。固定CaCl2物质的量浓度为5 mmol/L、温度为40℃,研究木瓜蛋白酶的添加量(0.025%~0.150%)对EDG凝胶强度的影响;固定木瓜蛋白酶的添加量为0.1%、温度为40℃,研究 CaCl2物质的量浓度(2.5~12.5 mmol/L)对EDG凝胶强度的影响;固定木瓜蛋白酶的添加量为0.1%、CaCl2物质的量浓度为 5 mmol/L,研究温度(30~80℃)对EDG凝胶强度的影响。
试验中数据为3次试验的平均值,采用DPS7.0版软件利用最小二乘法进行方差分析。采用软件Design Expert 7.0中Box-Behnken模型,选取三因(2)的形式,素三水平和三个中心点,优化木瓜蛋白酶用量、CaCl2浓度和凝固温度对EDG凝胶强度的影响。采用软件Design Expert7.0软件对回归模型进行分析。
2 结果与分析
2.1 不同无机盐对EDG活化能的影响
根据 Arrhenius公式,ln K=-E a/R×(1/T)+ln A,以ln K对1/T作图,经线性回归可求得Arrhenius方程及活化能E a。离子强度为0时Arrhenius曲线见图1。其他离子强度下所得线性回归方程的决定系数(其测定温度与离子强度为0时的各测定温度相同)与其相似(数据未列出)。
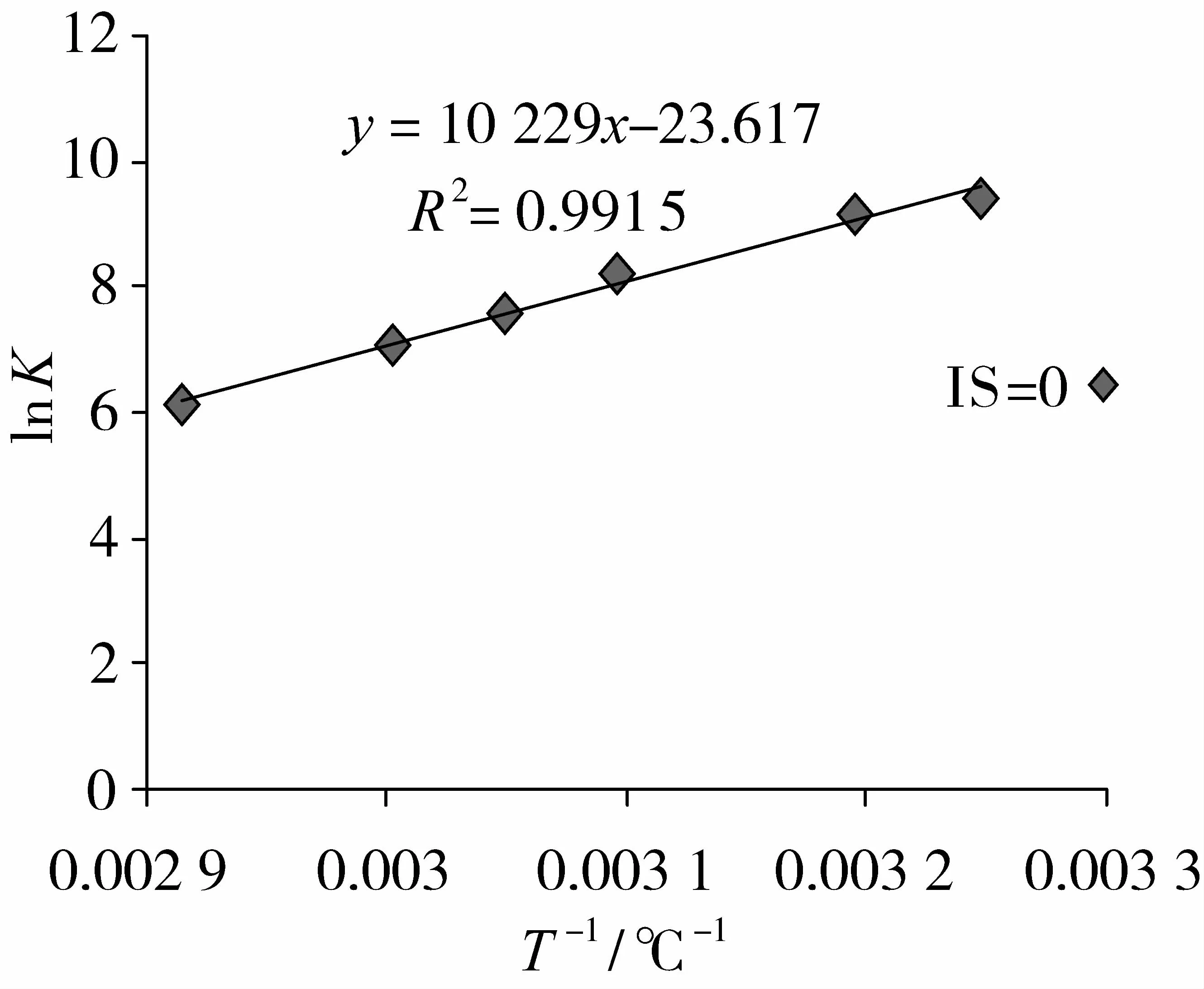
图1 离子强度为0时的Arrhenius曲线
不同离子强度下,各种无机盐对EDG的活化能及相关系数数值影响如表1所示。在不同温度下,凝固时间的对数与温度的倒数二者之间线性拟合程度较好,拟合的相关系数均达98.8%以上。无论是一价盐离子还是二价盐离子,随着离子强度的增加,EDG的活化能均逐渐降低。NaCl及KCl的离子强度从0增加到40,活化能从85 kJ/mol分别降低至47.5和55.1 kJ/mol。CaCl2和 MgCl2的离子强度从0增加至15过程中,活化能分别降低至61.8和62.1 kJ/mol,MgSO4的离子强度增加至 30,活化能降低至43.7 kJ/mol。
分子间化学反应的发生,必须给予足够能量使旧的化学键破裂,这个最低能量称为活化能[18]。一般认为DSPI形成EDG的机理是:蛋白酶将大豆蛋白水解为多肽,造成蛋白质球状结构的破坏及疏水基团的暴露,然后多肽链经过疏水相互作用、氢键和二硫键的交联,促发蛋白质形成网状交联结构[11-12]。DSPI在形成凝胶网络结构过程中,必须克服较大的静电斥力,形成疏水相互作用和氢键,该过程所需的最低能量即为胶凝反应的活化能。加入无机盐后,降低了EDG所需的活化能,因此,胶凝时间变短。
2.2 单因素试验
2.2.1 木瓜蛋白酶添加量
木瓜蛋白酶添加量对凝胶强度的影响如图2所示,在试验条件下,木瓜蛋白酶添加量从0.025%增加到0.075%的过程中凝胶强度极显著增加(P<0.01),随后,继续增加木瓜蛋白酶的用量,凝胶的硬度维持在相对稳定的水平,差异不显著。从经济角度考虑,选择0.075%为适宜加酶量。

图2 不同加酶量对EDG凝胶强度的影响
2.2.2 CaCl2浓度
CaCl2浓度对凝胶强度的影响如图3所示。CaCl2浓度可显著改变EDG的凝胶强度。CaCl2的物质的量浓度从2.5 mmol/L增加至7.5 mmol/L过程中,凝胶的硬度显著增加(P<0.01)。由于静电屏蔽和盐桥作用的双重效果[19-20],凝胶强度显著增加(P<0.01);随着CaCl2浓度的继续增大,凝胶强度显著降低(P<0.01),这可能是由于静电屏蔽和盐桥作用过大,蛋白质间的疏水相互作用成为主导效应[21],加酶后凝固时间短,乳清大量析出,观察切面发现凝胶网络结构粗糙。Lu等[22]在研究Ca2+浓度对DSPI凝胶微观结构时,采用共聚焦激光扫描显微镜发现,离子浓度越高,凝胶结构越粗糙,孔径越大,凝胶保水性越差。Maltais等[23]采用扫描电镜也发现了相同的规律:低离子浓度时,凝胶结构均匀密集,而高离子强度下,凝胶孔径越大,结构无序,肽链间随机组合性大。这与本研究的结果相一致。综上,可以选择CaCl2的物质的量浓度为7.5 mmol/L作为适宜的添加量。
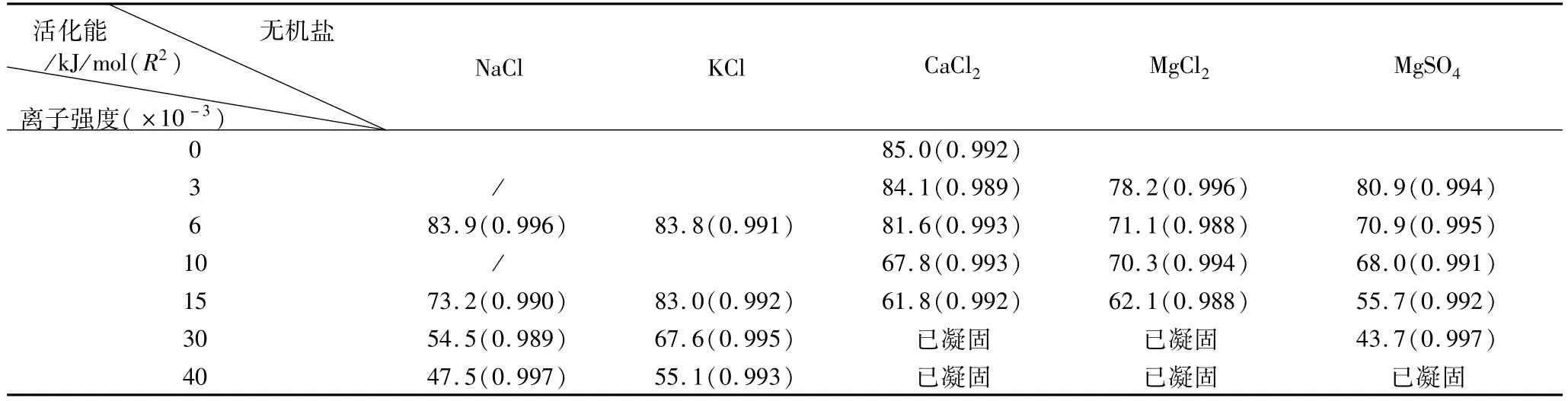
表1 不同离子强度无机盐对EDG的活化能及相关系数的影响

图3 CaCl2物质的量浓度对EDG凝胶强度的影响
2.2.3 温度
温度对凝胶强度的影响如图4所示。
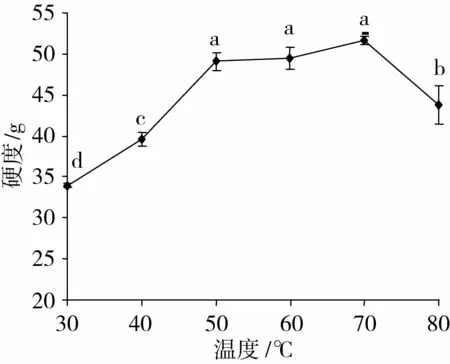
图4 温度对EDG凝胶强度的影响
从图4可以看出,温度对凝胶强度有较大影响。凝固温度从30℃增加至50℃,凝胶强度显著增加(P<0.01);从50℃增加至70℃,凝胶强度基本不变;温度进一步升至80℃时,凝胶强度显著降低(P<0.01)。其原因可能是变性后的大豆蛋白在低温冷却后有一定程度的复性[24]。另一方面较低温度下(小于70℃),随着温度的升高,蛋白质多肽链的伸展程度增大,暴露的疏水基团增多,有利于凝胶网络的形成[25]。在高温(80℃)下,蛋白质被水解成小分子的速度过快,凝胶速度过快,不利于形成致密的凝胶结构[26]。因此选择50℃作为适宜的凝胶温度。
2.3 木瓜蛋白酶EDG的模型建立及响应面分析
2.3.1 响应面分析因素水平的选取
综合单因素试验结果,根据Box-Behnken的中心组合试验设计原理[27-28],选用三因素三水平的响应面分析方法建立凝胶强度预测模型。试验因素与水平设计见表2。
2.3.2 响应面分析方案及结果
对木瓜蛋白酶添加量x1、CaCl2添加量x2和反应温度 x3作如下代换:X1=(x1-0.075)/0.025,X2=(x2-7.5)/2.5,X3=(x3-50)/10。以 X1、X2、X3为自变量,以凝胶强度为响应值,试验方案及结果见表3。
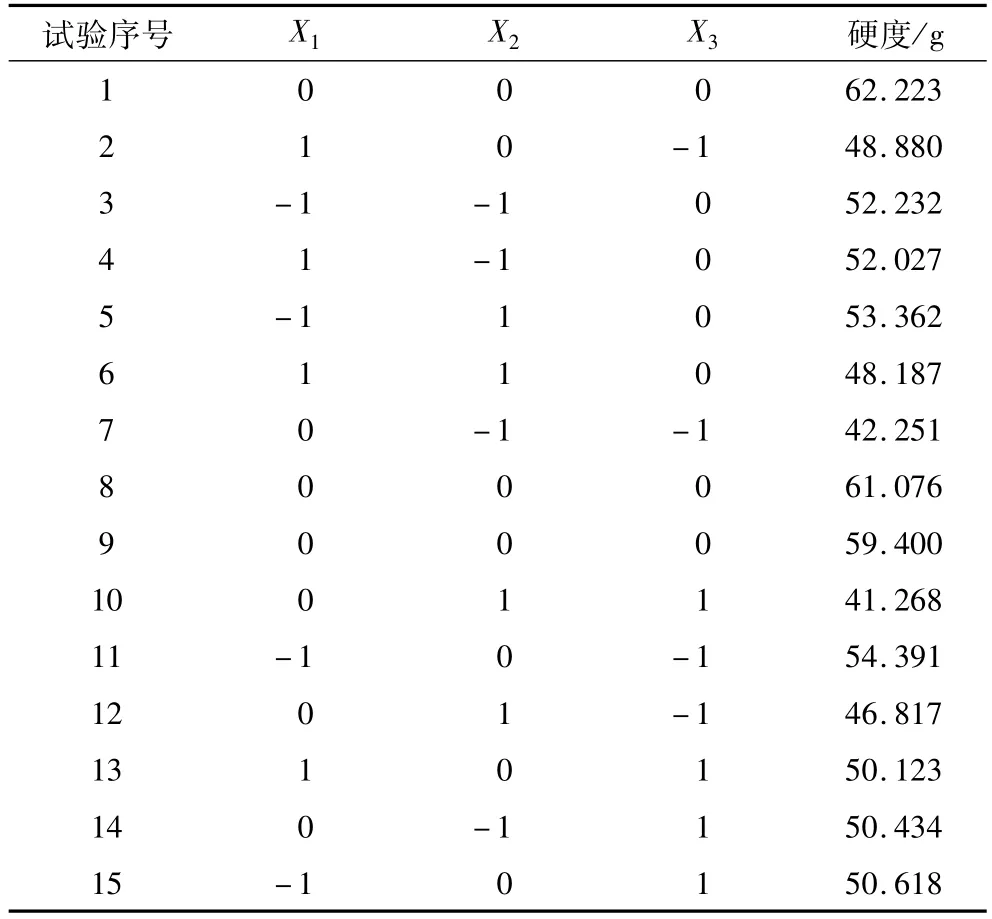
表3 响应面分析方案及试验结果
2.3.2.1 数学模型建立与显著性检验
利用三因素二次回归正交旋转组合试验设计方案对影响凝胶强度的3个参数进行优化,利用Design-Expert7.0软件对表3中的试验结果进行多元回归拟合,得出回归方程中的各项回归系数,方差分析见表4,用F检验法检验其显著性[28]。

表4 凝胶强度模型的方差分析及显著性检验
对表3在不同条件下测定的硬度,利用Design Expert 7.0软件进行回归拟合得到硬度的回归方程为:Y=60.90-1.42X1-0.91X2+0.013X3-
对回归方程的有效性进行检测,由表4的方差分析结果可以看出:一次项中X1对Y影响显著,即木瓜蛋白酶添加量对凝胶强度影响显著;二次项的影响极显著,说明各试验因素对响应值的影响并不是简单的线性关系;交互项X2X3对Y的影响极显著,即CaCl2添加量与反应温度的交互作用对凝胶强度的影响极显著。对回归方程的显著性检验可知,模型 F1=35.88>F0.01(5,9),仅有0.05%的可能性是由扰动项造成的,说明模型(方程)极显著;对回归方程的失拟项检验可知,F2=0.66<F0.05(2,3),说明在P>0.05水平不显著,失拟项影响很小。模型R2=0.984 8,调整后RAdj2=0.9573,表明仅有4.27%变异的不能由该模型解释,说明该模型具有较高价值。同时变异系数(2.43%)也较低,表明该试验具有很高的精确度和可靠性。因此,该模型拟合程度较好,试验误差小,较好的反映了凝胶的硬度与木瓜蛋白酶添加量、CaCl2添加量和反应温度的关系。
2.3.2.2 响应面分析
由回归系数显著性检验可知,X2(CaCl2添加量)和X3(温度)的交互作用对硬度的影响极显著,其他因素的交互作用影响不显著。固定其他因素在零水影响显著平,根据任意两因素的响应值所构成的等高线及响应曲面,就可以反映交互作用的强弱。因此,采用这种方法,将木瓜蛋白酶的添加量控制在零水平,来研究CaCl2添加量和温度的交互作用对凝胶强度的影响。结果如图5所示。

图5 CaCl2添加量和温度的交互作用对凝胶强度等高线及响应曲面的影响
由图5可以看出,随着CaCl2浓度的升高,温度的增加,凝胶强度呈先升后降的趋势。由回归方程及响应面图可以看出,CaCl2浓度和温度对凝胶强度的影响均呈现负二次曲线形式,CaCl2和温度二者均较高或较低时,均不利于提高EDG凝胶的硬度。
在一定范围内,温度、CaCl2浓度增加对大豆球蛋白间的交联有促进作用。Scilingo等[29]通过DSC研究了钙和热处理对大豆蛋白稳定性的影响,结果表明,钙水平在一定范围内对蛋白质有保护作用,可以防止高温对蛋白质的变性;经热处理变性后的大豆蛋白低温冷却后有一定程度的复性[24],在适宜的温度下,Ca2+的存在加固了大豆蛋白多肽链之间的交联,从而促使凝胶结构稳定,凝胶强度较高。Ca2+在较低浓度下促进酶交联11S蛋白聚合物的形成,而高浓度则抑制大分子聚合物的形成[30],但离子浓度过大,蛋白乳液粒径也增大,蛋白稳定性随之降低[31]。同时温度过高,由于大豆蛋白中7S与11S变性温度的差异,导致部分复性后的蛋白再次变性[32],在蛋白酶的作用下,多肽水解的速度过快,双重结果促使凝胶结构疏松、不稳定,凝胶强度较低。因此,虽然一定条件先提高温度和CaCl2浓度可促进大豆蛋白多肽链交联,但过高会使胶凝反应速度过快,不利于形成致密的网络结构,整体过于粗糙的凝胶结构,其凝胶强度自然也较低。
2.3.3 影响凝胶硬度的参数优化
根据回归方程的模拟寻优,得到响应值Y最大时优化条件为:X1=-0.39,X2=-0.02,X3=-0.03,即木瓜蛋白酶添加量0.065 25%、CaCl2物质的量浓度7.45 mmol/L、温度为49.7℃。在此条件下重复进行3次试验,平均硬度为61.754,这与回归方程预测值为61.188 9 g基本相等,说明该优化工艺正确可行,该回归方程与实际情况拟合良好。
3 结论
无机盐加快胶凝速度的原因是反应活化能降低,使反应更容易进行;Arrhenius曲线呈线性关系说明无机盐的加入虽加快了反应速度,但仍遵循同一反应机理。
所建立EDG凝胶强度模型能较准确预测凝胶的强度。木瓜蛋白酶添加量及CaCl2添加量与反应温度的交互作用对凝胶强度的影响极显著。CaCl2浓度和温度对凝胶强度的影响均呈现负二次曲线形式,二者同时较高或较低时,均不利于提高EDG凝胶的硬度。
[1]徐幸莲,彭增起,邓尚贵.食品原料学[M].北京:中国计量出版社,2006:114
[2]韩丽英.大豆蛋白凝胶特性对豆腐品质的影响 [D].哈尔滨:东北农业大学,2008
[3]Molina O S,Puppom C,Wagner JR.Relationship between structural changes and functional properties of soy protein isolates-carrageenan systems[J].Food Hydrocolloids,2004,18(6):1045-1053
[4]Moizuddin S,Harvey G,Fenton A M,et al.Tofu production from soybeans of full-fat soyflaks using direct and indirect heating processed[J].Journal of Food Science,1999,64:155
[5]Shen C F,Man D L,Buzzell R I,etal.Yield and quality of tofu as affect by soybean and soymilk characteristics:geltalactone coagulant[J].Journal of Food Science,1991,56:109
[6]栾广忠,李里特.蛋白酶对豆乳的凝固作用研究[J].食品工业科技,2006,27(1):71-74
[7]Blazek V,Caldwell R.The efficiency of coagulation of soy protein induced by commercial proteases[C].In Proceedings of14thAustralian Soybean Industry Conference,Bundaberg,2007,4-11
[8]Katsum I.Studies on the coagulation of soymilk-protein by commercial proteinase[J].Agricultrural and Biological Chemistry,1987,51:385
[9]刘敬媛,韩建春,冯镇,等.纳豆芽孢杆菌蛋白酶对大豆分离蛋白凝胶性的影响[J].食品工业科技,2013,34(4):164-167
[10]吴华昌,靳晓黎,邓静.豆乳凝固酶的研究进展[J].中国酿造,2010,(3):4-6
[11]Machiko M,Setsuro M.Improvement of water absorption of soybean protein by treatmentwith Bromelian[J].Journal of Agricultural and Food Chemistry,1984,32:486
[12]栾广忠,程永强,鲁战会,等.碱性蛋白酶Alcalase凝固大豆分离蛋白的分子间作用力[J].农业工程学报,2007,23(10):266-270
[13]巫庆华.木瓜蛋白酶凝固大豆蛋白质机理[J].乳业科学与技术,2002(1):6-9
[14]王丽,张英华.大豆分离蛋白的凝胶性及其应用的研究进展[J].中国粮油学报,2010,25(4):96-99
[15]朱学坤,彭见林,韩鹏飞.木瓜蛋白酶酶促豆浆蛋白凝固作用的研究[J].食品工业科技,2011(10):256-258
[16]笪久香,李莹莹,栾广忠,等.无机盐对木瓜蛋白酶凝固大豆分离蛋白凝胶的影响[J].食品科学,2012,33(11):30-34
[17]徐虹.新编普通化学[M].郑州:郑州大学出版社,2011:88
[18]李之俊,刘茜毓.化学反应活化能概念的探讨[J].山东轻工业学院学报,1995,9(2):11-13,28
[19]刘志胜.豆腐盐类凝固剂的凝固特性与作用机理研究[J].中国粮油学报,2000,15(3):39-43
[20]Nagano T,Masayuki T.Viscoelastic properties and microstructures of 11S globulin and soybean protein isolate gels:magnesium chloride-induced gels[J].Food Hydrocolloids,2011,25(7):1647-1654
[21]华欲飞,Cui SW,Wang Q,等.不同大豆分离蛋白凝胶的流变学性质[J].中国粮油学报,2003,18(6):43-47
[22]Lu X,Lu ZH,Yin L J,etal.Effectof preheating temperature and calcium ions on the properties of cold-set soybean protein gel[J].Food Research International,2010,43(6):1673-1683
[23]Maltais A,Remondetto G E,Subirade M.Mechanisms in-volved in the formation and structure of soya protein coldset gels:amolecular and supramolecular investigation[J].Food Hydrocolloids,2008,22(4):550-559
[24]Srinviasan D.Refolding of thermally unfolded soy proteins during the cooling regime of the gelation process:effect on gelation[J].Journal of Agricultural and Food Chemistry,1998,36:262-269
[25]李里特,刘志胜,辰巳英三.加工条件对豆腐凝胶物性品质的影响[J].食品科学,2000,21(5):26-29
[26]陈莉,钟芳,王璋.凝固剂及凝固条件对大豆蛋白胶凝性质的影响[J].中国乳品工业,2004,32(9):23-27
[27]费荣昌.试验设计与数据处理[M].第四版.无锡:江南大学出版社,2001:59-63
[28]Box G E P,Hunter W G.Statistics for experiments:an introduction to design,Data Analysis and Model Building.New York:Wiley.1990:579
[29]Scilingo A A,Anon M C.Calorimetric study of soybean protein isolate:effect of calcium and thermal treatments[J].Journal of Agricultural and Food Chemistry,1996,44(12):3751-3756
[30]Zhang G Y,Matsumura Y,Matsumoto S,et al.Effects of Ca2+and sulfhydryl reductant on the polymerization of soybean glycinin catalyzed by mammalian and microbial transglutaminases[J].Journal of Agricultural and Food Chemistry,2003,51(1):236-243
[31]Ramkumar C,Singh H,Munro PA,etal.Influence of calcium,magnesium or potassium ions on the formation and stability of emulsions prepared using highly hydrolyzed whey protein[J].Journal of Agricultural and Food Chemistry,2000,48(5):1598-1604
[32]汪立君,李里特,张晓锋,等.利用DSC对大豆蛋白质热变性的研究[J].中国农业大学学报,2001,6(6),93-96.
Effects of Inorganic Salts on the Gel Properties of Enzymatic-Induced Soybean Protein
Da Jiuxiang1,2Hu Yayun1Luan Guangzhong1Yan Longbing3Eizo Tatsumi4
(College of Food Science and Engineering,Northwest A&F University1,Yangling 712100)
(Patent Examination Cooperation of the Patent Office,SIPO,Guangdong2,Guangzhou 510530)
(Patent Examination Cooperation of the Patent Office,SIPO,Jiangsu3,Suzhou 215001)
(Japan International Research Centre for Agricultural Science4,Tsukuba,Japan 305-8686)
In order to investigate the effects of inorganic salt on thermal dynamic properties and gel strength of enzymatic-induced soybean protein gel,the dispersions of soybean protein isolate(4%,m/m)have been coagulated by papain.The clotting time was calculated on basis of the different concentrations of NaCl,KCl,CaCl2,MgCl2and MgSO4solution respectively.The activation energy was obtained from Arrhenius equation.A gel strength model as a function of three variables-the concentration of calcium ion,temperature and enzyme dosage,was developed from the experimental of Box-Behnken center-united design.The results showed that adding salts(NaCl,KCl,CaCl2,MgCl2and MgSO4)could lower the activation energy of gelling reaction,but all Arrhenius curve could keep to be linear,which indicated that the gelling followed the samemechanism.According to the analysis of significance and response surfacemethod,the gel strengthmold showed a high fitting degree.The gel strength was affected by the dosage of papain significantly(P<0.05).The reciprocal effect of Ca2+concentration and temperature on the gel strength was significant(P<0.01).The simultaneous increase or decease in both temperature and Ca2+concentration would weaken the gel strength.
soybean proteins isolate,enzymatic-induced gelation,papain,activation energy,inorganic salt,gel strength
TS201.7
A
1003-0174(2015)06-0015-07
中日合作项目 Advanced application of local food resources in China(K332021107),联合国大学项目UNU-Kirin Follow-up Research Programme(UNUISP-0053)
2014-01-11
笪久香,女,1986年出生,硕士,粮食、油脂与植物蛋白工程
栾广忠,男,1968年出生,副教授,植物蛋白深加工

