分子信标荧光定量PCR检测H3N2亚型猪流感病毒方法的建立
禹思宇,周 宇,唐连飞,孟 芳,袁晓芬,梁 斌
(1.湖南出入境检验检疫局检验检疫技术中心,湖南长沙 410004;2.惠州出入境检验检疫局,广东惠州 516006)
分子信标荧光定量PCR检测H3N2亚型猪流感病毒方法的建立
禹思宇1,周 宇2,唐连飞1,孟 芳1,袁晓芬1,梁 斌1
(1.湖南出入境检验检疫局检验检疫技术中心,湖南长沙 410004;2.惠州出入境检验检疫局,广东惠州 516006)
利用新型荧光探针—分子信标,建立一种检测猪流感病毒的新方法。根据H3N2亚型猪流感病毒(SIV)的HA和NA基因的保守基因序列,分别设计并合成了特异性引物和分子信标探针,利用实时荧光定量PCR技术检测H3N2亚型SIV。构建重组质粒pSK-H3和pSK-N2并绘制标准曲线。结果显示,该检测方法的敏感性达到102拷贝/μL;与其它主要相关病毒均不发生交叉反应,批内和批间试验的重复性变异系数(CV)均小于3%,表明该方法灵敏度强、特异性好。此方法的建立将为流感病毒H3N2亚型定型检测提供一种快速有效的方法。
猪流感病毒;H3N2亚型;分子信标探针;实时荧光定量PCR
猪流感病毒(swine infl uenza virus,SIV)是猪群中一种可引起急性高度接触传染性呼吸道疾病的A型流感病毒[1]。目前已经发现流感病毒的HA有16个亚型,NA有9个亚型,已从猪体内分离到H1N1、H1N2、H1N7、H3N2、H2N3、H3N1、H3N6、H4N6、H5N1、H5N2和H9N2 等11种不同亚型的SIV[2]。我国猪群中主要以H3N2和H1N1亚型的流行和危害比较严重[3]。猪是人流感病毒、禽流感病毒和猪流感病毒的共同宿主,流感病毒可能在猪体内发生基因重组或重配,产生新的病毒株,造成新的流行;猪在流感病毒的病原学、生态学及流行病学中占有重要地位,对猪流感的快速诊断必将成为预测和防止流感大暴发的重要手段。
要实现对H3N2流感的快速诊断,最快捷可行的方式是检测病毒核酸,目前使用最多的是荧光定量PCR方法。本试验使用的分子信标探针,不同于一般的探针。分子信标是设计最为巧妙的一种新型荧光分子探针,具有高选择性、高灵敏度和背景干扰低等优越性[4-6],在检测快速变异的病毒时非常有优势,在病毒分型时也是功能强大的工具。不同亚型的猪流感病毒,致病性差异很大,使用传统方法或不能快速、准确的检测出疫病,或无法对病毒进行分型。本实验结合分子信标技术建立猪H3N2流感的荧光定量PCR方法,对流感病毒进行快速检测并分型。采用该技术,即使出现新的变异毒株,通过改变分子信标探针,即可对新的流感毒株进行识别,具有广阔的应用前景。
1 材料与方法
1.1 毒株与核酸样品
H3N2型猪流感病毒标准株由中国农业科学院哈尔滨兽医研究所保存;H1、H5、H9亚型猪流感病毒、猪圆环病毒II型(PCV2)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪繁殖与呼吸综合症病毒(PRRSV)核酸由本实验室保存。
1.2 主要试剂
荧光定量试剂盒、RNA抽提试剂盒,购自Promega公司;pMD18-T、反转录用M-MLV、感受态细胞JM109试剂盒、质粒提取试剂盒和胶回收试剂盒,购自大连宝生物工程有限公司;RNA抽提Trizol试剂,购自Invitrogen公司;HiScribe T7体外转录试剂盒,购自NEB公司;商品化H3N2猪流感荧光PCR检测试剂盒,购自圣湘生物。
1.3 引物和探针的设计与合成
根据GenBank数据库中下载的H3N2亚型SIV的HA、NA基因核苷酸序列,利用DNA Star软件进行同源性分析比较,选出高度保守且特异的核苷酸区域,用软件Beacon Designer 7设计2对特异性引物H3F、H3R、N2F、N2R和2个特异分子信标探针H3P、N2P,引物和探针由上海闪晶生物技术公司合成,探针5'端标记的荧光报告基团是FAM和HEX,3'端标记的荧光淬灭基团为4(二甲基对胺基偶氮苯)苯甲酸(DABCYL),具体见表1。
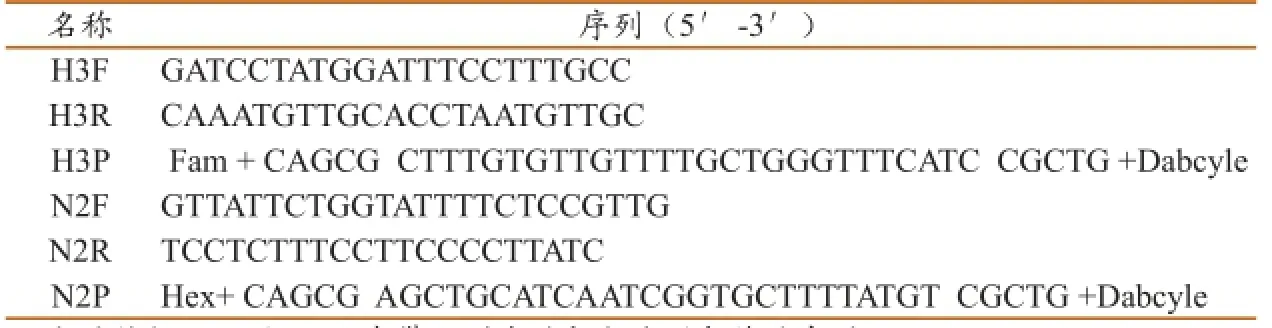
表1 引物和探针序列
1.4 质粒标准阳性模板的制备
按照RNA提取试剂盒说明书提取H3N2 SIV的RNA,利用反转录试剂盒合成cDNA用于试验,将扩增后H3N2的HA基因和NA基因分别克隆至pBlueScriptSK(-)构建重组质粒。提取质粒进行PCR鉴定和序列测定。将正确的质粒分别命名为pSK-H3和pSK-N2。
1.5 标准曲线的绘制和敏感性试验
在260 nm与280 nm波长下测定质粒的含量,并根据公式计算每微升液体中质粒的拷贝数。以重组质粒为模板,按照T7体外转录试剂盒说明书转录合成RNA。反转录后用无菌水10倍系列稀释(109拷贝/μL~l02拷贝/μL)后根据优化的最佳反应条件进行标准曲线绘制和敏感性试验。
1.6 特异性及重复性试验
将H3N2与H1、H5、H9 亚型SIV、PCV2、CSFV、PEDV、TGEV、PRRSV进行特异性试验,以确定该方法的特异性。取4个浓度的样品(108拷贝/μL、107拷贝/μL、106拷贝/μL、105拷贝/μL)作为模板进行重复性试验,每个浓度设4个重复,分成3个批次(A、B、C),进行批内和批间重复性试验。
1.7 临床样品的检测
对本实验室所保存疑似猪流感101份样品,利用建立的荧光定量PCR方法进行检测。
2 结果与分析
2.1 含H3HA 及N2NA基因的重组质粒的构建
H3N2 RNA反转录的cDNA为模板,利用引物经PCR扩增H3N2的HA和NA基因目的片段。结果显示扩增的目的片段分别约100bp和80bp,大小与预期相符。将其克隆于pBlueScriptSK(-)中构建重组质粒pSK-H3和pSK-N2,电泳结果与预期结果一致(图1)。并以EcoR I将该重组质粒线性化,通过体外转录试剂盒经T7 RNA聚合酶制备HA和NA基因片段的RNA转录产物,用于荧光定量PCR标准曲线的建立。

图1 H3HA和N2NA基因的PCR 扩增
2.2 荧光定量PCR反应体系和条件的确定
荧光定量PCR反应体系为25μL,其中2x qPCR buffer 12.5μL,上下游引物(10pmol/μL)各0.5μL,探针(10pmol/μL)1μL,cDNA 1μL,DEPC水补足25μL。将该体系瞬时离心后,按下列反应参数进行:95 ℃ 3 min;95 ℃ 20 s、60 ℃ 15 s、72 ℃ 15 s,扩增45个循环。扩增过程中收集荧光信号。
2.3 标准曲线及敏感性
将两种质粒标准品经T7体外转录及反转录后所得cDNA进行荧光定量PCR反应,扩增曲线见图2。从左到右的反应模板依次为1×109~1×102拷贝/μL,在浓度范围内有良好的线性关系,阴性对照无扩增反应。以起始模板的对数为x轴,Ct值为Y轴做回归曲线,即得到H3N2检测的两条标准曲线(图3)。斜率为-3.534(H3)、-3.349(N2),截距为46.04(H3)、41.26(N2),效率为1.918(H3)、1.989(N2),从而可以得出拷贝数与Ct值之间的线性关系表达式:Ct(H3)= -3.534×lg(拷贝数)+ 46.04和Ct(N2)= -3.349×lg(拷贝数)+ 41.26,而将待测样品的Ct值代入表达式就可以计算出它的初始拷贝数,也可直接从仪器上读取。敏感性试验显示最低检出量为102拷贝/μL。
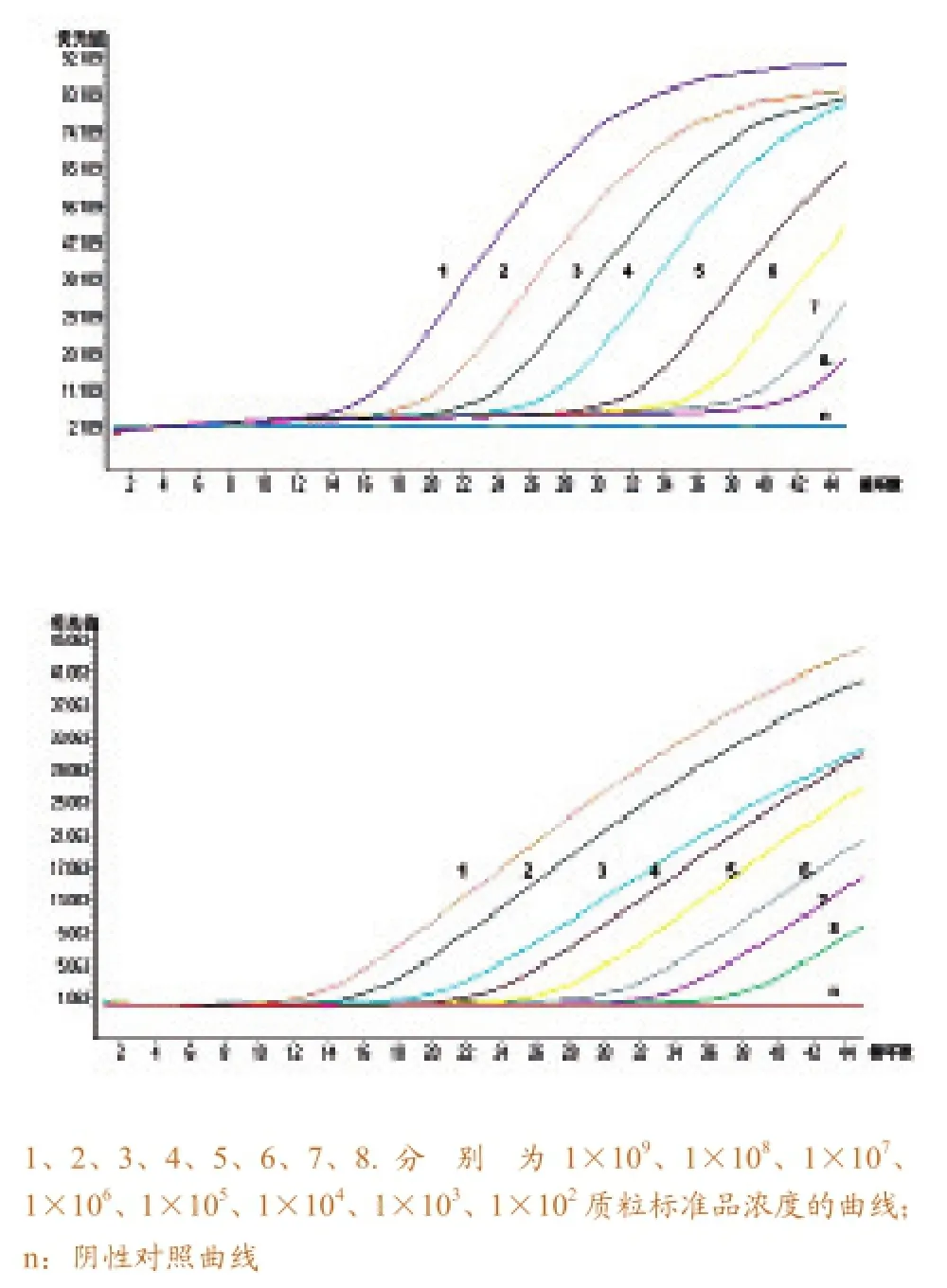
图2 荧光定量PCR 的动力学曲线
2.4 特异性、重复性试验
特异性:除H3N2亚型SIV外,H1、H5、H9亚型SIV与其他猪病病毒检测结果均为阴性(见图4)。表明建立的荧光定量PCR诊断方法特异性强。荧光定量PCR批内和批间重复试验结果见表2、3,批内重复试验变异系数(CV)为0.1%-0.35%,批间重复试验CV为0.39%-1.57%,两者CV值均在3%以下,表明该方法稳定,具有良好的重复性。

图3 荧光定量PCR 的标准曲线

图4 SIV H3(A)、N2(B)基因荧光定量PCR 检测的特异性试验结果
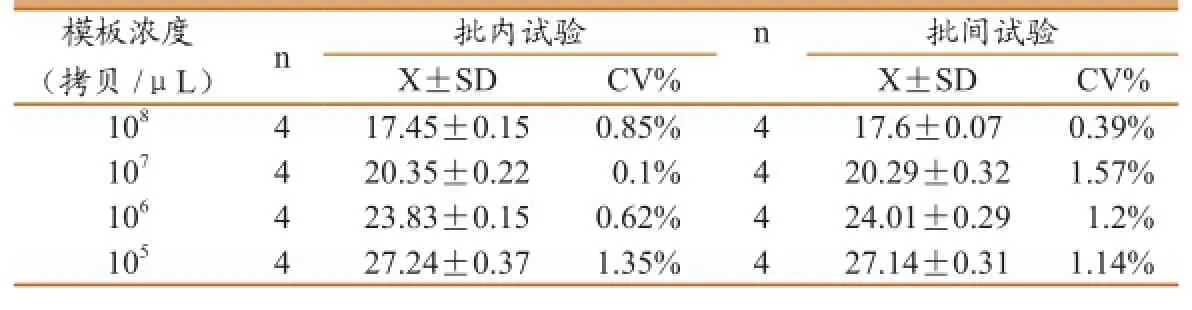
表2 SIV H3基因重复性试验结果

表3 SIV N2基因重复性试验结果
2.5 临床样品检测
对实验室所保存的101份猪流感疑似样品,用建立的荧光定量PCR方法和试剂盒方法(圣湘生物)进行检测,两者符合率为100%。
3 讨论
猪流感主要造成急性上呼吸道感染,临床症状为体温突然升高(40~45℃),猪流感有时还会出现流产。猪流感可继发细菌或病毒感染,严重时可导致呼吸衰竭[7]。此外,猪流感病毒也是猪免疫抑制的主要诱因之一,猪群感染猪流感病毒可引起猪繁殖能力减退,育肥猪增重减慢等[8]。猪流感不仅给养猪业造成重大经济损失,还对人类健康造成威胁,因此研究快速、敏感、准确的猪流感诊断产品,具有重要的经济价值和公共卫生意义。本试验结合ROCHE480 荧光定量检测系统,运用分子信标技术建立了一种新的SIV定量检测方法,通过测定SIV的核苷酸拷贝数,达到定量检测SIV的目的。
目前,分子信标技术已应用于SNPs分析、基因定量分析、疾病基因检测与诊断等生物领域,Bauerfeind等[9]利用分子信标技术对绵羊、山羊和牛的副结核分枝杆菌做了分子鉴定;John等通过分子信标检测猪病病原体,证明了该方法比常规PCR具有更高的敏感性。[10]分子信标作为一种新型荧光分子探针设计十分巧妙,探针的两末端分别标记荧光分子和淬灭分子,在目标物不存在时探针以茎环结构形式存在。探针的5'端和3'端自身可形成一种6个碱基左右的茎部结构,此时荧光分子和淬灭分子之间发生荧光共振能量传递(FRET),因此不会产生荧
光。在其环状部分,一般是一段长度为15~30碱基的序列,能与目标分子特异结合。当溶液中有特异性PCR发生时,探针与模板杂交,从而破坏了探针的FRET,于是便产生荧光,荧光强度与溶液中模板量成正比,因此可用于PCR定量分析[11];发夹结构保证了分子信标的高选择性,只有完全互补的单链DNA或RNA分子才能引起分子信标的发夹结构完全打开,从而发出荧光,因此它所具有的高选择性、高灵敏度的优越性;由于采用的非荧光染料作为淬灭分子,因此荧光本底比较低,有效的降低了背景干扰。
本文设计选择了2个分子信标探针,即H3-P(针对SIVHA基因)、N2-P(针对SIV NA基因)。在荧光定量PCR反应过程中以两种荧光通道信号分别追踪同一样品RNA的HA基因和NA基因的扩增动力学变化,实验结束即可确定其中病毒RNA的含量,又可以确定该病毒的亚型,检测过程方便、快捷。国内有过有关H3N2猪流感荧光PCR方法的报道,陈艳等[2]采用的是TaqMan MGB 探针法检测H3N2,TaqMan探针由于采用荧光和淬灭基团双末端标记,因此淬灭难以彻底,本底较高。报告基团的水解利用的是Taq酶的5'-3'外切活性,因此定量时容易受酶活性影响。探针标记成本较高,不便普及应用[12];孙忠晟[13]针对H3N2亚型流感病毒HA基因建立了SYBR Green I荧光RT-PCR检测方法,SYBR Green I 检测本身特异性差,不能分辨主带与杂带,给出的是总信号,所以在低样本浓度时,不能进行基因突变分析,且灵敏度低,适合于5 000拷贝以上的基因定量[14]。本实验结合分子信标技术建立猪H3N2流感的荧光定量PCR方法,定量不受酶的影响,高特异性,高灵敏度,一次实验即可确定病毒的亚型。
此外,以往建立的检测RNA病毒的荧光定量PCR方法,均使用含有目的基因的质粒,即DNA作为标准品;但该方法的缺陷是标准品与待检样品处理方式不同,导致最终的检测结果不能真实反映样品中病毒的拷贝数。本研究利用T7体外转录试剂盒,最大程度地降低试验误差,真实反映了所建立方法的敏感性[15]。本试验将分子信标应用于流感病毒的检测,凭借探针本身的高特异性和高灵敏度,建立了一种高效的H3N2猪流感的荧光定量PCR检测方法。在定性检测病毒的同时,还可以对病毒RNA 的含量进行测定。该方法灵敏度高,特异性强,结果稳定,操作方便快捷,可为猪流感H3N2亚型的检测提供有效手段。对存档的猪流感样品的检测结果和商品试剂盒的检测结果符合率为100%,说明所建技术有广阔的应用前景。
[1] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:333-334.
[2] 陈艳,张春明,乔传玲,等.H3N2 亚型猪流感病毒实时荧光定量PCR快速检测方法的建立[J] .中国兽医科学,2009,39(10):894-899.
[3] 李海燕,于康震,杨焕良,等.中国猪源H5N1和H9N2亚型流感病毒的分离鉴定[J] .中国预防兽医学报,2004,26(1):1-6.
[4] Fang X H,Li J J,Periette J,et al. Molecular beacons:novel fl uorescent probes[J].Anal Chem,2000,72(23):747A- 753A.
[5]Palladino S,Kay I,Fonte R. Use of real-time PCR and light cycler system for the rapid detection of pneumocystis carina in respiratory specimens[J].Diagn Microbiol Infect Dis,2001,39(4):233-236.
[6]Tyagi S,Kramer F R. Molecular beacons:probes that fl uoresce upon hybridization[J]. Nat Biotechnol,1996,14(3):303-308.
[7] World Organization for Animal Health (OIE). Manual of diagnostic tests and vaccines for terrestrial animals [DB] Paris;OIE;2008. Swine influenza.Available at:http∶//www. oie.int/eng/normes/ mmanual/2008 / df/2.08.08 _SWINE_ INFLUENZA. pdf. Accessed 7 Jan 2008.
[8] Choi Y K,Goyal S M,Joo H S.Prevalence of swine infl uenza virus subtypes on swine farms in the United States[J].Arch Virol,2002,147(6):1209-1220.
[9] Bauerfeind R,Benazzi S,Weiss R,et a1.Molecular characterization of Mycobacterium paratuberculosis isolates from sheep,goats,and cattle by hybridization with a DNA probe to insertion element IS900[J].Journal of Clinical Microbiology,1996,34(7):1617-1621.
[10] John M K ,Bemt H,Andrena M,et a1.Molecular beacon realtime PCR detection of swine viruses[J].Journal of Virological Methods,2007,140(1/2)155-165.[11]Li Q,Liang J,Luan G. Molecular beacon-based homogeneous fluorescence PCR assay for the diagnosis of infectious diseases[J].Analy Sci,2000,16(2):245-248.
[12]蔡霞.定量PCR技术及其应用现状[J].现代诊断与治疗,2005,16(2):112-115.
[13]孙忠晟,尹燕博,王平,等. SYBR GreenⅠ荧光定量PCR法检测猪流感H3N2亚型病毒方法的建立[J].中国兽医杂志,2012,48(4):7-9,97.
[14] Qzaki H,McLaughlin L W. The estimation of distances between specific backbone-labeled sites in DNA using fluorescence resonance energy transfer[J].Nucleic Acids Res,1992,20(19):5205-5214.
[15] 胡晓亮,姜骞,仇铮,等.口蹄疫病毒TaqMan荧光定量PCR检测方法的建立[J].中国预防兽医学报,2014,36(12):948-951.
(责任编辑:胡藕祥)
Establishment of a Molecular Beacon Real Time Fluorescent Quantitative PCR Assay for Detection of Swine Infl uenza Virus H3N2 Subtype
Yu Siyu1,Zhou Yu2,Tang Lianfei1,Meng Fang1,Yuan Xiaofen1,Liang Bin1
(1.Inspection Quarantine Technology Center of Hunan Entry-Exit Inspection Quarantine Bureau,Changsha,Hunan 410004;2.Huizhou Entry-Exit Inspection Quarantine Bureau,Huizhou,Guangdong 516006)
A new assay for the detection of swine influenza virus(SIV)was developed with a novel nucleic acid probe—molecular beacon. The specifi c primers and molecular beacon probes were designed according to the conserved region of H3 and N2 genes of swine infl uenza virus(SIV)H3N2 subtype. A real-time fl uorescent quantitative PCR assay was developed for detection of SIV H3N2 subtype. A series of dilutions of recombinant plasmids including pSK-H3 and pSK-N2 were prepared and used to generate standard curves. Under the optimized reaction conditions,the results showed that the developed assay was specifi c for detecting SIV with a detection limit of 102copies without cross-reactions to other swine viruses.The repeatability tests indicated that the inter-and intra-variation were less than 3%.The method was highly specifi c and sensitive,providing an effective method for detection of swine infl uenza virus H3N2 subtype.
swine infl uenza virus;H3N2 subtype;molecular beacon probe;real-time fl uorescent quantitative PCR
S 852.65+1
A
1005-944X(2015)07-0067-06
国家质检总局科技资助项目(2014IK243)
唐连飞

