猪霍乱沙门氏菌LAMP检测方法的建立与应用
时建立,彭 喆,郭立辉,李 俊,朱荣生,黄保华
(1.山东省农业科学院畜牧兽医研究所,山东济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东济南 250100)
猪霍乱沙门氏菌LAMP检测方法的建立与应用
时建立1,彭 喆1,郭立辉1,李 俊1,朱荣生1,黄保华2
(1.山东省农业科学院畜牧兽医研究所,山东济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东济南 250100)
利用猪霍乱沙门氏菌lacZ基因设计特异性引物,通过优化各种反应条件,建立了检测猪霍乱沙门氏菌的环介导等温扩增(LAMP)快速检测方法。此方法特异性好,灵敏度高,将细菌DNA稀释到10-8仍可检出,是PCR方法的1000倍。本研究建立的LAMP方法操作简便、灵敏度高、特异性强,为临床检测猪霍乱沙门氏菌和预防人猪霍乱沙门氏菌病提供了技术保障。
猪霍乱沙门氏菌;环介导等温扩增技术;快速诊断
沙门氏菌是一类对人和动物都有致病性的重要的革兰氏阴性肠杆菌科细菌,主要引起人和动物发热、胃肠炎、腹泻和败血症等临床症状,同时是一种常见的食源性致病菌,污染动物性食品感染人类,导致食物中毒,引起败血症等,甚至死亡[1-2],对人和动物危害严重。猪霍乱沙门氏菌是引起猪沙门氏菌病的主要血清型,主要感染断奶期仔猪,引发仔猪副伤寒,临床上以急性败血症、慢性坏死性肠炎、顽固性下痢等为特征,当并发或继发感染其它疾病或治疗不及时时,死亡率较高,给养猪业造成重大的经济损失,严重困扰着养猪业的健康发展。在我国,猪沙门氏菌感染率很高,在屠宰中往往污染猪肉,引起人沙门氏菌感染发病。因此临床中急需一种敏感快速并且廉价的猪霍乱沙门氏菌诊断方法。
传统检测猪霍乱沙门氏菌的方法有细菌培养、生化和血清学鉴定、免疫学检测等,如ELISA以及以PCR为基础的检测技术等,此类方法操作繁琐、费时费力、所需试剂繁多,经济成本高,并且有设备和技术要求,难以在基层推广普及[3,8]。
环介导等温扩增检测(LAMP)技术是2000年由Notomi等建立的一种新型核酸扩增技术,该技术可在等温条件下通过特异DNA聚合酶作用而实现对特定核苷酸序列的扩增,具有特异性强、灵敏度高、简便快速、成本低廉和结果可视化等优点,目前在一些病原微生物检测中被广泛应用[4,6-7]。本试验针对猪霍乱沙门氏菌β-半乳糖苷酶基因(lacZ基因),建立了LAMP快速检测方法,为临床检测猪霍乱沙门氏菌和预防人猪霍乱沙门氏菌病提供技术支撑。
1 材料与方法
1.1 材料
猪霍乱沙门氏菌和鼠伤寒沙门氏菌购自中国科学院微生物研究所(CGMCC,No. 1.1859和1.1190);金黄色葡萄球菌、副猪嗜血杆菌、大肠杆菌、巴氏杆菌、乳酸杆菌等由山东省畜禽疫病防治与繁育重点实验室保存和提供;检测用猪肉购自实验室周边超市和农贸市场;Bst DNA聚合酶、dNTP、DNA Marker DL-2000购自宝生物工程(大连)有限公司;其他试剂为进口或国产分析纯试剂。1.2 方法
1.2.1 DNA模板的制备
采用煮沸法制备靶DNA[9]:挑取猪霍乱沙门氏菌单菌落溶于100μL无菌水混匀后,于100℃水浴25 min裂解,冰浴5 min,然后4℃12 000 r/min离心5 min,取含DNA模板的上清液备用。
1.2.2 引物设计与合成
根据Genbank公布的猪霍乱沙门氏菌lacZ基因序列,利用网http∶//primerexplorer.jp/e/设计LAMP特异引物,包括外引物对(F3、B3)和内引物对(FIP、BIP)(表1)。引物由上海生工生物工程有限公司合成。

表1 扩增lacZ基因的LAMP引物序列
1.2.3 LAMP反应条件优化
LAMP基本反应体系为25μL,成分包括:内外引物、dNTPs、Betaine、Bst DNA 聚合酶、10×ThermoPol buffer 、DNA模板。反应温度在60~65 ℃,扩增60 min左右,80 ℃10 min终止反应,取扩增产物于1%琼脂糖凝胶中电泳,观察结果。也可在反应结束后在反应管中加入1μL SYBR GeenⅠ核酸染料,肉眼观察溶液颜色变化,也可在紫外下观察有无荧光。
以基本反应体系为基础,为确定最佳扩增条件,选择对LAMP扩增反应影响较大的几种因素如反应时间、反应温度、Betaine浓度和dNTPs浓度进行调整,对各组分进行优化。
1.2.4 LAMP方法灵敏度检测
取1 mL猪霍乱沙门氏菌液体培养物,用煮沸法制备DNA,以生理盐水10倍梯度稀释,分别作为模板进行LAMP扩增,并同时与检测沙门氏菌的国家标准(GB/T 28642-2012)进行比较。反应结束后在反应管中加入1μL SYBR GeenⅠ核酸染料,肉眼观察溶液颜色变化,也可在紫外下观察有无荧光。确定LAMP反应的灵敏度。
1.2.5 LAMP方法特异性检测
分别对鼠伤寒和猪霍乱沙门氏菌及金黄色葡萄球菌、副猪嗜血杆菌、大肠杆菌、巴氏杆菌、乳酸杆菌等进行LAMP扩增,检测LAMP引物的特异性。
1.2.6 LAMP方法临床样品检测
对实验室周边超市和农贸市场购买的猪肉样品无菌研磨处理后煮沸法提取DNA进行LAMP检测。对检测结果阴性样品用猪霍乱沙门氏菌进行人工感染后重新进行LAMP检测。
2 结果
2.1 LAMP条件的优化
猪霍乱沙门氏菌LAMP扩增阳性结果在凝胶电泳中呈梯状条带,无模板的阴性对照扩增无条带。优化结果显示:最佳反应温度为63 ℃(图1A);dNTPs浓度在0.4 mmol/L时扩增条带最亮;betaine浓度在1.2 mol/L时扩增条带最亮;扩增30 min
即出现稳定梯状条带,而扩增75 min出现最亮条带(图1D)。
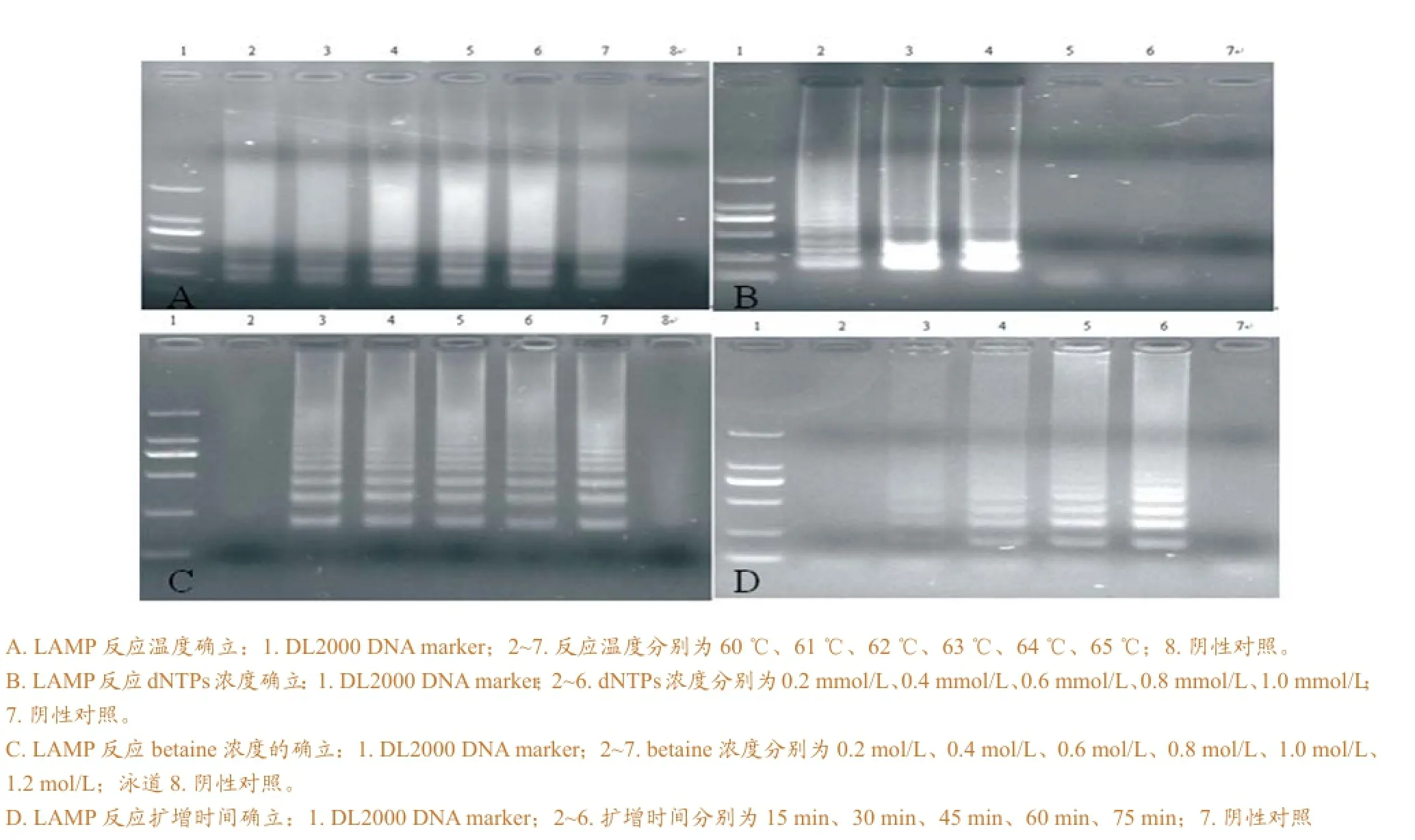
图1 优化LAMP反应条件时扩增产物1%琼脂糖凝胶电泳结果
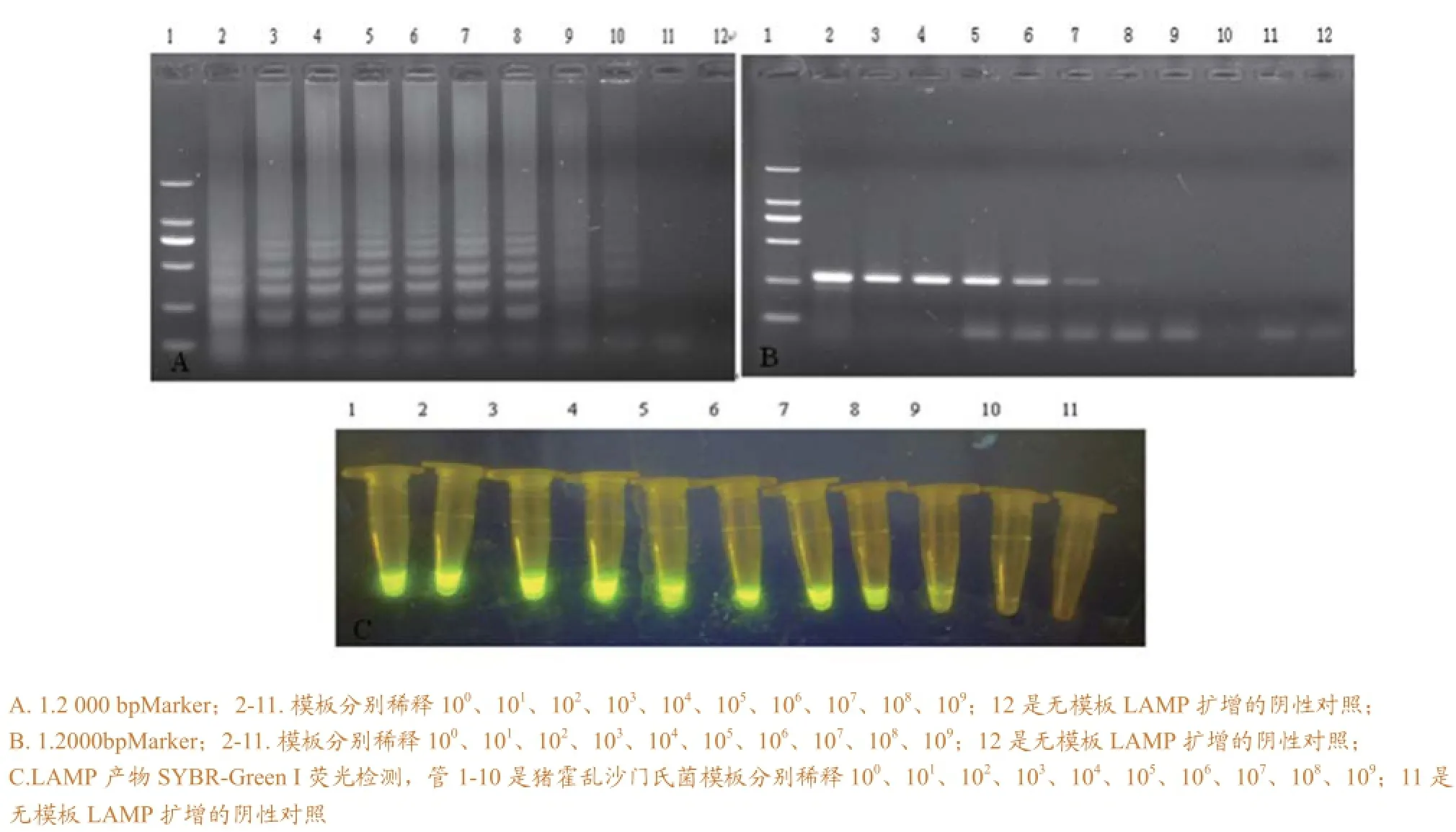
图2 LAMP反应灵敏度检测结果
最终优化后的LAMP反应体系为1μL DNA模板,1.5μL FIP 和BIP 引物,0.15μL F3和B3
引 物,4μL dNTPs(10μM),2.5μL 10×ThermoPol buffer,1μL Bst DNA polymerase,6μL Betaine,加入超纯水至25μL。各反应物在63°C水浴75 min,然后80 ℃ 5 min灭活终止反应。
2.2 LAMP反应的灵敏度
将猪霍乱沙门氏菌DNA 作10倍梯度稀释进行LAMP 反应,结果DNA稀释到108倍仍可检出(图2A)。扩增产物中分别加入SYBR GeenⅠ核酸染料,DNA稀释108倍扩增产物在紫外下可见荧光(图2C)。将各稀释的猪霍乱沙门氏菌DNA进行PCR检测,结果显示PCR法的检出限为DNA稀释到10-5(图2B)。
由上图可知:LAMP检测方法的最低检测量为10-8稀释,常规PCR检测方法的最低检测量为10-5稀释,LAMP方法的灵敏度是PCR方法的1 000倍。
2.3 LAMP特异性检测
对7种菌株用煮沸法提取DNA后进行LAMP反应,结果显示仅猪霍乱沙门氏菌出现特征性阶梯状扩增条带,而其他菌均未出现梯形条带(图3)。

图3 LAMP特异性检测结果
2.4 临床样品检测
从实验室周边超市和农贸市场购买的猪肉样品进行LAMP检测,结果显示只有个别样品能够检测出猪霍乱沙门氏菌。对检测结果阴性样品用猪霍乱沙门氏菌进行人工感染后重新进行LAMP检测,能够扩增出特异的梯形条带(图4)。
3 讨论

图4 部分临床样品检测结果
猪霍乱沙门氏菌宿主范围较窄,主要导致猪的副伤寒病,临床症状主要表现败血症和小肠结肠癌等,每年给全球的肉猪养殖业造成重要经济损失。偶尔感染人类,但是感染后,通常会造成比较严重的后果[5],不仅有肠炎等肠胃症状,而且在感染后两、三天内导致病人发烧休克乃至败血症、关节炎以及骨髓炎。病情发作急性而且非常严重,特别容易侵犯两岁以下儿童以及患有免疫缺损的人群,对人类健康造成巨大的威胁。
传统方法检测猪霍乱沙门氏菌不仅操作繁琐,且需要4~7天才能得出明确的诊断结果,灵敏度很低并且有设备和技术要求,难以在基层普及推广。本实验建立的LAMP检测方法只需在63 ℃条件下进行等温扩增75 min后,再在80 ℃条件下加热5 min让酶失活即可,并且LAMP扩增产物可以通过凝胶电泳或者加入荧光染料的方法观察结果。该技术在等温条件下即可进行核酸的变性和扩增,不需要特殊的仪器设备,仅在水浴锅中就可完成扩增反应,适合在食品厂、基层兽医站和养殖场等基层单位中进行快速检测和推广应用,方便快捷,成本低廉、特异性强,灵敏度是现行沙门氏菌国家标准PCR检测方法的1 000倍,对猪霍乱沙门氏菌的有效防控具有重要意义,同时在猪霍乱沙门氏菌的快速检测方面具有较好的应用前景。
参考文献:
[1] Hendriksen RS,Vieira AR,Karlsmose S,et al. Global monitoring of Salmonella serovar distribution from the world health organization global foodborne infections network country data bank:results of quality assured laboratories from 2001 to 2007[J]. Foodborne Pathog Dis,2011, 8:887-900.
[2] Humphrey TJ. Salmonella,stress responses and foodsafety[J]. Nat Rev Microbiol,2004,2:504–509.
[3] Zhang G,Brown EW,González-Escalona N Comparison of real-time PCR,reverse transcriptase real-time PCR,loopmediated isothermal amplification,and the FDA conventional microbiological method for the detection of Salmonella spp in produce[J]. Appl Environ Microbiol ,2011,77:495-501.
[4] Notomi T,Okayama H,Masubuchi H,et al. Loop-mediated isothermal amplifi cation of DNA[J]. Nucleic Acids Res,2000,28:E63.
[5]Chiu C H,Su L H. Salmonella enteriea serotype Choleraesuis:Epidemiology,Pathogenesis,Clinical Disease and Treatment[J]. Clin Microbiol Rev,2004,17(2):311-322.
[6] Zhou S, Han S, Shi J,et al. Loop-mediated isothermal amplifi cation for detection of porcine circovirus type 2[J]. Virol J,2011,8:497-502.
[7] Techathuvanan C,Draughon FA,D'Souza DH. Comparison of reverse transcriptase PCR,reverse transcriptase loopmediated isothermal amplifi cation,and culture-based assays for Salmonella detection from pork processing environments[J]. J Food Prot,2011,74:294-301.
[8] 杨娟,许美玲,许爱华,等. 畜产品中沙门氏菌检验方法的研究进展 [J]. 家禽科学,2011(2):51-53。
[9] 布坎南R E,吉本斯N E. 伯杰细菌鉴定手册8 版[M]//中国科学院微生物研究所翻译组译. 北京:科学出版社,2004:392- 442.
(责任编辑:胡藕祥)
Application of a Loop-mediated Isothermal Amplif cation Assay for Detection of Salmonella choleraesuis
Shi Jianli1,Peng Zhe1,Guo Lihui1,Li Jun1,Zhu Rongsheng1,Huang Baohua2
(1.Institute of Animal Science and Veterinary Medicine,Shandong Academy of Agricultural Sciences,Jinan,Shandong 250100;2.Shandong Key Laboratory of Animal Disease Control and Breeding,Jinan ,Shandong 250100)
Based on the specific primers designed according to the lacZ gene of Salmonella choleraesuis a loopmediated isothermal amplifi cation (LAMP) assay was developed for rapid detection of Salmonella choleraesuis. The result could be observed both with agarose gel electrophoresis and naked eyes. The LAMP assay was of high sensitivity and specificity,and could detect as low as 10-8dilutions. The study provided a very simple and efficient detection method for the clinical diagnosis of Salmonella choleraesuis in food,suitable for rapid detection in laboratories under general conditions.
Salmonella choleraesuis;loop-mediated isothermal amplifi cation assay;rapid detection
S852.61+2
B
1005-944X(2015)08-0068-05
山东省现代农业产业技术体系疫病控制岗位(SDAIT-06-021-07);山东省农业重大应用技术创新课题
黄保华

