不同锂源对富锂锰基Li1.133Mn0.466Ni0.2Co0.2O2正极材料性能的影响
林赞锐,沈家东,沈楷翔,马少蒙,侯贤华,3*
(1.华南师范大学物理与电信工程学院,广东省量子调控工程与材料重点实验室,广州510006;2.广东省高效绿色能源与环保材料工程技术研究中心,广州510006;3.电化学储能材料与技术教育部工程研究中心,广州510006)
锂离子电池已成为规模化电化学储能和车用动力电池的首选,其能量密度及各种电化学性能主要取决于正极和负极材料的嵌/脱锂特性[1]. 目前商业化的石墨负极材料已接近理论质量比容量372 mAh/g,在整体电池中的成本约占10%;商业化的LiCoO2(LCO,高钴近层状结构)、三元(NCA,MNC,中钴近层状结构)、LiFePO4(LFP,橄榄石结构)以及LiMn2O4(LMO,尖晶石结构)等正极材料的实际质量比容量都小于160 mAh/g,且在整体电池中的成本高达40%[2-3],正极材料已经成为制约锂离子电池发展的瓶颈. 因此,高性能正极材料开发及产业化刻不容缓,探索低成本、高容量、高倍率等特性的正极材料体系成为全球亟需解决的科学问题[4].
锂离子电池正极材料有钴酸锂(LiCoO2)、镍酸锂(LiNiO2)、锰酸锂(LiMnO2)、尖晶石锰酸锂(LiMn2O4)、镍钴酸锂(LiNi1-xCoxO2)、镍钴锰酸锂(LiNi1-xCoxMnyO2)和磷酸亚铁锂(LiFePO4)等[5].其中,LiCoO2成本高,Co2+有毒,且在过充时,因为材料的结构不稳定会导致性能下降[6];LiNiO2的合成较为困难,原子有序度低,可逆性差[7];LiMnO2在高温下的热稳定性差[8];尖晶石LiMn2O4在循环过程中会发生相转变而导致容量损失[9];二元材料LiNi1-xCoxO2和三元材料LiNi1-xCoxMnyO2虽然综合了几种材料的优点,但其质量比容量均难以达到200 mAh/g[10],不能满足电动汽车高比能量(300 Wh/kg)的要求.
本文利用不同锂源合成了2 种富锂锰基Li1.133Mn0.466Ni0.2Co0.2O2(LMNCO)正极材料,并对其电化学性能进行改性研究,该方法简单易行且合成出了球形电极材料,与传统正极材料相比,该材料具有更高的质量比容量和良好的倍率性能.
1 材料与方法
1.1 电极材料的制备
采用共沉淀的方法[11]制备前驱体,分别与不同锂源(Li2CO3、LiOH)混合煅烧得到富锂锰基正极材料,具体方法为:按物质的量之比为0.466∶0.2∶0.2称取Mn(AC)2·4H2O、Co(AC)2·4H2O、Ni(AC)2·4H2O 溶于去离子水中,配制200 mL 1 mol/L 各种醋酸盐溶液和240 mL 1 mol/L 的Na2CO3溶液.将Na2CO3溶液与醋酸盐溶液混合,并不断搅拌,同时加入600 mL 0.5 mol/L 的NH4HCO3溶液,继续搅拌;用NH4OH 调节pH 值在7.5 ~8.0 之间,在800 r/min 的转速下离心4 h 后,将沉淀过滤,用去离子水洗涤后将沉淀物在60 ℃下真空干燥8 h,获得前驱体[Mn0.466Ni0.2Co0.2]CO3;将前驱体平均分成2 份,分别与不同锂源(Li2CO3和LiOH)以n(前驱体)∶n(锂源)=100∶95 混合并研磨均匀,置于500℃下预热5 h;然后在900 ℃下焙烧12 h. 分别得到不同锂源的Li1.133Mn0.466Ni0.2Co0.2O2富锂锰基正极材料.
1.2 材料表征与电化学测试
采用德国PANalytical X'pert PRO X 射线衍射仪(管压40 kV,管流40 mA,步宽为0.02°,扫描速度为5°/min)对样品进行物相分析. 采用日本JEOLJSM-6510 场发射扫描电子显微镜,观察形貌和颗粒大小分布. 采用武汉LAND 电池测试系统CT2001A9(电压范围为0.01 ~2.00 V,电流密度为100 mA/g)上测试充放电循环性能,在Solartron 1470E 型多通道电化学系统上进行循环伏安测试(电压的范围为0.01 ~2.00 V,扫描速率为0.1 mV/s).
将合成的正极材料、导电炭黑(北京,电池级)和聚偏氟乙烯(日本,电池级)按质量比8∶1∶1 混合,加入溶剂N-甲基-2-吡咯烷酮(成都,分析纯)调成浆料,均匀涂覆在20 μm 厚的铝箔(深圳,电池级)表面,在120 ℃下真空干燥12 h,裁切成直径18 mm 的圆形正极片(约含6 mg 活性物质). 以金属锂片(北京,99.9%)为对电极,Celgard 2300 膜(美国)为隔膜,1 mol/L LiPF6/EC +DEC +EMC (体积比1∶1∶1,张家港,电池级)为电解液,在布劳恩惰性气体手套箱(上海)中组装CR2430 型扣式电池.
2 结果与讨论
2.1 物相组成和形貌分析
对不同锂源制备的Li1.133Mn0.466Ni0.2Co0.2O2正极材料进行X 射线衍射(XRD)表征(图1). 除了20° ~25°的超晶结构衍射峰外,其他衍射峰都表明材料具有标准的α-NaFeO2型层状岩盐结构,属R-3m 空间群,对应于六方晶系[12]. 2个主峰(003)和(104)分别出现在18.6°与44.6°左右,未出现其他杂峰,且(006)/(102)和(108)/(110)这2 组峰的分裂明显,说明样品具有较好的层状结构,结晶良好,晶形完美[13]. 在20°~25°处微小的衍射峰,是Li、Ni、Co和Mn 在3a 位置的超晶格排序引起的,属C2/m 空间群,表明材料中含有单斜晶系的层状Li2MnO3相. 因此,不同锂源合成的Li1.133Mn0.466Ni0.2Co0.2O2正极材料均具有较好的层状结构,并且是晶型完整的分层结构[14].
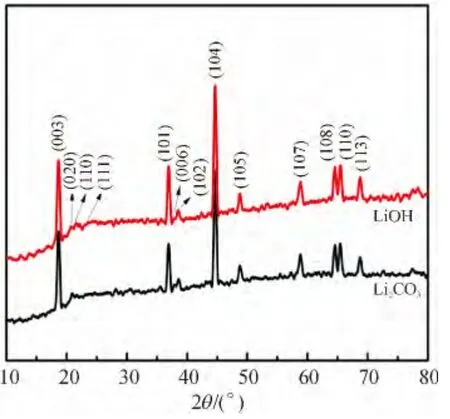
图1 不同锂源的Li1.133Mn0.466Ni0.2Co0.2O2 正极材料XRD 谱Figure 1 XRD patterns of Li1.133 Mn0.466 Ni0.2 Co0.2 O2 cathode material with different lithium sources
图2 表明,Li2CO3锂源样品颗粒细小,类似于球体,分布较不均匀,颗粒的直径小于2 μm,有部分团聚现象. LiOH 锂源样品颗粒,但是分布均匀,少有团聚现象,颗粒直径小于2 μm. LiOH 锂源样品颗粒相对均匀,结晶度相对较好[15].
2.2 充放电循环分析
图3A 为制备的Li1.133Mn0.466Ni0.2Co0.2O2正极材料的在0.1C 倍率下前50 周充放电循环曲线对比图,充放电平台在2.0 ~4.8 V 之间. Li2CO3锂源样品首次充电质量比容量、放电质量比容量分别为333.6 mAh/g 和205.0 mAh/g,库伦效率为61.48%.而LiOH 锂源样品首次充、放电比容量分别为330.1 mAh/g 和218.6 mAh/g,库伦效率为66.23%,LiOH锂源样品的首次放电比容量和库仑效率均比Li2CO3锂源样品的高.

图2 Li2CO3(A)及LiOH(B)锂源制备Li1.133 Mn0.466 Ni0.2 Co0.2O2 材料的SEM 图Figure 2 SEM images of Li1.133 Mn0.466 Ni0.2 Co0.2 O2 Materials with different lithium sources of Li2CO3 (A)and LiOH (B)
图3B 为不同锂源的Li1.133Mn0.466Ni0.2Co0.2O2正极材料在不同倍率0.1C、0.2C、0.5C、1C、2C(1C=250 mA/g)下的充放电倍率性能. 结果表明,随着电流密度的增加,不同锂源的2 种样品的充放电比容量逐渐下降. 主要原因是在高倍率下,样品材料在高能量的电流下产生更高的极化,从而导致比容量下降[16]. Li2CO3锂源样品在不同倍率下的放电比容量分别为200.2、187.1、142.9、124.2 和98.3 mAh/g. 而LiOH 锂源样品的放电比容量分别为226.2、201.7、161.1、124.0 和58.7 mAh/g.
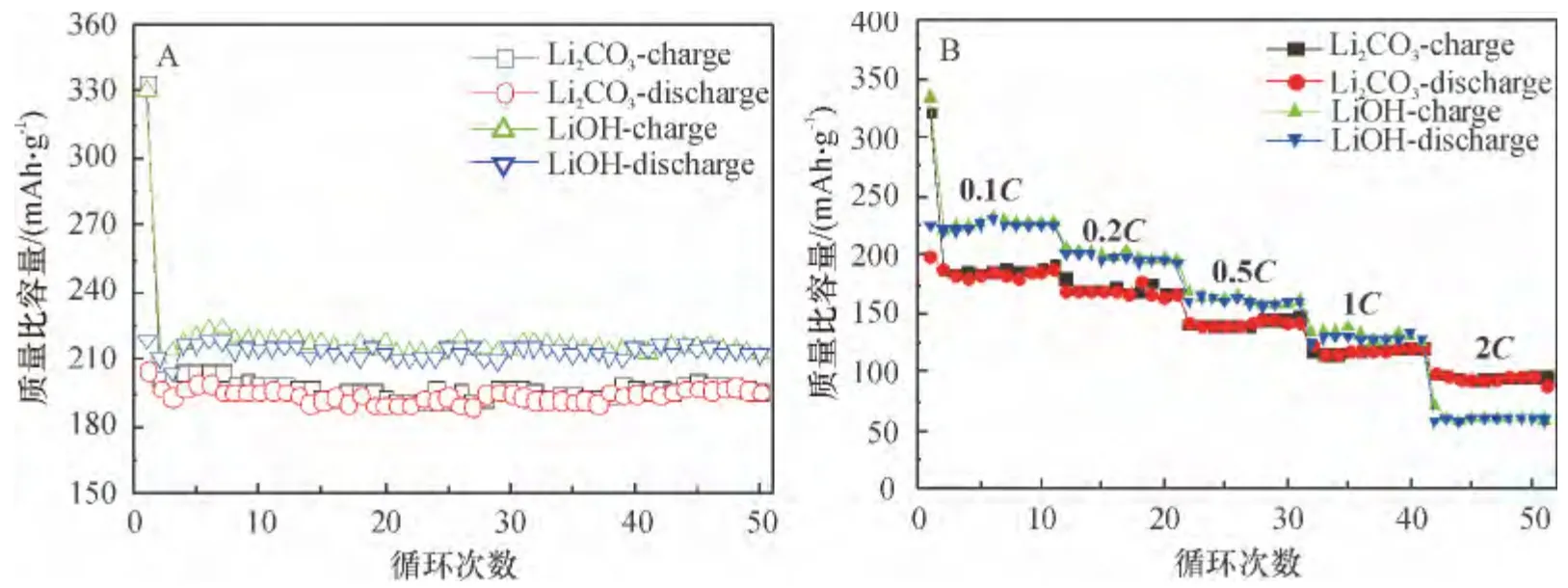
图3 不同锂源的Li1.133Mn0.466Ni0.2Co0.2O2 正极材料在0.1C 倍率下循环性能(A)及倍率性能(B)Figure 3 Cycling performance(0.1C)(A)and rate capability (B)of Li1.133Mn0.466Ni0.2Co0.2O2 cathode material with different lithium sources
在0.1C、0.2C、0.5C、1C 倍率下,两者放电比容量相比,LiOH 锂源样品比Li2CO3锂源样品高,最高差额达24 mAh/g. 但在2C 倍率下,LiOH 锂源样品放电比容量直线下降,比Li2CO3锂源样品降低39.6 mAh/g. 这说明,在不同倍率下,LiOH 锂源样品的循环性能比Li2CO3锂源样品更加优异. 在2C 倍率下,LiOH 锂源样品相比Li2CO3锂源样品容量衰减较大. 因此,Li2CO3锂源样品电化学性能比LiOH锂源样品稳定,但其综合电化学性能不及LiOH 锂源样品.
2.3 材料的循环伏安分析
不同锂源的Li1.133Mn0.466Ni0.2Co0.2O2正极材料在扫描速率为0.1 mA/s,测试电压在2.5 ~4.8 V范围前3 次的循环伏安曲线(图4)表明,在第一次循环时,不同锂源样品的充电平台都有2个明显的氧化峰. Li2CO3锂源样品的氧化峰分别在4.10 V和4.55 V. 在4.10 V 氧化峰的形成与LiMO2(M =Mn、Ni、Co 等.)结构中Li+的脱出有关[17],同时伴随着Ni2+和Co3+分别氧化为Ni4+和Co4+. 另一个在4.55 V 的氧化峰与Li2MnO3的活化反应(Li2O在Li2MnO3晶体中逐渐脱出)有关,但随着循环次数的增加,其峰值大小会逐渐减小. 这主要是因为Li2MnO3的活化以及氧原子的减少引起的. LiOH锂源样品的氧化峰分别为4.15 V 和4.71 V. 前者对应Ni 和Co 的氧化,后者与Li2MnO3的活化反应相关.

图4 Li2CO3(A)和LiOH(B)锂源Li1.133Mn0.466Ni0.2Co0.2O2 正极材料的循环伏安曲线Figure 4 Cyclic voltammetry curves of Li1.133 Mn0.466 Ni0.2 Co0.2 O2 cathode materials with different lithium sources of Li2CO3(A)and LiOH (B)
Li2CO3锂源样品在和LiOH 锂源样品分别在3.78 V 和3.74 V 出现强还原峰,这是由Ni2+和Co3+减少产生的. Li2CO3锂源样品的还原峰在3 次循环中相比LiOH 锂源样品的重叠性较好. 这表明,Li2CO3锂源样品的循环可逆性更加优良[18]. 并且,其阴极峰和阳极峰电位差仅0.32 V,比LiOH 锂源样品的峰电位差(0.41 V)小,这可以理解为Li2CO3锂源样品在电化学反应中更能减少极化反应[19].总之,Li2CO3锂源样品在电化学反应中的稳定性好于LiOH 锂源样品.
3 结论
采用共沉淀的法制备了以Li2CO3和LiOH 为锂源的富锂锰基Li1.133Mn0.466Ni0.2Co0.2O2正极材料,对比研究了不同锂源正极材料的电化学性能. 以Li2CO3锂源合成的样品,颗粒细小,呈现类球体形状,部分团聚较明显,分布不均匀,稳定循环比容量较高,2C 倍率下充放电测试均呈现较好的倍率特性. LiOH 锂源合成的样品颗粒细小,呈现类球体形状,颗粒分布均匀,少有团聚现象,相对比较均匀,结晶度相对较好. 稳定循环比容量优于Li2CO3锂源样品,小于1C 倍率的性能优于Li2CO3锂源样品,但在大倍率充放电条件下衰减加剧.
[1]Li X B,Xu M Q,Chen Y J,et al. Surface study of electrodes after long-term cycling in Li1.2Ni0.15Mn0.55Co0.1O2-graphite lithium-ion cells[J]. Journal of Power Sources,2014,248:1077-1084.
[2]储艳秋.锂离子电池薄膜电极材料的制备及其电化学性质研究[D]. 上海:复旦大学,2003.
[3]Kim J G,Son B,Mukherjee S,et al. A review of lithium and non-lithium based solid state batteries[J].Journal of Power Sources,2015,282:299-322.
[4]Zhang Y,Ye K,Cheng K,et al. Three-dimensional lamination-like P2-Na2/3Ni1/3Mn2/3O2assembled with two-dimensional ultrathin nanosheets as the cathode material of an aqueous capacitor battery[J]. Electrochimica Acta,2014,148:195-202.
[5]徐玲荣,孙建红,叶琴.锂离子电池正极材料的研究与应用现状探究[J]. 化学工程与装备,2012(1):105-107.Xu L R,Sun J H,Ye Q. Research and application status of lithium ion battery cathode material to explore[J].Journal of Chemical Engineering and Equipment. 2012(1):105-106.
[6]Hou X H,Huang Y L,Ma S M,et al. Facile hydrothermal method synthesis of coralline-like Li1.2Mn0.54Ni0.13Co0.13O2hierarchical architectures as superior cathode materials for lithium-ion batteries[J]. Materials Research Bulletin,2015,63:256-264.
[7]黄果,杨顺毅,雷钢铁,等. Li(1+x)Ni0.166Co0.166Mn0.667O(2.175十2)正极材料的喷雾干燥法合成及电化学性能[J].中国有色金属学报,2014,24(3):725-732.Huang G,Yang S Y,Lei G T,et al. Li(1+x)Ni0.166Co0.166Mn0.667O(2.175十2)the spray drying method of synthesis and electrochemical properties of the cathode material[J].Chinese Journal of Nonferrous Metals,2014,24(3):725-732.
[8]Hou X H,Zou X L,Huang Y L,et al. Surfactant CTABassisted synthesis of Li1.13[Ni0.233Mn0.534Co0.233]0.87O2with festoon-like hierarchical architectures as cathode materials for Li-ion batteries with outstanding performance[J].RSC Advances,2014,4 (56):29534-29541.
[9]Zhao C H,Shen Q. Organic acid assisted solid-state synthesis of Li1.2Ni0.16Co0.08Mn0.56O2nanoparticles as lithium ion battery cathodes[J]. Current Applied Physics,2014,14(12):1849-1853.
[10]Muhammad S,Lee S,Kim H,et al. Deciphering the thermal behavior of lithium rich cathode material by in situ X-ray diffraction technique[J]. Journal of Power Sources,2015,285:56-160.
[11]Jan G,Jay H S,Sun H K,et al. Thermal stability of lithium-rich manganese-based cathode[J]. Solid State Ionics,2014,268:242-246.
[12]Yang F,Zhang Q G,Hu X H,et al. Synthesis of layered xLi2MnO3·(1- x)LiMnO2nanoplates and its electrochemical performance as Li-rich cathode materials for Liion battery[J]. Electrochimica Acta,2015,165:182-190.
[13]Zhang J W,Guo X,Yao S M,et al. Tailored synthesis of Ni0.25Mn0.75CO3spherical precursors for high capacity Li-rich cathode materials via a urea-based precipitation method[J].Journal of Power Sources,2013,238:245-250.
[14]Yang X K,Wang X Y,Zou G S,et al. Spherical lithium-rich layered Li1.13[Mn0.534Ni0.233Co0.233]0.87O2with concentration-gradient outer layer as high-performance cathodes for lithium ion batteries[J]. Journal of Power Sources,2013,232:338-347.
[15]Lee J W,Huang D S. Application of thermodynamic activity models to the equilibrium potential for lithium intercalation process of a cobalt-free cathode material with a layered structure[J]. Computational Materials Science,2015,100:80-83.
[16]Wang J,Qiu B,Cao H L,et al. Electrochemical properties of 0. 6Li[Li1/3Mn2/3]O2-0. 4LiNixMnyCo1-x-yO2cathode materials for lithium-ion batteries[J]. Journal of Power Sources,2012,218:128-133.
[17]Zhao C H,Shen Q. Organic acid assisted solid-state synthesis of Li1.2Ni0.16Co0.08Mn0.56O2nanoparticles as lithium ion battery cathodes[J]. Current Applied Physics,2014,14(12):1849-1853.
[18]Zheng J M,Wu X B,Yang Y. A comparison of preparation method on the electrochemical performance of cathode material Li[Li0.2Mn0.54Ni0.13Co0.13]O2for lithium ion battery[J]. Electrochimica Acta,2011,56(8):3071-3078.
[19]Sun H H,Choi W H,Lee J K,et al. Control of electrochemical properties of nickel-rich layered cathode materials for lithium ion batteries by variation of the manganese to cobalt ratio[J]. Journal of Power Sources,2015,275:877-883.

