胸水和血清中的腺苷脱氨酶、乳酸脱氢酶水平及其比值在结核性胸膜炎诊断中的价值
武 栋,叶迎宾,黄秀香,张 萍,柳晓金,郑立恒
(1.河北省张家口市传染病医院呼吸科,河北张家口 075000;2.河北省邯郸市传染病医院,河北邯郸 056002;3.河北省石家庄市第五医院检验科,河北石家庄 050024;4.河北省胸科医院检验科,河北石家庄 050000)
近年来,全球结核病呈上升趋势,约1/3人口感染了结核分枝杆菌(MTB)[1],占个器官结核病总数的80%~90%。结核性胸膜炎是由于结核分枝杆菌(MTB)及其代谢产物进入胸膜腔而机体正处于超敏状态,引起大量炎性细胞、蛋白质及纤维素渗出的炎性疾病[2]。结核引起胸腔积液最常见,结核性胸腔积液是仅次于淋巴结结核分枝杆菌的第二大结核病肺外表现[3]。当前临床上对结核性胸膜炎的诊断通常以胸水涂片或培养找结核杆菌为标准,但是胸水涂片阳检率低,而胸水培养耗时长,易错过最佳的治疗时机。为了提高腺苷脱氨酶(ADA)、总蛋白(TP)和乳酸脱氢酶(LDH)及其比值对结核性胸膜炎的诊断价值,现对结核性胸腔积液患者和肝性胸水患者同步检测血清和胸水的ADA、TP和LDH,并计算三者在胸水和血清的比值,现将报道总结如下。
1 材料与方法
1.1 研究对象及分组
1.1.1 结核组 随机抽取2014年上半年本院收治的结核性胸膜炎患者50例(结核组),均符合结核性胸膜炎的诊断标准:(1)确诊标准:胸水找到、培养出抗酸杆菌或胸膜活检发现典型结核病理改变。(2)临床诊断标准参照文献[4-5]:①年龄小于45岁;②有典型的结核中毒症状;③胸水白细胞分类以淋巴细胞为主;④胸水蛋白/血清蛋白大于0.5;⑤胸水ATA阳性;⑥胸水ADA大于45 U·L-1。以上6项符合3项以上排除其他原因引起的胸腔积液,诊断性抗结核治疗有效。在结核性胸膜炎患者中,男31例,年龄15~76岁,平均31.5岁。女19例,年龄13 ~45 岁,平均26.1 岁。性别比例1.63∶1。
1.1.2 对照组 肝性胸水(对照组)20例,均符合下列诊断标准[6]:(1)肝硬化失代偿期的诊断成立;(2)均有不同程度的咳嗽、胸闷、气促等,并经X线,超声波或CT检查和胸腔穿刺证实有胸腔积液;(3)排除心、肺、肾及其它疾病所致的胸水。在肝性胸水患者中,男11例,年龄25~61岁,平均36.7岁。女9例,年龄36~64岁,平均47.5岁。男女比例 2.22∶1。
1.2 仪器和试剂 Roche cobas c501全自动生化分析仪检测胸水和血清中的TP、LDH和ADA,均为罗氏原装试剂。ADA和LDH采用速率法,TP采用双缩脲(两点终点)法进行检测,严格按照说明书操作。血清中的LDH参考值<245 U·L-1,TP参考值60~80 g·L-1;ADA参考值<20 U·L-1。
1.3 样本的采集 静脉采血2 mL和待检胸水3 mL分别注入普通的试管中,经离心后分离出血清和上清液,在2 h内完成TP、LDH和ADA的检测。保证室内质控在控。
1.4 统计学方法 应用SPSS 19.0软件对测量数据进行统计分析。检测数据用均数±标准差表示。两组间比较:计量资料采用t检验,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。此外,绘制受试者工作特征曲线(ROC曲线)计算临界值、敏感度、特异度、准确度和AUC。
2 结果
2.1 结核组和对照组的胸水和血清中的ADA、TP和LDH的检测结果 结核组中胸水和血清中ADA、TP、LDH含量及其比值明显高于对照组,差异显著有统计学意义(P<0.05)。见表1。
表1 结核组和对照组的胸水和血清中的ADA、TP和LDH的检测结果(±s)

表1 结核组和对照组的胸水和血清中的ADA、TP和LDH的检测结果(±s)
注:“P”:指胸水;“S”:指血清。
项目PADA/U·L-1 SADA/U·L-1 PADA/SADA PTP/g·L-1 STP/g·L-1 PTP/STP PLDH/U·L-1 SLDH/U·L-1 PLDH/SLDH结核组(n=50)68.5 ±1.02 16.2 ±2.8 3.13 ±1.40 55.3 ±6.92 63.6 ±2.54 0.69 ±0.07 418.0 ±201.4 203.0 ±40.7 3.44±2.27对照组(n=20)3.55 ±0.98 24.6 ±20.0 0.94 ±0.45 17.8 ±10.6 61.1 ±6.5 0.28 ±0.22 52.5 ±46.6 254.5 ±58.0 0.35 ±0.25 t 28.301 2.930 6.829 18.321 2.339 11.866 7.997 4.214 6.243 P<0.01 <0.01 <0.01 <0.01 <0.05 <0.01 <0.01 <0.01 <0.01
2.2 胸水中ADA和LDH在结核性胸膜炎的灵敏度、特异度和ROC曲线 根据ROC曲线以及“敏感度+特异度”取最大值的原则,确立胸水中水中ADA和LDH的临界值分别是44 U·L-1和433 U·L-1。ADA 和 LDH 的 AUC 分别为 0.830[95%CI(0.605 ~1.000)],0.774[95%CI(0.586 ~0.962)]。见图 1,2。
2.3 结核组中ADA和LDH的ROC结果分析表PADA诊断结核性胸水的敏感度、特异度和准确度分别为70.0%、94.0%和82.0%。PLDH 诊断结核性胸水的敏感度、特异度和准确度分别为56.0%、92.0%和74.0%。二者联合检测的诊断结核性胸水的敏感度、特异度和准确度分别为82.0%,94.0%和88.0%。联合检测的敏感度和准确度均高于任一单项检测,差异比较有统计学意义(P <0.05)。见表2。
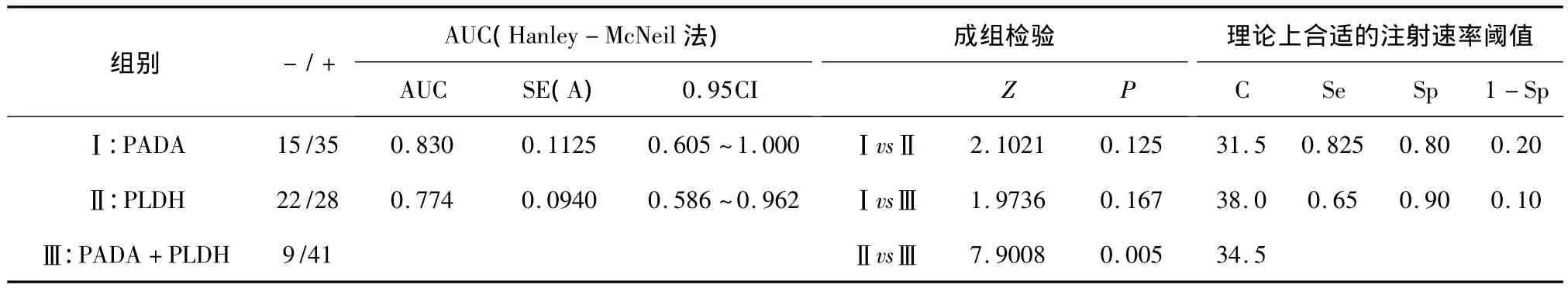
表2 结核组中PADA和PLDH的ROC结果分析表
3 讨论
结核性胸膜炎是结核杆菌及其自溶产物,代谢产物进入超灵敏机体的胸膜腔,引起大量炎性细胞、蛋白质纤维素渗出的炎性反应[7-8]。由于胸膜炎症,胸腔积液的渗出增多,胸液中纤维蛋白、细胞碎片对淋巴管的阻塞和组织炎症的压迫,导致淋巴管微孔的重吸收减少,引起胸腔积液[4]。另外胸膜毛细血管内蛋白质含量升高,胶体渗透压升高,进而胸膜通透性增加,胸水形成及回吸收失衡,大量液体渗漏至胸腔,也是引起胸腔积液的主要原因[9]。
肝性胸水是由于肝硬化晚期患者在极度的低白蛋白血症,导致胶体渗透压下降,破坏血管外静水压与渗透压之间的平衡,促使血浆自血管内进入胸腔产生胸水[10-11]。肝硬化时肝静脉压力也会升高,血浆自肝窦渗透到周围的组织间隙,使得淋巴液生成增多,造成胸导管压力升高,加之胸腔负压作用,使得胸膜淋巴管扩张、淋巴液淤滞、外溢产生胸水[12]。肝性胸水易伴发自发性细菌性脓胸,应尽早进行血、胸水的细菌培养检查,以指导临床进行强有力的抗感染治疗[13]。肝性胸水是肝硬化失代偿期的晚期并发症之一,临床症状也不典型,易被忽略。
ADA为腺嘌呤生成次黄嘌呤的关键酶,是参与机体免疫关系密切的核酸代谢酶,最终氧化成尿酸排出体外。在人体存在三种同工酶,结核性胸水ADA主要以ADA2升高为主,ADA2存在于单核细胞[14]。结核杆菌引起的机体的免疫是特异性的免疫,在细胞免疫中,ADA在淋巴细胞的分化及单核细胞转化成巨噬细胞中的活性大幅升高[15]。结核性胸膜炎由于胸膜局部的T淋巴细胞受到结核分枝杆菌抗原的刺激,使其分化和增值,可能是胸水中ADA升高的原因[16-17]。吴聪[18]等对 ADA 对于结核性胸膜炎的诊断价值进行过荟萃分析,随着ADA方法改进及全自动生化分析仪的成熟应用,提高了结核性胸膜炎的阳性诊断率。刘春云[7]等认为在结核性胸腔积液诊断相对困难时,综合考虑ADA的灵敏度和特异度,可作为诊断结核性胸腔积液的重要指标。大量文献报道胸腔积液中ADA测定有助于早期诊断结核性胸膜炎,还可以作为鉴别结核性和恶性胸腔积液的重要指标[19],这一结论现在广泛应用于临床。胸水中ADA的浓度大于70 U·L-1诊断为结核性胸水,在40~70 U·L-1诊断为结核性胸水的可能性为75.0%,小于40.0%的诊断为结核性胸水的可能性很小[20]。
LDH是一种含锌的糖酵解酶,存在与机体所有组织细胞的胞质内,组织含量明显高于血清,因此当机体组织受损时,血清中LDH会升高,是反映炎症反应的重要指标之一。肺炎、肺结核、结核性胸膜炎会造成肺组织的坏死或者出现结核性胸腔积液时,血清及周围组织中的 LDH进入胸水导致LDH升高[21]。可解释为人类胸膜间皮细胞核巨噬细胞具有强阳性的LDH细胞化学反应,是胸膜炎程度的标志物,其数值越高,表现炎症越明显[22]。由于LDH对病因诊断的特异性较差,当用LDH测定值判断肺炎、肺结核、结核性胸膜炎时,首先要排除心梗、急性肝功能损伤,外部筋肉损伤等。刘彤媌[23]报道LDH在结核性胸水和癌性胸水中的浓度有一定的区别。夏静[20]等发现结核性、恶性及炎性胸腔积液的LDH明显高于正常范围,且结核性胸腔积液患者胸水与血清LDH比值明显高于恶性胸腔积液患者,在鉴别诊断结核性的特异性优于恶性胸腔积液。表1中提示,在鉴别结核性胸水与肝性胸水时,胸水与血清LDH比值比血清LDH有明显的优势。
表1提示:(1)结核组中胸水和血清的ADA及PADA/SADA的比值均高于对照组,差异显著有统计学意义(P<0.01)。充分说明检测ADA对结核胸水的诊断和鉴别诊断比肝病胸水更具有优势,再次证明了胸水ADA是诊断结核性疾病的重要指标之一。(2)结核组的胸水和血清的LDH及PLDH/SLDH的比值均高于对照组,差异显著有统计学意义(P<0.01)。检测胸水和血清中LDH的含量对诊断结核性胸水有临床价值。与相关文献[24]报道的不一致。表2提示:PADA诊断结核性胸水的敏感度、特异度和准确度分别为 70.0%、94.0%和82.0%。PLDH诊断结核性胸水的敏感度、特异度和准确度分别为56.0%、92.0%和74.0%。二者联合检测的诊断结核性胸水的敏感度、特异度和准确度分别为82.0%,94.0%和88.0%。联合检测的敏感度和准确度均高于任一单项检测,差异比较有统计学意义(P<0.05)。因此联合检测可以提高敏感度和准确率,对诊断结核性胸膜炎有重要临床意义。
由此可见,多项生化指标联合检测能提高结核性胸膜炎的诊断准确率。必须要求我们在日常的生化检测中观察并分析异常的实验室数据,分别进行组合统计,探索患者体液的生化检测变化规律。然后通过大量数据证实这一规律的客观存在,并作为鉴别诊断的依据应用于临床。
[1]罗一钧,杨建林.赣州地区结核分枝杆菌利福平和异烟肼耐药基因突变特点的研究[J].国际检验医学杂志,2014,35(9):1136-1137.
[2]孙 庆.荧光定量聚合酶链反应快速检测胸腹水抗酸杆菌的临床应用[J].国际检验医学杂志,2011,32(13):1479-1480.
[3]Jolobe OMP.Atypical tuberculous pleural effusions[J].European Journal ofInternal Medicine,2011,22:456-459.
[4]彭德虎,石 琳,罗立全,等.结核性胸膜炎患者胸腔积液蛋白质含量对预后的影响[J].实用医学杂志,2012,28(21):3611-3612.
[5]汪发勇,汤海涛,潘宏年,等.27例结核性胸腹炎临床诊治分析[J].安徽医药,2013,17(6):995-996.
[6]卢小容.肝硬化失代偿期合并肝性胸水30例临床观察[J].黑龙江医学,2011,35(3):199-200.
[7]刘春云,龚享文,陈 谦,等.胸水腺苷脱氨酶对结核性胸腔积液诊断价值的Meta分析[J].现代中西医结合杂志,2013,22(4):384-386.
[8]刘志辉,彭德虎,孟繁荣,等.结核性胸膜炎患者结核分枝杆菌培养滤液、胸腔积液和血清蛋白质组分析[J].实用医学杂志,2014,30(17):2745-2747.
[9]卜建玲,马 玙.结核性胸膜炎的诊断现状与研究进展[J].中国防痨杂志,2009,31(1):33-36.
[10]张 俊,孙文兵.肝性胸水[J].中国临床医生,2013,41(8):12-14.
[11]胡铭洋,彭 燕.肝性胸水诊治的进展[J].世界华人消化杂志,2014,22(14):1953-1958.
[12]卢小容.肝硬化失代偿期合并肝性胸水30例临床观察[J].黑龙江医学,2011,35(3):199-200.
[13]陈泽云,雷正荣.肝性胸水的治疗现状[J].中国中医急症,2011,20(8):1294-1296.
[14]李方学,张为卿,张广蕾,等.腺苷脱氨酶检测在胸腔积液中的诊断价值[J].中国实验诊断学,2011,15(9):1351-1352.
[15]曾 静,程多智.腺苷脱氨酶在胸水性质鉴别的临床应用[J].临床肺科杂志,2013,18(12):2302-2303.
[16]欧阳福桂.胸水腺苷脱氨酶检测在结核性胸膜炎诊断中的临床应用[J].江西医药,2012,47(9):818-819.
[17]郑 建,欧勤芳,刘袁媛,等.结核性胸膜炎患者结核特异性T淋巴细胞的免疫应答及其迁徙作用[J].中华传染病杂志,2013,31(12):715-718.
[18]吴 聪,江 静,谢作华,等.腺苷脱氨酶对结核性胸膜炎诊断的荟萃分析[J].内科,2007,10(2):718-723.
[19]尉艳霞,童朝晖,龚娟妮,等.腺苷脱氨酶诊断结核性胸膜炎价值的再评价[J].中国结核和呼吸杂志,2010,33(4):273-275.
[20]夏 静,闫雪波,刘荣玉.联合检测CEA、ADA、LDH及血沉对胸腔积液性质判断的临床意义[J].安徽医药,2013,17(2):222-223.
[21]刘华伟,李建红,王 健.肺癌患者血清乳酸脱氢酶水平变化的临床意义[J].临床肺科杂志,2011,16(8):1284.
[22]甘永梅,周叶苹,於 敏.CEA和LDH联检对良恶性胸腔积液鉴别诊断价值的探讨[J].临床肺科杂志,2012,17(11):2100-2101.
[23]刘彤媌.降钙素原及乳酸脱氢酶联合检测在对老年患者胸腔积液诊断中的价值[J].中国老年学杂志,2013,33(6):1249-1251.
[24]刘培香,许益民.检测胸水ADA、TP、LDH、ALP对结核性胸膜炎的诊断价值[J].实用预防医学,2011,18(7):1344-1345.

