牛IFN-ε基因克隆、表达与抗病毒活性分析
王庭柱,郭永丽,高明春,罗修鑫,安东,刘莹,师东方*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江省农垦总局建三江管理局八五九农场,黑龙江双鸭山 156326)
牛IFN-ε基因克隆、表达与抗病毒活性分析
王庭柱1,2,郭永丽1,高明春1,罗修鑫1,安东1,刘莹1,师东方1*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江省农垦总局建三江管理局八五九农场,黑龙江双鸭山 156326)
为分析预测牛IFN-ε基因功能及特性,研究首先从牛肝基因组中克隆该基因,推导牛IFN-ε基因对应氨基酸并作生物信息学分析,在mRNA水平验证牛IFN-ε基因为可转录基因。构建包含牛IFN-ε成熟肽基因的原核表达载体pET32a-BoNE,将重组载体转移至大肠杆菌RosettaTM(DE3)pLysS,IPTG诱导表达,融合蛋白rBoNE主要以包涵体形式存在。结果表明,经MDBK-VSV干扰素活性系统检测,牛IFN-ε融合蛋白具有抗病毒活性。组织分布表明,其可在肝、肾、胸腺、小肠以及睾丸中组成性表达,但心脏未见表达。
牛IFN-ε;克隆表达;融合蛋白;抗病毒活性
网络出版时间2015-12-28 12:54:15[URL]http://www.cnki.net/kcms/detail/23.1391.S.20151228.1254.002.html
王庭柱,郭永丽,高明春,等.牛IFN-ε基因克隆、表达与抗病毒活性分析[J].东北农业大学学报,2015,46(12):39-44.
Wang Tingzhu,Guo Yongli,Gao Mingchun,et al.Cloning,expression and antiviral activity analysis of bovineIFN-ε[J].Journal of Northeast Agricultural University,2015,46(12):39-44.(in Chinese with English abstract)
IFN-ε是Ⅰ型干扰素重要成员。与IFN-α、IFN-β、IFN-κ、IFN-ω、IFN-ε、IFN-δ、IFN-αω、 IFN-ν、IFN-τ、IFN-ζ(或者Limitin)等具有相同受体类型、基因座位点及相似蛋白结构[1-3]。IFN-ε含192个氨基酸,与IFN-β蛋白结构相似[1]。与其他Ⅰ型干扰素不同,IFN-ε可持续表达于肺、脑、小肠和生殖组织[1,4],与IFN-α2b相比具有较低抗病毒、抗增殖和自然杀伤细胞增殖活性[5],但在胎生哺乳动物抗病毒保护和早期胎盘发育中均具有重要作用[1,6-8]
IFN-ε研究日趋完善[3,9-12],人、鼠、猪和狗的IFN-ε已见报道[1,3,9-14],但生物学活性研究较少。牛Ⅰ型干扰素研究有限,尤其是牛IFN-ε,其正常生理条件下能否组成型表达、生理与免疫学功能目前仍未可知。本研究克隆并表达牛IFN-ε,并测定其抗病毒活性、生理条件下组织分布状态,为反刍动物IFN-ε深入研究提供理论支持。
1 材料与方法
1.1材料
1.1.1菌株、载体和试剂
原核表达载体pET-32a(+)购自Novagen公司;大肠杆菌RosettaTM(DE3)pLysS和TG1感受态细胞由东北农业大学动物医学学院微生物教研室保存;TRIzol试剂购自Invitrogen公司;PFU高保真性DNA聚合酶购自北京天根生化科技有限公司;DNA Marker、pMD18 T载体、rTaq、Primestar DNA聚合酶和限制性内切酶购自大连TaKaRa工程有限公司;pEASY Blunt T载体购自北京全式金生物技术有限公司;T4DNA连接酶购自NEB公司;BCA蛋白浓度测定试剂盒购自北京碧云天有限公司;Ni-NTA纯化试剂盒购自南京金斯瑞生物科技有限公司。
1.1.2细胞和病毒
荷斯坦奶牛肝组织采自黑龙江哈尔滨综合牧场;VSV病毒购自中国兽药监察所;MDBK细胞和EBK细胞由哈尔滨兽医研究所馈赠。
1.2方法
1.2.1牛IFN-ε基因定位与克隆
参照分子克隆指南提取牛肝基因组[15]。NCBI上搜索IFN-ε基因成熟肽序列,将其在牛基因组序列上定位分析,得出牛基因组上IFN-ε基因序列。根据得到的基因序列设计包括牛IFN-ε在内的特异性上游引物BoIFNES:5'GGTGCTGCTAAGCCTCT GA 3'和下游引物BoIFNEA:5'CAGTCGGCTGTTC CTTCAC 3'。以提取牛肝基因组为模板,PCR扩增目的片段,反应条件为:94℃5 min;94℃30 s,52~62℃30 s,72℃40 s,30个循环;72℃10 min。胶回收扩增目的片段,连接至pEASY Blunt-T载体,酶切鉴定正确后测序分析。
1.2.2牛IFN-ε基因序列分析
通过网站预测软件(http://www.ncbi.nlm.nih.gov/ gorf/)分析牛IFN-ε开放性阅读框架(ORF),同时使用Lasergene 11软件包(DNAStar,Inc.,USA)和ClustalX软件分析牛IFN-ε氨基酸序列并作序列比对分析,通过ClustalX和MEGA 5.0作进化树构建分析[16]。
使用在线软件预测牛IFN-ε糖基化位点(http:// www.cbs.dtu.dk/services/NetGlycate/)及二级结构(http:// www.npsa-pbil.ibcp.fr.)。
1.2.3牛IFN-ε基因mRNA转录分析
EBK细胞提前24 h铺板,待单层细胞长至细胞板80%~90%时,加入1∶100倍稀释的VSV病毒感染1.5 h,换取细胞维持液。VSV感染EBK细胞后6 h收获细胞,参照说明书使用Trizol试剂提取细胞总RNA,DNase I处理后使用引物BoIFNEA反转录合成cDNA第1链。以此为模板,特异性鉴定上游引物BoNE-RNAA1:5'AGACCTCGTCAGT TCAGCAG 3'以及下游引物BONE-RNAA2:5'GA CAATAGTCCAGGCACAGC 3'扩增目的基因片段,PCR反应条件同上。胶回收扩增目的片段,连接至pMD18 T载体,酶切鉴定正确后测序分析。
1.2.4牛IFN-ε原核表达载体构建
设计原核表达特异性引物BoNEORFEI:5' TGTTGAATTCEcoRⅠCAAGAGCTGAAACTGGTT 3'和BoNEORFXI:5'TCACTCGAGXhoITCAAGTTTCC ATGCCCTGT 3'扩增牛IFN-ε成熟肽序列,PCR反应条件同上。将PCR产物与pET-32a(+)质粒分别用Eco RⅠ和XhoⅠ双酶切,酶切产物纯化回收并T4DNA连接酶连接,转化至TG1感受态中,经酶切鉴定阳性质粒,测序正确的重组质粒命名为pET32a-BoNE。
1.2.5融合蛋白rBoNE表达与纯化
将pET32a-BoNE转化RosettaTM(DE3)pLysS感受态细胞,经IPTG诱导表达6 h,重悬菌体后在冰浴条件下超声裂解,取沉淀和上清SDS-PAGE分析,将融合蛋白命名为rBoNE[17]。大剂量诱导后用Ni-NTA亲和层析纯化目的蛋白,BCA蛋白浓度测定试剂盒测定纯化后蛋白浓度,SDS-PAGE检测。
1.2.6融合蛋白rBoNE抗病毒活性分析
96孔细胞培养板常规培养MDBK细胞至单层后,每孔加入100 μL4倍稀释的rBoNE,37℃孵育24 h后用100 TCID50VSV攻毒,24~48 h后观察细胞病变抑制结果,同时设细胞对照和病毒对照。以抑制50%细胞病变(CPE50)的最高干扰素稀释度为1个活性单位(U)[18]。
1.2.7牛IFN-ε组织分析
取成年牛心、肝、肾、胸腺、小肠、睾丸等组织提取RNA,使用引物BoIFNE-A2反转录,DNase I处理后使用引物BoIFNEA反转录,BoNE-RNAA1和BONE-RNAA2为引物PCR扩增。同时以牛GAPDH基因作为内参,检测牛IFN-ε基因在组织中分布情况。
2 结果与分析
2.1目的基因扩增与序列分析
PCR扩增产物经琼脂糖凝胶电泳鉴定,片段大小约1 000 bp,与预期大小(1 073 bp)一致(见图1);重组质粒经酶切鉴定分析后均与预期相符,测序结果经比对分析,与参考基因片段相似性达99.81%,其中ORF区氨基酸相似性达100%。ORF区包含一个21 aa组成信号肽序列以及172 aa成熟肽序列,蛋白质分子质量大小为22.694 ku,等电点为8.34。

图1 牛IFN-ε PCR扩增产物Fig.1PCR product of bovine IFN-ε
二级结构预测结果表明,牛IFN-ε有5个潜在α螺旋,与人和鼠IFN-ε结果一致。牛IFN-ε无N-糖基化位点,存在7个潜在O-糖基化位点,这些位点在蛋白折叠、寡聚化和稳定性方面起重要作用[19]。进化分析结果表明,牛IFN-ε与其他动物IFN-ε亲缘关系较近,可能是由一个共同的祖先分子进化而来(见图2)。另外进化树构建分析的序列共分3个进化分支:Ⅰ型干扰素、Ⅱ型干扰素和Ⅲ型干扰素,且IFN-ε属于Ⅰ型干扰素。
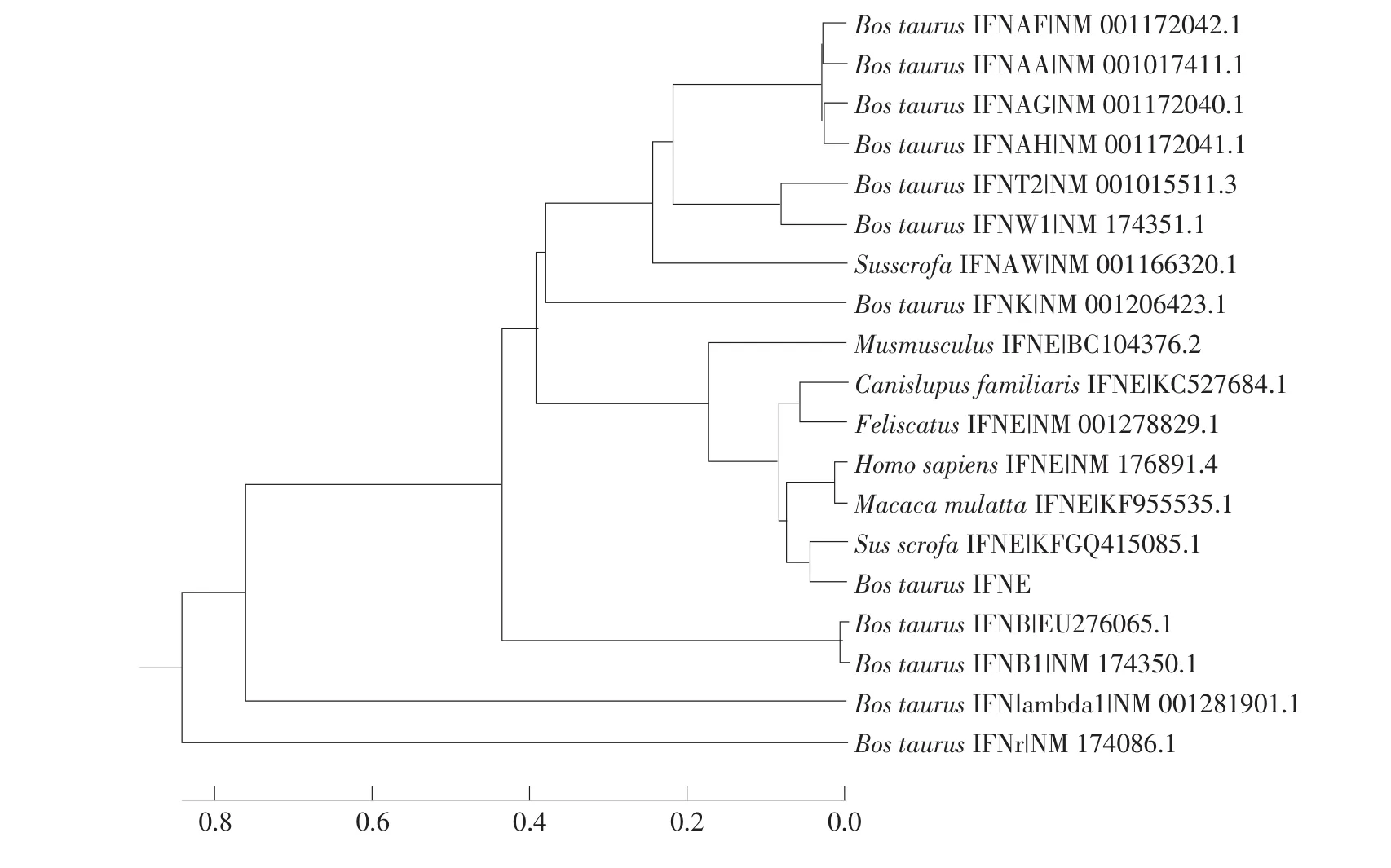
图2 牛IFN-ε进化分析Fig.2Phylogenetic analysis of bovine IFN-ε
2.2牛IFN-ε转录分析
EBK细胞感染VSV 6 h后,RT-PCR可检测到牛IFN-ε基因转录(见图3a),牛IFN-ε mRNA来源序列与基因组来源序列一致(见图3b)。

图3 牛IFN-ε的mRNA转录分析及鉴定Fig.3mRNA transcription analysis and identification of bovine IFN-ε
2.3牛IFN-ε表达载体构建与鉴定
以pEASY-BoNE为模板,上下游引物BoNE⁃ORFEI和BoNEORFXI扩增出约530 bp基因片段,与预期目的片段相符(见图4a)。然后以相似方式连接到pET32a载体(见图4b)。
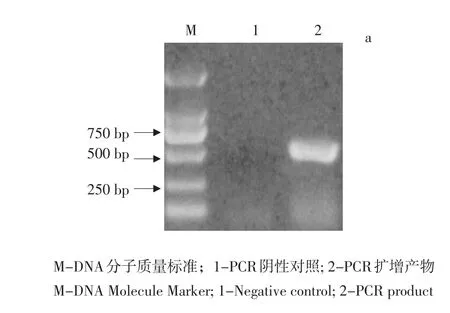
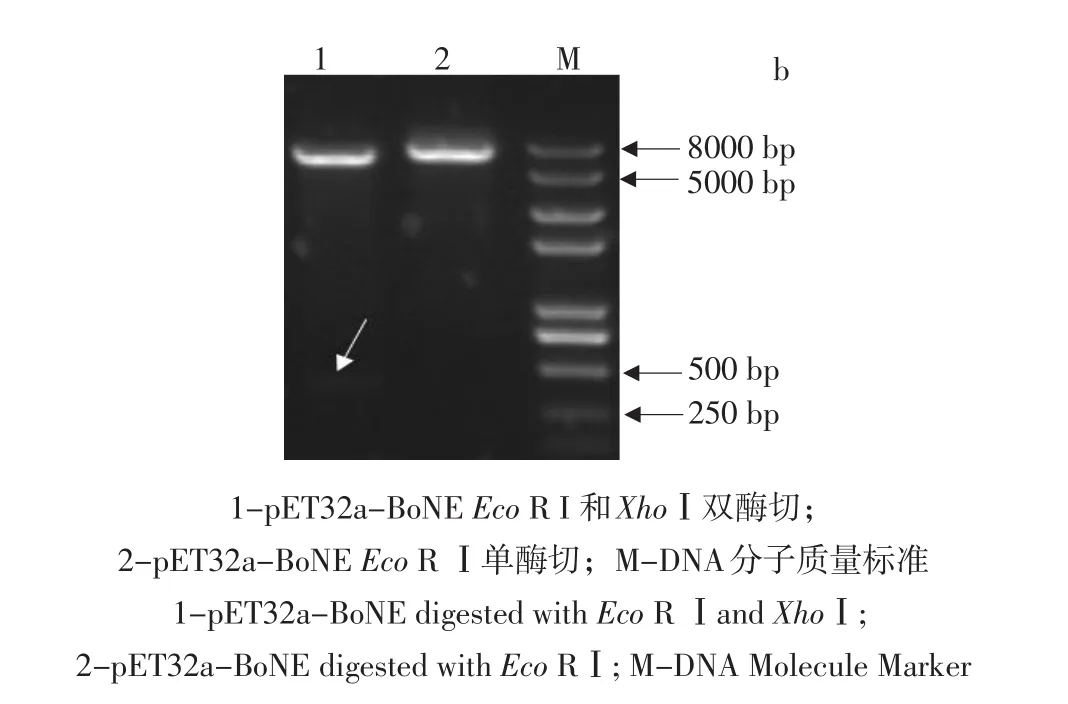
图4 重组质粒PCR扩增和鉴定Fig.4PCR and restriction digestion analysis of pET32a-BoNE
2.4融合蛋白rBoNE表达与纯化
SDS-PAGE结果表明,重组菌在分子质量约25 ku处有特异性蛋白条带,与预期分子质量一致,并且表达的融合蛋白主要以包涵体形式存在(见图5a)。rBoNE经Ni-NTA亲和层析纯化显示清晰单一条带(见图5b),BCA法测定纯化蛋白浓度为0.528 mg·mL-1。
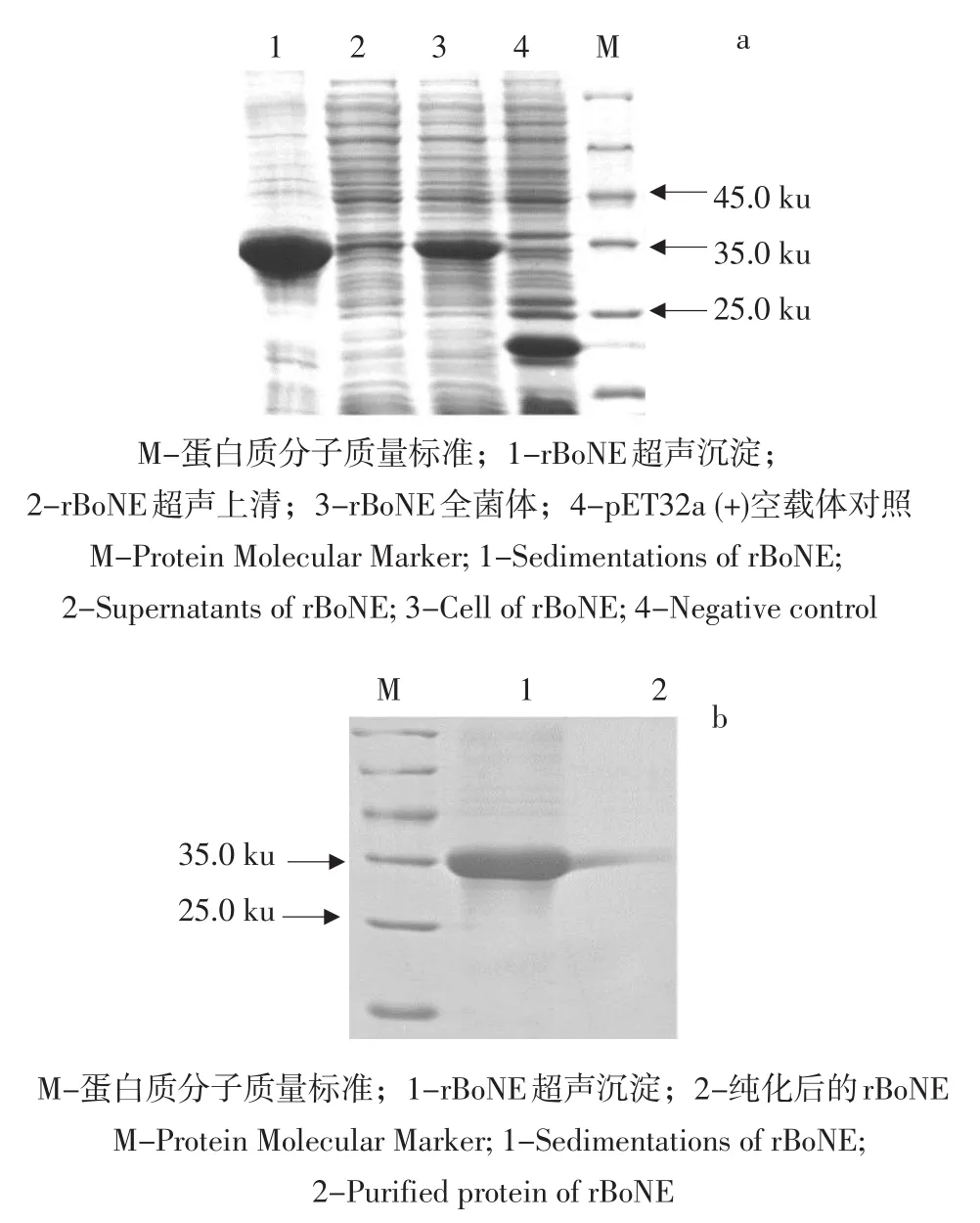
图5 rBoNE诱导表达可溶性分析及纯化Fig.5SDS-PAGE analysis of recombinant protein rBoNE
2.5融合蛋白rBoNE抗病毒活性分析
抗病毒活性试验表明,MDBK细胞对照组生长良好(见图6a),rBoNE处理后(经计算,活性为6.7×103U·mL-1),能抵抗100TCID50病毒攻击(见图6b),而病毒对照组细胞全部死亡(见图6c),说明纯化获得融合蛋白rBoNE具有较好抗病毒活性。
2.6牛IFN-ε组织分布
半定量RT-PCR结果表明,BoIFN-ε可在生理条件下持续性表达于肝、脾、肾、小肠、睾丸,而心脏未见表达。BoIFN-α在上述组织中均不表达,GAPDH内参结果显示从肺中提取RNA失败(见图7)。
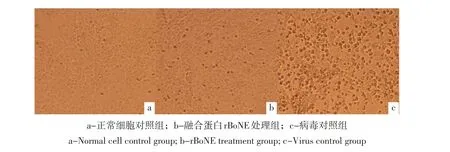
图6 融合蛋白rBoNE抗病毒分析Fig.6Antiviral activity analysis of rBoNE
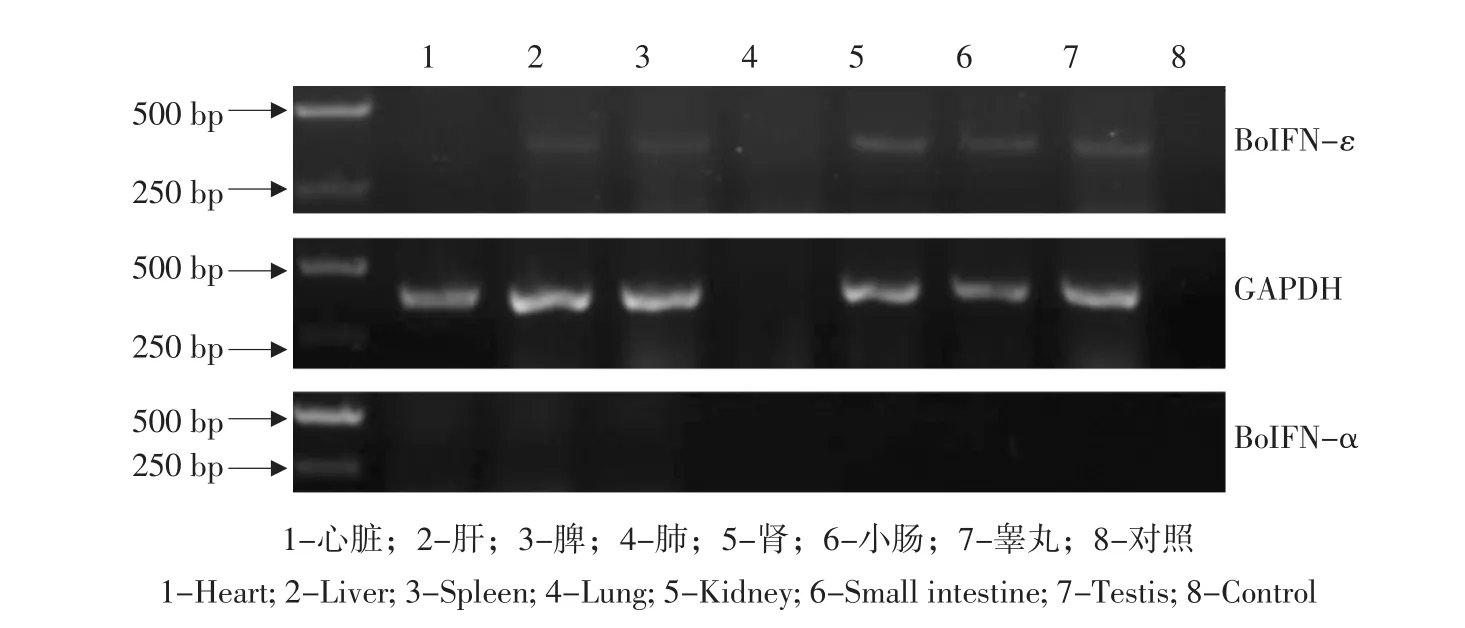
图7 BoIFN-ε组织分布Fig.7Tissue analysis of BoIFN-ε
3 讨论
IFN-ε可表达于各种细胞,但是在生殖组织中发挥病毒保护还是在早期胚胎发育中发挥作用仍无定论[7,20]。Ⅰ型干扰素各型之间结构类似,均为无内含子的单拷贝或多拷贝基因[21]。所以本试验从牛肝基因组中克隆获得IFN-ε基因,采用RT-PCR方法证明牛IFN-ε为可转录基因。生物信息学分析结果表明,牛IFN-ε与猪IFN-ε同源性为87.1%,与其他动物IFN-ε在相同位置有高度保守的氨基酸位点,具有保守的半胱氨酸,可形成一个二硫键,有潜在糖基化位点可形成糖蛋白,具有5个α螺旋,这些特性均属于Ⅰ型干扰素典型特征。另外进化分析表明,牛IFN-ε与其他动物IFN-ε属于同一进化分支,且属于牛Ⅰ型干扰素分支。
IFN-ε多分布在生殖组织,人IFN-ε显著表达于子宫、子宫颈、阴道和卵巢[22],鼠IFN-ε表达于卵巢、子宫、纤维母细胞、肺、脑、肾上腺及心脏,但胸腺、脾、睾丸、肝和肾中未见表达[1]。恒河猴IFN-ε表达于子宫、卵巢和睾丸,在心脏、胸腺、肠、肾、脑和脊髓中也有表达[23],猪IFN-ε可表达于皮肤、肠、肠系膜淋巴结、睾丸、脾和外周血淋巴细胞,但肠、肠系膜淋巴结和皮肤表达量较高[14]。牛IFN-ε可表达于肝、脾、肾、肠、睾丸中,而心脏未见表达,可能与不同物种IFN-ε组织表达分布不同有关。
本研究通过细胞病变抑制法,选用牛源细胞MDBK和测定干扰素活性的标准病毒VSV作为抗病毒检测系统,检测融合蛋白rBoNE活性。结果表明融合蛋白在MDBK细胞上具有抗病毒活性,为今后获得重组牛IFN-ε奠定基础。为牛Ⅰ型干扰素研究提供理论基础,而有关牛IFN-ε具体功能有待进一步研究。
4 结论
a.克隆得到牛IFN-ε,该分子具有典型的I型干扰素分子特征。
b.牛IFN-ε在细胞水平具有抗病毒活性。
c.牛IFN-ε为组成型表达,分布于肝、脾、肾、肠、睾丸中。
[1]Hardy M P,Owczarek C M,Jermiin L S,et al.Characterization of the type I interferon locus and identification of novel genes[J].Ge⁃nomics,2004,84(2):331-345.
[2]Peng F W,Gao H C,Xie Z P,et al.Biological activities of recom⁃binant human interferon Epsilon[J].Chinese Journal of Experi⁃mental&Clinical Virology,2005,19(3):227-231.
[3]Kontsek P,Karayianni-Vasconcelos G,Kontsekova E.The hu⁃man interferon system:Characterization and classification after discovery of novel members[J].Acta Virol,2003,47(4):201-215.
[4]Hermant P,Francius C,Clotman F,et al.IFN-epsilon is constitu⁃tively expressed by cells of the reproductive tract and is ineffi⁃ciently secreted by fibroblasts and cell lines[J].PLoS One,2013,8 (8):71320.
[5]Peng F W,Duan Z J,Zheng L S,et al.Purification of recombinant human interferon-epsilon and oligonucleotide microarray analysis of interferon-epsilon-regulated genes[J].Protein Expr Purif,2007, 53(2):356-362.
[6]Xi Y,Day S L,Jackson R J,et al.Role of novel type I interferon epsilon in viral infection and mucosal immunity[J].Mucosal Im⁃munol,2012,5(6):610-622.
[7]Matsumiya T,Prescott S M,Stafforini D M.IFN-epsilon mediates TNF-alpha-induced STAT1 phosphorylation and induction of ret⁃inoic acid-inducible gene-I in human cervical cancer cells[J].J Immunol,2007,179(7):4542-4549.
[8]Sharkey D J,Macpherson A M,Tremellen K P,et al.Seminal plas⁃ma differentially regulates inflammatory cytokine gene expression in human cervical and vaginal epithelial cells[J].Mol Hum Re⁃ prod,2007,13(7):491-501.
[9]Freaney J,Zhang Q,Yigit E,et al.High-density nucleosome occu⁃pancy map of human chromosome 9p21-22 reveals chromatin or⁃ganization of the type I interferon gene cluster[J].J Interferon Cy⁃tokine Res,2014,34(9):676-685.
[10]乔世峰.干扰素-α对人肝癌细胞抑制作用的研究[J].中国现代医学杂志,2006(1):43-46.
[11]李武平,宋瑜丽,张成海,等.重组人干扰素-β(rhIFN-β)中试工艺研究[J].中国生物制品学杂志,2004(1):33-35.
[12]高寒春.人干扰素ε的克隆、表达及活性的初步研究[D].呼和浩特:内蒙古师范大学,2004.
[13]Yang L,Xu L,Li Y,et al.Molecular and functional characteriza⁃tion of canine interferon-epsilon[J].J Interferon Cytokine Res, 2013,33(12):760-768.
[14]Sang Y,Rowland R R,Hesse R A,et al.Differential expression and activity of the porcine type I interferon family[J].Physiol Ge⁃nomics.2010,42(2):248-258.
[15]Joseph S,Russell D W.Molecular cloning:A laboratory manual [M].Beijing:Science Press,2008.
[16]Guo Y,Gao M,Luo X,et al.Molecular cloning and characteriza⁃tion of the alpha-chain gene of goose immunoglobulin heavy chain [J].Biotechnol Lett,2014,36(4):805-811.
[17]王君伟,郭永丽,高明春.外源重组蛋白制备鹅免疫球蛋白轻链特异性多克隆抗体[J].东北农业大学学报,2012,43(9): 60-63.
[18]Rubinstein S,Familletti P C,Pestka S.Convenient assay for inter⁃feron[J].J Virol,1981,37:755-758.
[19]Hosoi K,Utsumi J,Kitagawa T,et al.Structural characterization of fibroblast human interferon-beta 1[J].J Interferon Res,1988,8 (3):375-384.
[20]Krause C D,Pestka S.Evolution of the Class 2 cytokines and re⁃ceptors,and discovery of new friends and relatives[J].Pharmacol Ther,2005,106(3):299-346.
[21]Lowenthal J W,Staeheli P,Schultz U,et al.Nomenclature of avi⁃an interferon proteins[J].J Interferon Cytokine Res,2001,21(7): 547-549.
[22]Fung K Y,Mangan N E,Cumming H,et al.Interferon-epsilon protects the female reproductive tract from viral and bacterial in⁃fection[J].Science,2013,339(6123):1088-1092.
[23]Demers A,Kang G,Ma F,et al.The mucosal expression pattern of interferon-epsilon in rhesus macaques[J].J Leukoc Biol.2014,6 (96):1101-1107.
Cloning,expression and antiviral activity analysis of bovineIFN-ε
WANG Tingzhu1,2,GUO Yongli1,GAO Mingchun1,LUO Xiuxin1,AN Dong1,LIU Ying1,SHI Dongfang1(1.School of Veterinary Medicines,Northeast Agricultural University,Harbin 150030,China;2.859 Farm of Jiansanjiang Administration,Agricultural Reclamation Administration of Heilongjiang Province,Shuangyashan Heilongjiang 156326,China)
In order to analyze the functions and characterization of predicted bovineIFN-εgene,a novel bovineIFN-εgene was cloned from bovine liver genome,the corresponding amino acids were deduced and the characterization was analyzed with bioinformatics software,and bovineIFN-εwas verified to be the transcribed gene at the mRNA level.Then the prokaryotic expression vector pET32a-BoNE containing the mature peptide gene of bovine IFN-ε was constructed,and the recombinant vector was transformed intoE.coliRosettaTM(DE3)pLysS.After IPTG induction,the fusion protein rBoNE mainly expressed as the insoluble form.The results showed antiviral activity was analyzed by MDBK-VSV system, the result revealed that bovineIFN-εhad antiviral activity.Tissue distribution showed that bovine IFN-ε could be expressed constitutively in liver,kidney,thymus,small intestine and testis,but not expressed in the heart.
bovineIFN-ε;cloning and expression;fusion protein;antiviral activity
S852.4+2
A
1005-9369(2015)12-0039-06
2015-04-15
现代农业(奶牛)产业技术体系项目(CARS-37);国家科技支撑计划项目(2012BAD12B05,2012BAD12B03)
王庭柱(1980-),男,博士研究生,研究方向为奶牛疫病防控。E-mail:wangtingzhu1980@163.com
师东方,教授,博士生导师,研究方向为畜禽传染病免疫防控。E-mail:shi_df@163.com

