糖基化反应过程中卵白蛋白分子特性变化研究
胥伟,王海滨,黄迪,向涛,许亚彬
(武汉轻工大学食品科学与工程学院,武汉 430023)
糖基化反应过程中卵白蛋白分子特性变化研究
胥伟,王海滨,黄迪,向涛,许亚彬
(武汉轻工大学食品科学与工程学院,武汉 430023)
以蛋清卵白蛋白糖基化产物为研究对象,监测糖基化反应过程中蛋白分子特性变化。发现随反应时间延长,卵白蛋白与单糖或多糖反应产物接枝度均逐渐增大,且相同反应条件下,卵白蛋白与单糖反应产物接枝度较大;糖基化卵白蛋白表面巯基相对含量前3 d逐渐增加,第4天达最大值,糖基化卵白蛋白表面巯基相对含量始终高于卵白蛋白。1~3 d内,随反应时间延长,糖基化卵白蛋白疏水性不断增加,反应3 d后,糖基化卵白蛋白疏水性则明显下降;反应体系中大体积粒子数随反应时间延长逐渐增加,且前3 d较大面积的粒子数增速较快。圆二色谱研究结果表明,随糖基化反应进行,α螺旋含量逐渐减小,β折叠与β转角含量不断增加;无规则卷曲含量呈波浪式变化,β折叠含量变化最大。结果表明,糖基化反应可提高蛋清卵白蛋白疏水性和分子粒径,使蛋白二级结构发生明显变化。
卵白蛋白;糖基化反应;分子特性
网络出版时间2015-12-25 13:11:04[URL]http://www.cnki.net/kcms/detail/23.1391.S.20151225.1311.044.html
胥伟,王海滨,黄迪,等.糖基化反应过程中卵白蛋白分子特性变化研究[J].东北农业大学学报,2015,46(12):33-38.
Xu Wei,Wang Haibin,Huang Di,et al.Study on ovalbumin molecular properties changes in the process of glycation reaction[J].Journal of Northeast Agricultural University,2015,46(12):33-38.(in Chinese with English abstract)
蛋清蛋白具有多种功能性质(如凝胶性、起泡性、乳化性等),广泛用于食品工业[1],其中卵白蛋白是蛋清中含量最多的蛋白质,占蛋清蛋白总量54%。卵白蛋白分子质量为44.5 ku,等电点为4.5,是一种单体、球形磷酸糖蛋白,由385个氨基酸残基组成,其中疏水性氨基酸占50%以上,碳水化合物比例占3.5%,是蛋清蛋白中唯一具有游离巯基的蛋白质,每1分子卵白蛋白中含有4个巯基和1个二硫键[2]。
王喜波等研究表明,通过改变蛋白分子物可改善蛋白质功能性质[3],如卵白蛋白与右旋糖苷在60℃、湿度大于75%条件下、反应3周以上可制得卵白蛋白-右旋糖苷共轭物,该产物具有良好的乳化性[4]。卵白蛋白糖基化反应后功能性研究已有报道[1],但关于糖基化反应过程中蛋白分子特性研究鲜见报道,本研究以蛋清卵白蛋白与葡聚糖为反应物,研究糖基化反应过程中蛋白分子特性变化,为揭示卵白蛋白糖基化反应进程及其应用提供理论依据。
1 材料与方法
1.1试验材料与试剂
卵白蛋白:Sigma试剂公司;β-葡聚糖:济南昌诺生物技术有限公司;磷酸二氢钠、磷酸氢二钠:国药集团化学试剂有限公司;TNBS(三硝基苯磺酸):上海宝曼生物科技有限公司;DTNB(5,5'-二硫代双-2-硝基苯甲酸):北京索莱宝科技有限公司;1,8-ANS(8-苯胺-1-萘磺酸):上海皓尘生物科技有限公司。
1.2仪器与设备
ALC-310.3电子分析天平:北京赛多利斯仪器系统有限公司;722-2000型分光光度计:北京赛多利斯仪器系统有限公司;DHP-9272型电热恒温培养箱:上海一恒科技有限公司;
BI-200SM静态激光散射仪:美国布鲁克海文公司;S-3400N扫描电镜:日本日立公司;JASCOJ-815圆二色光谱:日本JASCO公司。
1.3方法
1.3.1糖基化卵白蛋白制备
将葡萄糖、葡聚糖分别与卵白蛋白以8∶100混合,置于恒温恒湿箱中,反应温度70℃,相对湿度74%,反应时间1~5 d,每隔1 d取出等量样品置于干燥器于冰箱中(4℃)存放待用[5]。
1.3.2接枝度测定
用去离子水配制质量分数为1%糖基化蛋白样品溶液,取0.5 mL该溶液,依次加入0.5 mL质量分数4%NaHCO3溶液,0.5 mL质量分数10%SDS溶液和0.5 mL质量分数0.1%TNBS溶液,混匀后40℃下避光保温2 h,加入1 mol·L-1HCl溶液0.25 mL和0.01 mol·L-1HCl溶液2.25 mL,混匀后在340 nm下测定吸光值,将卵白蛋白样品作为空白,接枝度计算公式如下:
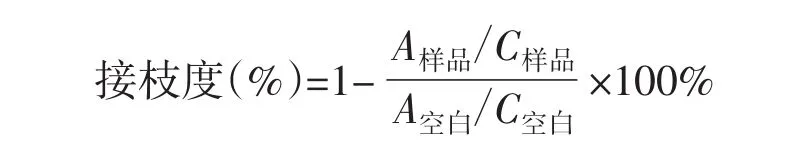
其中,A-340 nm下吸光值;C-蛋白样品浓度(g·mL-1)。
1.3.3巯基相对含量测定
表面巯基相对含量测定:取浓度为0.1 mol·L-1Tris-甘氨酸缓冲液(pH 8.0,含0.01 mol·L-1EDTA)4 mL加入到1 mL质量分数为4%蛋白溶液中,40℃下保温30 min后加入125 μL DTNB试剂中,在25℃显色10 min,测定412 nm下吸光值,以不加样品Ellman试剂作空白对照,计算公式如下:

其中,ΔA为加DTNB试剂样品吸光值与不加DTNB试剂样品吸光值之差;C-样品浓度(g·mL-1)。
总巯基相对含量测定:在Tris-甘氨酸缓冲液中添加0.25%SDS使其蛋白变性,将内部巯基暴露,蛋白质溶液浓度改为0.4%,其他同表面巯基测定。
1.3.4蛋白疏水性测定
参考Sun和Nakai方法[6-7],用pH 7.4浓度0.02 mol·L-1磷酸缓冲液配制浓度0.1%~0.5%蛋白溶液,取不同浓度样品溶液4 mL,加入20 μL ANS溶液(以pH 7.4磷酸缓冲液作溶剂,浓度0.02 mol·L-1)作为荧光探针在25℃下保持1 h。在370 nm激发波长和470 nm发射波长下测定样品荧光强度,以荧光强度为横坐标,蛋白溶液浓度为纵坐标绘制曲线,曲线斜率即为蛋白分子表面疏水性。
1.3.5粒径分析
根据Schwenke和Easa等方法[7-8],并稍作改动。称取0.2 g样品,溶于20 mL pH 7.0浓度为0.1 mol·L-1磷酸缓冲液中,磁力搅拌使其充分溶解,静态激光散射仪测定粒径分布。操作条件:介质:水溶液;扫描角度90°;温度25℃;波长632.8 nm。
1.3.6圆二色谱分析
JASCOJ-810旋光仪分析卵白蛋白与糖基化卵白蛋白远紫外圆二色谱。具体操作如下:将蛋白溶液移至0.1 cm厚椭圆形比色皿中,25℃下连续充氮在190~250 nm扫描区间下远紫外区域扫描,扫描参数为:V=50 nm·min-1,间隔0.1 nm,累积3次扫描结果。克分子椭圆率[θ]计算公式如下:
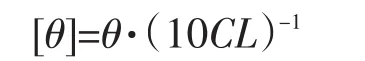
θ-CD仪测出椭圆率(mdeg);C-胰蛋白酶抑制剂浓度(mol·L-1);L-比色皿厚度(cm)。
由The Model JWssE-480 Protein secondary Strueture Estimation Program软件,参照Yang氏CD光谱估算糖基化卵白蛋白二级结构中α螺旋,β折叠,β转角和无规卷曲所占比率。
1.3.7荧光光谱分析
将蛋白样品溶于pH 7.0浓度为0.01 mol·L-1磷酸盐缓冲液中,蛋白质溶液浓度为0.5 mg·mL-1,以pH 7.0浓度为0.01 mol·L-1磷酸盐缓冲液作空白参比,检测参数为:激发波长(280 nm),发射光谱扫描范围(300~380 nm)。
2 结果与分析
2.1糖基化卵白蛋白接枝度分析
为分析卵白蛋白与多糖和单糖发生糖基化反应时接枝度变化的差异性,选用葡萄糖作空白对照,测定不同反应时间卵白蛋白-葡聚糖接枝产物和卵白蛋白-葡萄糖接枝产物(糖添加量为8%,反应温度70℃,相对湿度74%,反应时间1~5 d)接枝度,结果如图1所示。
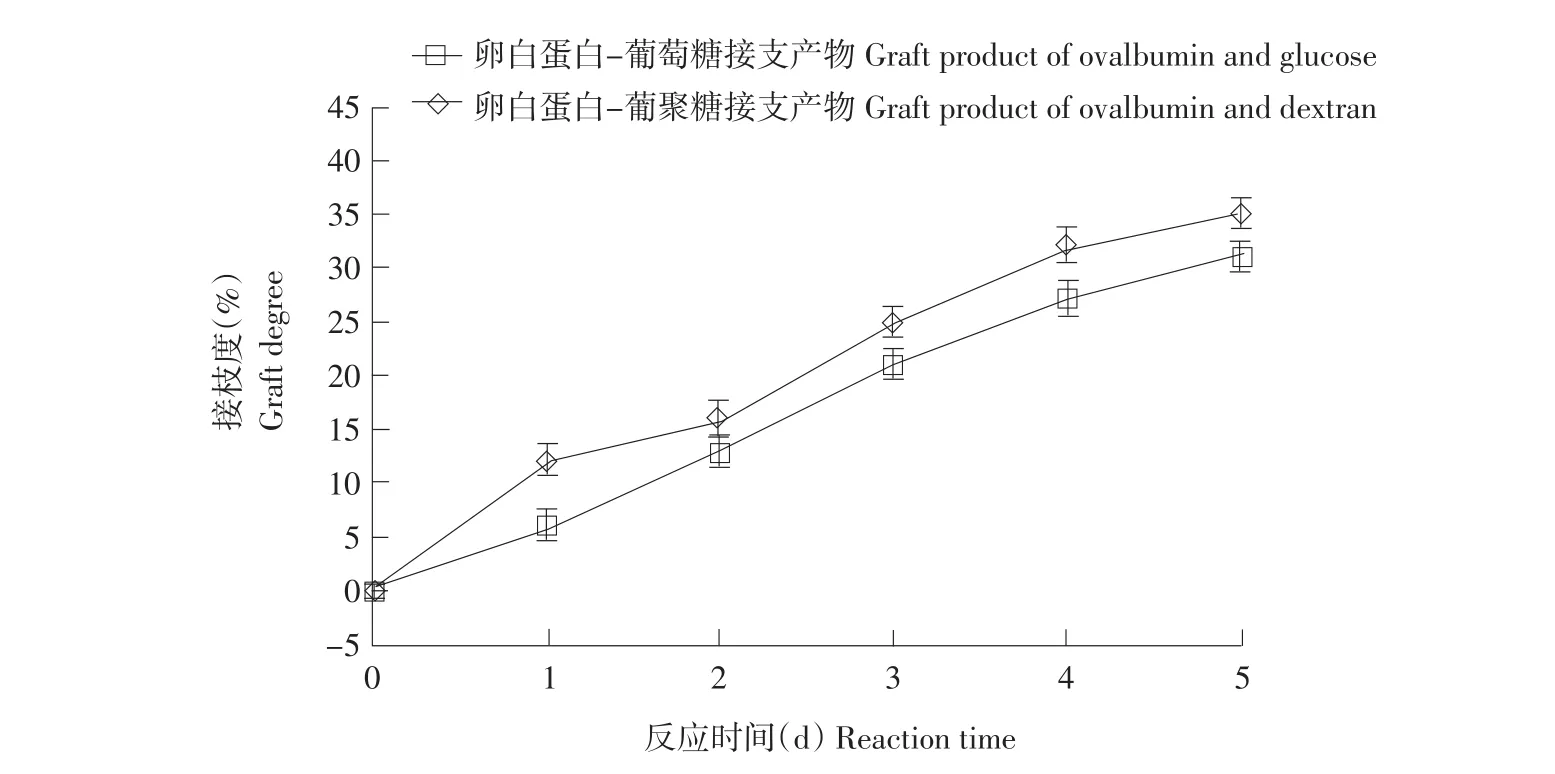
图1 糖基化卵白蛋白接枝度变化Fig.1Change of glacated OVA grafting percentage
在1~5d随反应时间延长,卵白蛋白与单糖和多糖接枝产物接枝度逐渐增大。
2.2糖基化卵白蛋白巯基相对含量变化
糖基化卵白蛋白表面巯基相对含量变化可反映巯基对蛋白结构影响,蛋白巯基相对含量变化如图2所示,本试验所用多糖为葡聚糖。卵白蛋白在相对湿度74%、70℃条件下反应1~5 d,蛋白巯基相对含量随反应时间变化如图2(左)所示。可知表面巯基相对含量在前3 d逐渐增加,第4天达最大。
2.3糖基化卵白蛋白疏水性变化
采用ANS作为荧光探针测定糖基化蛋白疏水性,结果如图3所示。
由图3可知,随蛋白质浓度增加,荧光强度呈线性增长趋势,此方法可较好反映蛋白质表面疏水性。在1~3 d,随反应时间延长,糖基化卵白蛋白疏水性不断增加。Shirai等认为未改性卵白蛋白中有许多疏水基团[9],大多数位于蛋白分子内部,糖基化反应使包埋于天然态卵白蛋白分子内部疏水性基团暴露,使蛋白结构伸展。3 d后糖基化卵白蛋白疏水性明显降低。
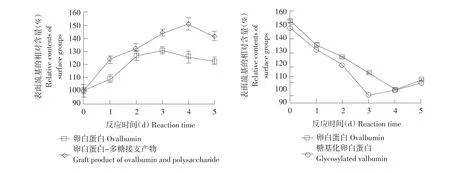
图2 糖基化卵白蛋白巯基相对含量变化Fig.2Change of sulfhydryl groups content of glycated ovalbmin

图3 糖基化卵白蛋白疏水性变化Fig.3Hydrophobicity of glycated ovalbumin during incubation
2.4糖基化卵白蛋白溶液粒径分析
糖基化反应过程中,蛋白分子大小及形状随糖基化反应程度变化,采用静态激光散射仪研究不同反应时期糖基化卵白蛋白粒径分布,结果如表1所示。
D[4,3]表征分子体积,由表1可知,随反应时间延长,反应体系中大体积粒子数逐渐增加。D [3,2]表征分子面积,反应前3 d,具有较大面积粒子数量增速较快,主要由于多糖与蛋白连接使蛋白分子面积增大,后续反应过程中,蛋白伸展对蛋白分子面积影响很小故增速缓慢。
2.5荧光光谱分析
美拉德反应高级阶段产物具有较强荧光特性[10],在激发波长为347 nm,发射波长为450 nm下有较强吸收。这一特性不同于蛋白质色氨酸残基荧光特性(激发波长290 nm,发射波长336 nm),美拉德高级阶段的荧光特性由美拉德反应过程中生成小分子中间产物造成。通过对卵白蛋白样品溶液荧光性分析可以判断美拉德反应高级阶段进行程度。此外,荧光光谱可用于分析糖基化卵白蛋白在反应过程中结构变化,在激发波长347 nm,发射波长450 nm下测定糖基化卵白蛋白荧光强度,并在激发波长280 nm下,扫描区间300~400 nm色氨酸荧光光谱,对结果分析如图4所示。
由图4可知,糖基化反应3 d,蛋白荧光强度并无显著变化,说明此时体系主要处于美拉德反应初级阶段,但当反应进行到第4、5天时,荧光强度增幅剧烈。
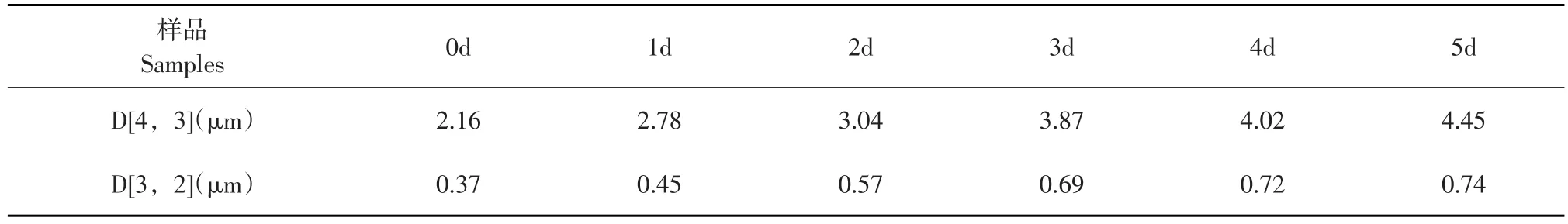
表1 糖基化卵白蛋白平均粒径变化Table 1Mean particle size of glycated ovalbumin
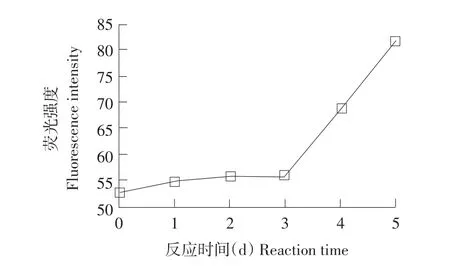
图4 糖基化反应过程中卵白蛋白荧光强度Fig.4Fluorescence of glycated ovalbumin during incubation
图5是在激发波长290 nm,发射波长336 nm条件下测定的色氨酸荧光光谱,图中1为天然态的卵白蛋白,2为不加糖仅在糖基化反应条件下放置3 d卵白蛋白,3为糖基化反应3 d后的卵白蛋白。可知糖基化反应使色氨酸荧光光谱发生明显变化,糖基化反应可部分改变卵白蛋白侧链基团,导致色氨酸残基所处微环境发生改变。
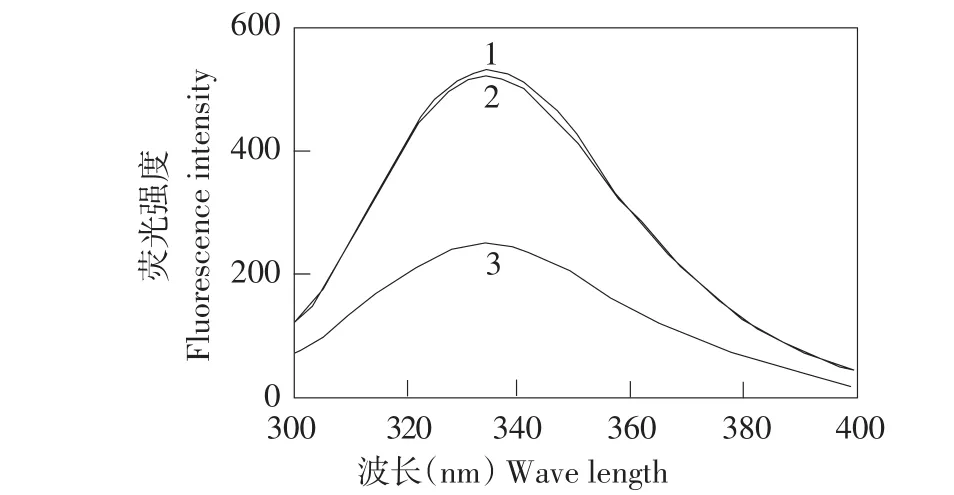
图5 卵白蛋白与糖基化卵白蛋白色氨酸荧光光谱Fig.5Tryptophan fluorescence spectra of ovalbumin and glycated ovalbumin
2.6圆二色谱分析
蛋白质圆二色性被广泛用于蛋白质分子构象检测。采用圆二色谱分析糖基化卵白蛋白二级结构变化,结果如表2所示。
随糖基化反应进行,α螺旋含量逐渐减小;β折叠与β转角含量不断增加;无规则卷曲含量呈波浪式变化,其中β折叠含量变化最大。

表2 糖基化卵白蛋白各构象含量分析Table 2Composition of the structure of glycated ovalbumin (%)
3 讨论与结论
相同反应时间下卵白蛋白与单糖反应产物比多糖反应产物接枝度大,因为葡聚糖分子质量较大,对其醛基末端与卵白蛋白游离氨基之间羰胺反应空间位阻较大。反应过程中,糖基化卵白蛋白表面巯基相对含量始终高于未改性卵白蛋白,因为一方面糖基化反应使蛋白质结构发生变化,蛋白伸展程度增加,将处于分子内部巯基基团暴露在蛋白表面,使表面巯基相对含量增加。另一方面暴露在分子表面巯基在此反应条件下反应活性增强,易于转化成二硫键,进而导致巯基相对含量下降。由图2(右)可知,糖基化卵白蛋白总巯基相对含量始终高于未改性卵白蛋白总巯基相对含量,但与表面巯基变化不同,总巯基相对含量随反应时间延长而降低。反应3 d后糖基化卵白蛋白疏水性明显降低,是由于已伸展疏水基团之间相互作用形成疏水键,蛋白分子表面疏水基团相互聚集,通过疏水相互作用,蛋白单体形成多聚体,进而使蛋白表面疏水性不断下降。本试验中反应前3 d美拉德反应速度(高级阶段)非常缓慢,进入第4天后,美拉德反应速度(高级阶段)急剧加快,这一趋势与王玉堃使用葡萄糖改性所测结果不同[5],造成差异原因是本研究中采用多糖,反应用糖分子质量越大,美拉德反应进入高级阶段越迟。
随反应时间延长,卵白蛋白与单糖或多糖反应产物接枝度均逐渐增大,且相同反应时间与单糖反应产物接枝度较大。随反应时间延长,α螺旋含量逐渐减小,β折叠与β转角含量不断增加,无规则卷曲含量呈波浪式变化,其中β折叠含量变化最大。
[1]邓杰,刘静波,潘风光,等.蛋粉的功能特性研究[J].中国家禽, 2010,32(24):39-41.
[2]Nisbet A D,Saundry R H,Moir A J G.,et al.The complete amino-acid sequence of hen ovalbumin[J].European Journal of Biochemistry,1981,115:335-345.
[3]王喜波,迟玉杰,胥伟.超声辅助琥珀酰化改性大豆蛋白研究[J].东北农业大学学报,2011,42(5):6-13.
[4]Mine Y.Recent advances in the understanding of egg white protein functionality[J].Trends in Food Science and Technology, 1995,6:225-232.
[5]王玉堃.干热过程中美拉德反应对蛋清粉凝胶性的改性研究[D].无锡:江南大学,2011.
[6]Sun Y,Hayakawa S,and Izumori K.Modification of ovalbumin with a rare ketohexose through the Maillard reaction:effect on protein structure and gel properties[J].Journal of Agricultural and Food Chemistry,2004,52:1293-1299.
[7]Nakai S,Li-Chan E.Hydrophobicity-functionality relationship of food proteins[J].Hydrophobic Interactions in Food Systems.Boca Raton,CRC Press:1988,47-48.
[8]Schwenke K D,Hennmg T,et al.Linited trptic hydrolysi of pea legumin molecular mass and conformational stability of legumm-T [J].Journal of Biological Macromolecules,2001,28:175-182.
[9]Shirai N,Tani F,Higasa T,et al.Linear polymerization caused by the defective folding of a noninhibitory serpin ovalbumin[J]. Journal of Biochemistry,1997,121:787-797.
[10]孔保华,李菁,刘骞.美拉德反应产物抗氧化机理及影响因素的研究进展[J].东北农业大学学报,2011,42(11):9-13.
Study on ovalbumin molecular properties changes in the process of glycation reaction
XU Wei,WANG Haibin,HUANG Di,XIANG Tao,XU Yabin(School of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
With egg white ovalbumin glycosylation reaction product as the research object, monitoring glycosylation reaction process,changes in the protein molecular characteristics.Experimental results showed that with prolongation of reaction time,ovalbumin and monosaccharide and polysaccharide of reaction product grafting degree increased gradually,and the same reaction time and reactions of monosaccharide graft copolymer was larger;glycosylated ovalbumin surface thiol relative content of 3 days before gradually increased,the 4 day reached maximum value,and the relative content of glycosylated ovalbumin surface thiol was always higher than that of ovalbumin.In 1-3 days, with the extension of reaction time,the hydrophobicity of the glycosylated albumin increased significantly,and the hydrophobicity of the 3 days later,the size of the large volume of the reaction system increased gradually with the increase of the reaction time,and the first 3 days with a large area of the rapid increase in particle number.Experimental results showed that,glycosylation could improve the hydrophobicity and molecular size of ovalbumin.Determined the secondary structure of ovalbumin before and after the glycosylation reaction,infrared spectroscopy and circular dichroism analysisshowed that the glycosylation reaction to ovalbumin α-helix content decreases gradually;β-sheet was theβ-turn content continues to increase;coil content with the wavy changes in reaction time,the greatest change in theβ-sheet content.
ovalbumin;glycation reaction;molecular properties
TQ64
A
1005-9369(2015)12-0033-06
2015-08-15
湖北省教育厅科技研究计划青年人才项目(532109015012)
胥伟(1985-),男,讲师,博士,研究方向为食品蛋白质化学及应用。E-mail:xuwei1216@163.com

