CyclinD1、P53、CK20在膀胱尿路上皮癌中的表达及其意义
李传应,李 明,王晓秋
(安徽省立医院病理科,安徽合肥 230001)
膀胱尿路上皮癌是泌尿系统中最常见的恶性肿瘤,早期发现并治疗能明显降低患者的死亡率,寻找与膀胱尿路上皮癌有关的生物学标记物,对其早期诊断、治疗和判断预后具有十分重要的意义。近年来,有关膀胱尿路上皮癌中分子生物学标记物的研究较多。本研究采用免疫组化的方法检测CyclinD1、P53和CK20在正常尿路上皮、尿路上皮良性增生、异型增生及膀胱尿路上皮癌中的表达情况,旨在探讨其与膀胱尿路上皮癌发生、发展的关系。
1 材料与方法
1.1 临床标本 安徽省立医院病理科2009—2013年经病理诊断的尿路上皮良性增生8例、异型增生10例、膀胱尿路上皮癌标本35例,其中膀胱尿路上皮癌患者中,男性28例,女性7例,年龄42~92岁,平均年龄61岁。病理分级按WHO分类标准分为低级别和高级别,8例尿路上皮异型增生、23例非浸润性膀胱尿路上皮癌(其16例低级别,7例高级别),12例浸润性膀胱尿路上皮癌(其中7例低级别,5例高级别)由2位高级职称病理专家使用双盲法再次复查证实,15例行全膀胱切除术,20例行保留膀胱手术,术后均随访1年以上。8例正常膀胱组织取膀胱良性病变周围黏膜,8例良性病变分别为4例内翻性乳头状瘤,4例腺性膀胱炎。
1.2 方法 标本经10%中性缓冲福尔马林固定、石蜡包埋、3μm连续切片,分别进行HE染色和免疫组化染色。CyclinD1、P53和CK20鼠源单克隆抗体(中杉公司)的免疫组化染色步骤参照说明书进行;二氨基联苯胺(DAB)显色;苏木素复染;脱水、透明;中性树胶封片;以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
1.3 结果判定 CyclinD1、P53以细胞核染成棕黄色或棕褐色为阳性结果,其中CyclinD1染色时,尿路上皮全层下1/3细胞核着色视为阴性;P53只有细胞核呈棕黄色时才视为阳性。CK20以细胞膜着棕黄色或棕褐色为阳性结果。
1.4 统计处理 对各组中CyclinD1、P53和CK20的表达情况采用SPSS13.0软件进行χ2检验,P<0.05有统计学意义。
2 结果与分析
CyclinD1、P53、CK20在各组研究对象中的表达情况见表1及图1。
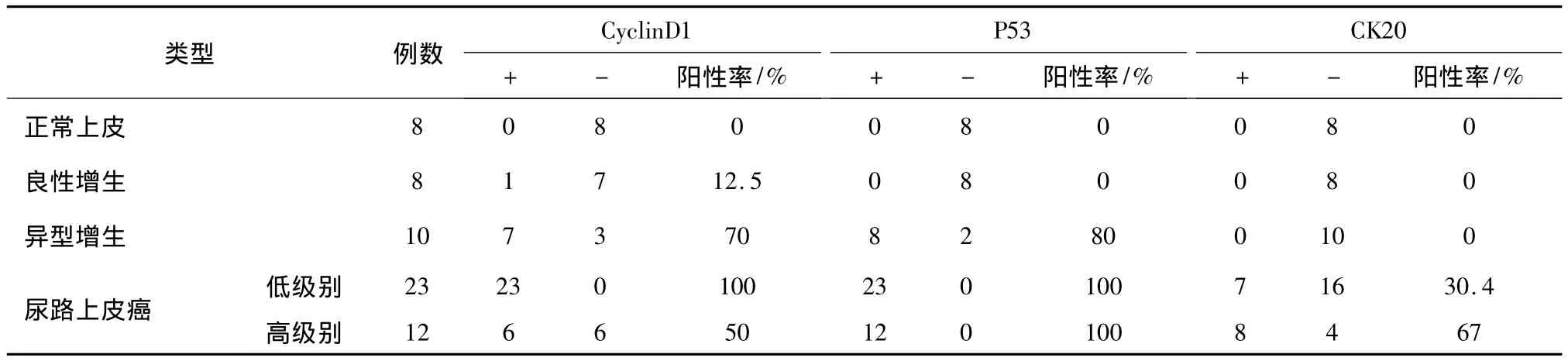
表1 CyclinD1、P53及CK20在正常尿路上皮及尿路上皮病变中的表达
3 讨论
CyclinD1是细胞周期G1/S期过渡检查点的一个重要基因,在细胞信号通路上属于癌基因STAT3的一个下游靶基因及该信号通路中的关键因子,CyclinD1调控细胞增殖是通过刺激细胞周期素依赖性激酶4(CDK4)从而介导Rb基因蛋白产物的磷酸化,解除Rb对转录因子E2F的抑制效应,使细胞从G1期进入S期的分裂程序的。因此,CyclinD1的表达上调可以使细胞进入失控性生长[1-2]。本实验及曾文利[3]研究发现,CyclinD1在膀胱尿路上皮癌及异型增生组织中表达强于良性增生及正常尿路上皮,推测其机制很可能是由于CyclinD1过表达导致尿路上皮细胞自主生长,从而发生恶性转化,成为肿瘤发生的早期事件[3-5],在低级别与高级别尿路上皮癌中CyclinD1表达情况有显著差异,推测其原因可能是随着低级别尿路上皮癌进一步向高级别发展,CyclinD1基因的作用逐渐减弱,而突变型P53及其他癌基因的作用占主导地位;或者在高级别尿路上皮癌的发生过程中,CyclinD1基因仅占次要的作用等;P53是常见的抑癌基因,位于人类17p13.1,全长约16~20 kb。很多临床实验证实P53的突变与一些肿瘤的发生密切相关[6-9],在膀胱癌中的表达明显高于正常组织,并且与肿瘤的分级相关[10],本实验也得出相似的结论,P53基因表达与膀胱尿路上皮癌的发生、生长、浸润、转移等均有相关性[11],其机制可能是P53基因突变其空间构象发生改变,失去对细胞增殖、生长、凋亡的正常调控作用,并可能变成癌基因,能够诱导和促进肿瘤组织中血管内皮生长因子(VEGF)的表达,促进肿瘤血管生成,导致肿瘤的演进、转移等。CK20是构成细胞骨架的重要物质,为I型角蛋白的一种,含有424个氨基酸,分子量48 553,一般仅仅表达于上皮细胞。正常情况下尿路上皮中仅表层伞细胞或偶尔情况下中间层细胞表达CK20[12],有人发现在尿路上皮伞细胞浆中有大量呈纤维状的CK20染色体,随着上皮细胞的恶性转化,肿瘤性尿路上皮细胞中CK20的表达失去这种模式,这是细胞角蛋白一系列改组后重建过程,这种现象可能是上皮细胞为了适应形态和功能变化而发生的改变。本研究和既往的研究均发现CK20在膀胱尿路上皮病变中的表达具有较高的特异性和敏感性,而且有“仅表达在恶性尿路上皮”的特点[13],表达强度往往与膀胱尿路上皮癌的分级有明显的关系[12]。Moll等[14]用免疫组化方法研究711例原发和转移性肿瘤也发现,CK20阳性肿瘤细胞的数目在不同级别尿路上皮癌组织中变化很大,其不同染色强度,可能反映出肿瘤细胞侵袭力和转移力的强弱,与尿路上皮癌的分级相关,由于CK20在膀胱尿路上皮癌中的重要价值,有人通过检测尿液中CK20 mRNA的量来监测肿瘤是否早期复发[15],具有重要的临床价值。
[1]Nadal A,Cardesa A.Molecular biology of laryngeal squamous cell carcinoma[J].Virchows Arch,2003,442(1):1-7.
[2]Ohtani N,Yamakoshi K,Takahashi A,et al.The p16INK4a- RB pathway:molecular link between cellular senescence and tumor suppression[J].Med Invest,2004,51(3/4):146-153.
[3]曾文利.CyclinD1在膀胱尿路上皮癌中的表达及意义[J].中国组织化学与细胞化学杂志,2011,20(4):355-357.
[4]李 彬,徐 涛,赵 晖,等.P27,Cyclin D1在膀胱尿路上皮癌中的表达及其意义[J].实用医学杂志,2006,22(22):2607-2609.
[5]詹自力,苟 欣.P27、Cyclin D1在膀胱移行细胞癌中的表达及其临床意义[J].当代医学,2010,16(24):31-32.
[6]Takeba Y,Kumai T,Matsumoto N,et al.Irinotecan activates P53 with its active metabolite,resulting in human hepatocellular carcinoma apoptosis[J].J Pharmacol Sci,2007,104(3):232-242.
[7]Bau DT,Tsai MH,Lo YL,et al.Association of P53 and p21(CDKN1A/WAF1/CIPI)polymorphisms with oral cancer in Taiwan patients[J].Anticancer Res,2007,27(3B):1559-1564.
[8]Jung JT,Kim DH,Kwak EK,et al.Clinical role of Bcl-2,Bax,or P53 overexpression in Periph- eral T- cell lymphomas[J].Ann Hematol,2006,85(9):575-579.
[9]Farazi PA,Glickman J,Horner J,et al.Cooperative interactions of P53 mutation,telomere dysfunction,and chronic liver damage in hepatocellular carcinoma progression[J].Cancer Res,2006,66(9):4766-4773.
[10]冀建波,程育胜,姚 宏.S100A4和P53蛋白在膀胱尿路上皮癌中的表达及其临床意义[J].山西医药杂志,2013,42(5):510-511.
[11]董 锐,朱朝辉,万 峰,等.Survivin和突变型P53在膀胱尿路上皮癌组织中的表达及其临床意义[J].中华实验外科杂志,2013,30(2):386-388.
[12]丁佩芬,戎丹平,顾 霞,等.P53、CK20表达与膀胱尿路上皮癌分级的关系[J].肿瘤基础与临床,2013,26(6):461-463.
[13]余东海,周四维,章慧平,等.CK20、Cjun在膀胱肿瘤的表达和临床意义[J].临床泌尿外科杂志,2005,20(5):288-290.
[14]Moll R,Schiller DL,Franke WW.Identification of protein IT of the intestinal cytoskeleton as a novel type I cytokeratin with un2 usual properties and expression patterns[J].Cell Biol,1990,111(2):567-580.
[15]朱 峰,张 艳,李 军,等.尿核基质蛋白22和细胞角蛋白20mRNA联合监测在膀胱肿瘤复发中的意义[J].重庆医学,2014,43(14):1703-1706.

