简单包覆改性LiMn2O4正极材料在高温下的电化学性能
张 静,王月磊,,3 ,刘浩涵,3,邱胜杰,蔡 聪,宓一鸣
(1.上海市纳米科技与产业发展促进中心实验室,上海200237;2.上海工程技术大学化学化工学院,上海201620;3.中国科学院 上海微系统与信息技术研究所,上海200050)
0 引 言
锂离子电池凭借其比能量高、电压高、工作温度范围宽、储存寿命长等优点,在数码产品及汽车领域的应用越来越广泛[1]。锂离子电池正极材料在整个电池体系中占有举足轻重的地位,其成本在电池的所有成本(包括制造、销售、运输、储存等成本)中高达21%[2]。作为锂源供给体,锂离子电池正极材料应具有比容量高、脱嵌锂动力学性能好、循环及储存结构稳定性好等特点。目前常见的正极材料主要有LiCoO2、LiMn2O4、LiFePO4、LiNixCoyMn1-x-yO2等[3],其中LiCoO2是目前商业化程度最大的正极材料,但钴的毒性大、资源贫乏且价格昂贵,不宜推广应用[4];LiNixCoyMn1-x-yO2的比容量高,对环境污染较小,但合成成本较高,其商业化进程一直受到阻碍[5];LiFePO4的结构稳定性好,但电导率较低,在高倍率下充放电时,可逆容量下降很快,其应用与发展也一直受到限制[6]。尖晶石LiMn2O4具有资源丰富、价格较低(锰的价格约为钴的1/40、镍的1/20)、电压平台较高和环境友好等优点,被认为是最具应用潜力的正极材料之一[7-8],但其在高温下容量下降较快的缺点限制了它的大规模商业化推广[9]。导致LiMn2O4正极电池容量快速下降的主要原因为[10-12]Mn3+的姜-泰勒效应、锰离子在电解液中的溶解、充放电循环时晶体结构的损坏。LiMn2O4表面的 Mn3+发生姜-泰勒效应后变为Mn2+和 Mn4+,而 Mn2+可溶解于电解液中,致使LiMn2O4的晶体结构从表层开始崩塌,从而导致其容量下降。在高温下姜-泰勒效应更加剧烈,从而加剧了LiMn2O4容量的下降。
为了解决以上问题,常采用的办法是对LiMn2O4粉体先进行表面包覆改性。传统的包覆方法主要有溶胶凝胶法、共沉淀法、水热法等,包覆物主要为金属氧化物、磷酸盐、锂盐等。传统包覆方法大多需要将LiMn2O4颗粒置于偏酸性的溶液中,但LiMn2O4颗粒较易被酸性介质腐蚀而影响性能。为此,作者采用一种新型、简单的包覆方法(不需要进行pH或温度的调节),利用乙醇易挥发的原理在LiMn2O4颗粒表面形成均匀的钟乳石状NiO包覆层,乙醇的表面张力较小能更好地浸润到微米级LiMn2O4颗粒的表面,使包覆变得更加简单、有效;并以该材料作为电池的正极研究了它在高温下的电化学性能。
1 试样制备与试验方法
试验用原料为 Ni(CH3COO)2·4H2O(分析纯)和尖晶石LiMn2O4粉体(河北强能锂电科技有限公司,粒径为1~3μm,纯度大于99.9%),试剂为无水乙醇(分析纯)。首先将Ni(CH3COO)2·4H2O溶解在无水乙醇中,然后将LiMn2O4粉体加入到以上溶液中,确保NiO与LiMn2O4的质量比为2∶100。在室温下使用电磁搅拌器剧烈搅拌5h至无水乙醇完全挥发,得到黑色凝胶;然后将凝胶放入90℃的烘箱中烘干,得到黑色固体,再将固体研磨后进行400℃×7h+600℃×3h的高温煅烧。
使用D/max-2000PC X型 X射线衍射仪(XRD)分析试样的晶相以及晶体的结晶度,铜靶,电压40kV,电流40mA,扫描速度为2(°)·min-1;采用 Hitachi-S4700型场发射扫描电镜(FESEM)观察试样表面的微观形貌,并用其附带的能谱仪(EDS)进行微区元素分析;用JEOL 200CX型透射电镜(TEM)分析晶体的结构并观察颗粒的表面形貌;采用PHI 5000CESCA System型 X射线光电子能谱仪(XPS)分析试样表面各元素的价态以及相对含量,铝/镁靶,高压 14.0kV,功率250W,真空度小于1.33×10-6Pa;采用 Auger-Scan3.21或XPSPeak4.1软件进行分峰拟合。
使用CR2025型扣式电池研究电极材料在高温环境(55℃)下的电化学性能。电池正极的制备方法如下:将活性物质(包覆NiO前后的LiMn2O4粉体)(加入量80%,质量分数,下同)、Super P炭黑(10%)、KS-6 石墨(5%)和PVDF聚偏氟乙烯(5%)溶解在NMP(N-甲基吡咯烷酮)溶液中,待分散均匀后将其均匀涂抹于铝箔上,并在120℃的烘箱中烘干12h;将单面涂布的电极片冲压成直径为1.4cm的圆片;在氩气气氛的手套箱中,将电极片与锂片用Celgard®2320隔膜隔开,然后置入2025型扣式电池壳中;向其中注入由1mol·L-1LiPF6EC(碳酸乙烯酯)、DMC(碳酸二甲酯)、DEC(碳酸二乙酯)按体积比为1∶1∶1配成的电解液;最后在扣式电池封口机(武汉千里马电源机械制造有限公司)上对电池进行封口。电池的充放电性能测试在BTS-5V5mA型电池性能测试仪上进行,检测电池的不同倍率充放电容量、循环性能,并记录充放电曲线、循环性能曲线等。
2 试验结果与讨论
2.1 物相组成
由图1可看出,包覆NiO前后的LiMn2O4均为完美的尖晶石结构[13],XRD谱并没有发生明显变化。这是因为NiO的相对含量较低,在XRD谱中显示不出来。

图1 包覆NiO前后LiMn2O4粉体的XRD谱Fig.1 XRD patterns of LiMn2O4particles without and with NiO coating
2.2 微观形貌
从图2可以看出,包覆NiO前后LiMn2O4粉体的直径均为1~3μm;包覆前的表面较光滑,包覆后的表面则变得粗糙,且凹凸不平。由此可判断包覆NiO后的LiMn2O4粉体表面覆盖了一次包覆物。
由图3可看出,包覆NiO后LiMn2O4粉体表面的主要元素为锰和镍,其中镍元素是包覆前所没有的;镍元素均匀地分布在LiMn2O4颗粒表面,且锰与镍的物质的量比为99.47∶0.53。
由图4可见,包覆后,NiO非常均匀地包覆在LiMn2O4颗粒表面,形成了钟乳石状的包覆层;而未包覆NiO的LiMn2O4颗粒表面十分光滑,晶格条纹一直延伸至晶粒表面的边界处,可见其洁净度良好,测量其晶格条纹可知其晶面间距为0.237nm,对应 LiMn2O4晶体的(222)晶面;钟乳石状突起物的晶面间距为0.241 8nm,对应NiO晶体的(111)晶面。由此可判断LiMn2O4颗粒外层的包覆物为NiO。
2.3 XPS谱
由图5可见,包覆NiO前,锰元素2p3/2轨道峰的横坐标分别为642.22eV和642.35eV[14]。分别对包覆前后LiMn2O4粉体进行 Mn3+(641.7eV)和Mn4+(642.7eV)分峰,所得两离子峰的积分面积分别如图中两种虚线所示。对于包覆NiO前的LiMn2O4粉体,其表面Mn3+和Mn4+的物质的量分数基本相等(分别为50.7%和49.3%),而包覆后这两种离子的物质的量分数分别为35.4%和64.6%。两离子峰相对面积比值的不同决定了两种材料表面锰的平均价态,通过计算可知包覆NiO前后LiMn2O4粉体表面锰的平均价态分别为+3.49和+3.64。包覆前后LiMn2O4粉体表面 Mn3+与Mn4+相对面积比值的不同是因为,在高温热处理过程中包覆层中的镍元素扩散到了LiMn2O4颗粒的表层,并在其表层结构中以 Ni2+代替了一部分Mn3+的位置,并形成了LiNixMn2-xO4的尖晶石结构镍锰材料(x的值相对较小)。

图2 包覆NiO前后LiMn2O4粉体的SEM形貌Fig.2 SEM photoes of LiMn2O4particles without(a)and with(b)NiO coating

图3 包覆NiO后LiMn2O4粉体的元素面分布及包覆前后的EDS谱Fig.3 Mn(a)and Ni(b)elements map distribution of LiMn2O4particles with NiO coating and EDS spectra of LiMn2O4particles without(c)and with(d)NiO coating

图4 包覆NiO前后LiMn2O4颗粒的HR-TEM形貌Fig.4 HR-TEM photoes of LiMn2O4particles without(a,c,e)and with(b,d,f)NiO coating:(a-b)at low magnification;(c-d)at middle magnification and(e-f)at high magnification
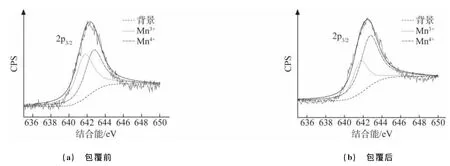
图5 包覆NiO前后LiMn2O4粉体表面锰元素的XPS谱Fig.5 XPS patterns of Mn element on the surface of LiMn2O4particles wihout(a)and with(b)NiO coating
2.4 电化学性能
由图6可以看出,对于以包覆NiO前的LiMn2O4作为正极的电池,其首次放电曲线有两个明显的特征电压平台[15],且随着循环次数增加,放电曲线扭曲变形比较严重,比容量和放电电压都出现了较大程度的衰减;以包覆NiO后的LiMn2O4作为正极的电池的放电曲线,在首循环时有两个明显的特征电压平台变得相对模糊,且随着循环次数增加,放电曲线形状保持得较为良好,比容量和放电电压的衰减较包覆前的要低很多。结构的稳定程度决定了放电电压如何变化,包覆NiO前的LiMn2O4正极材料的两个特征电压平台是由锂离子的有序化排列引起的两个立方相共存导致的。包覆后的首次放电曲线的特征平台变得模糊是由于材料在热处理过程中,Ni2+扩散到LiMn2O4材料内部,代替了部分Mn3+的位置,从而在一定程度上抑制了两个立方相共存的发生[16]。此外,NiO包覆层阻止了电解液与活性物质的直接接触,有效抑制了锰的溶解,从而在很大程度上提高了LiMn2O4材料晶体结构的稳定性。
由图7(a)可见,包覆NiO前后LiMn2O4正极材料在55℃下的首循环放电比容量分别为105.037,104.643mAh·g-1,包覆 NiO 后的稍有下降;这是由于LiMn2O4粉体被NiO包覆后,活性物质的比例有所下降。在55℃经200次2C循环后,包覆NiO前的LiMn2O4正极材料的比容量只剩余88.128mAh·g-1,容量保持率为83.90%;虽然NiO包覆LiMn2O4正极材料的初始比容量相对较低,但其经200次2C循环后的比容量仍剩余96.998mAh·g-1,容量保持率高达92.69%,较包覆前的提高了8.79%。这主要是由于NiO包覆层对LiMn2O4材料起到了隔离保护作用,防止由于锰离子从颗粒表面扩散而导致的容量降低以及晶体结构崩塌,从而使LiMn2O4材料在高温下仍能保持良好的结构稳定性。
由图7(b)可见,包覆NiO前后LiMn2O4正极材料在0.5C下的首循环放电比容量分别为109.603,108.732mAh·g-1,随着充放电电流的增加,包覆NiO前后LiMn2O4正极材料的放电比容量均有所下降,但是后者的倍率性能明显较前者的更高,在10C时仍可以放出97.463mAh·g-1的比容量,而前者只能放出82.86mAh·g-1的比容量,其容量保持率分别为75.60%和89.64%(包覆后比包覆前提高了14.04%)。这主要是由于LiMn2O4颗粒表面NiO包覆层的保护作用,以及因颗粒表层中Ni2+取代了部分Mn3+的位置而使得表层部分的Mn4+增多,提高了LiMn2O4材料的结构稳定性[7]。
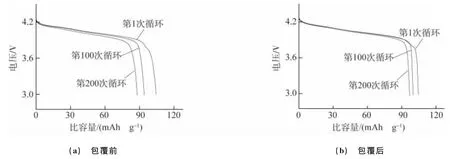
图6 包覆NiO前后LiMn2O4正极材料在55℃下的放电曲线Fig.6 Discharge curves of LiMn2O4anode materials without(a)and with(b)NiO coating at 55 ℃

图7 包覆NiO前后LiMn2O4正极材料在55℃下的循环性能曲线与倍率性能曲线Fig.7 Cycle performace curves(a)and rate performance curves(b)of LiMn2O4anode materials wihout and with NiO coating at 55℃
3 结 论
(1)利用无水乙醇易挥发的特性成功地将NiO包覆于LiMn2O4粉体表面,在热处理过程中镍扩散至LiMn2O4颗粒的表层;包覆后LiMn2O4粉体表面呈钟乳石状突起,晶体结构没有发生改变。
(2)与包覆前相比,NiO包覆LiMn2O4正极材料在高温下经200次2C循环后的循环保持率提高了8.79%;在55℃下依次经10次0.5C、10次1C、10次2C、10次5C和10次10C电流的循环后,NiO包覆LiMn2O4正极材料的容量保持率比包覆前的提高了14.04%。
[1]赵智泉,刘庆雷,黄大成,等.锂离子电池负极用硅/碳纳米复合材料制备方法和性能的研究进展[J].机械工程材料,2012,36(9):1-7.
[2]见姬,周文娟,徐国祥,等.锂离子电池正极材料行业分析[J].科技情报开发与经济,2014,24(4):146-149.
[3]黄可龙,王兆翔,刘素琴.锂离子电池原理与关键技术[M].北京:化学工业出版社,2008.
[4]SU L W,JING Y,ZHOU Z.Li ion battery materials with core-shell nanostructures[J].Nanoscale,2011,3:3967-3983.
[5]AMATUCCI G,PASQUIER A D,BLYR A,et al.The elevated temperature performance of the LiMn2O4/C system:failure and solutions[J].Electrochim Acta,1999,45:255-259.
[6]AOSHIMA T,OKAHARA K,KIYOHARA C,et al.Mechanisms of manganesespinels dissolution and capacity fade at high temperature[J].J Power Sources,2001,97/98:377-380.
[7]PITCHAI,R.THAVASI V,MHAISALKAR S G,et al.Nanostructured cathode materials:a key for better performance in Li-ion batteries[J].J Mater Chem,2011,21:11040-11051.
[8]XIA Y,ZHOU Y,YOSHIO M.Capacity fading on cycling of 4VLi/LiMn2O4cells[J].J Electrochem Soc,1997,144:2593-2560.
[9]江剑兵,杜柯,曹雁冰,等.机械活化氧化法制备锰酸锂及其性能研究[J].功能材料,2014,45(8):08120-08123.
[10]KOMABA S,KUMAGAI N,KATAOKA Y.Influence of manganese(II),cobalt(II),and nickel(II)additives in electrolyte on performance of graphite anode for lithium-ion batteries[J].Electrochim Acta,2002,47:1229-1239.
[11]LI X F,XU Y L,WANG C L.Suppression of Jahn-Teller distortion of spinel LiMn2O4cathode[J].J Alloy Compd,2009,479:310-313.
[12]DARUL J,NOWICKI W,LATHEC,et al.Observation of phase transforma-tions in LiMn2O4under high pressure and at high temperature by in situ X-ray diffraction measurements[J].Radiat Phys Chem,2011,80:1014-1018.
[13]HOSONO E,KUDO T,HONMA I,et al.Synthesis of single crys-talline spinel LiMn2O4nanowires for a lithium ion battery with high powerdensity[J].Nano Lett,2009,9:1045-1051.
[14]WEI Y J,YAN L Y,WANG C Z,et al.Effects of Ni doping on[MnO6]octahedron in LiMn2O4[J].The Journal of Physical Chemistry:B,2004,108:18547-18551.
[15]LUO J Y,CHENG L,XIA Y Y.LiMn2O4hollow nanosphere electrode material withexcellent cycling reversibility and rate capability[J].Electrochem Commun,2007,9:1404-1409.
[16]HWANG B J,TSAI Y W,SANTHANAM R,et al.Evolution of local electronic and atomic structure of Co-doped LiMn2O4cathode material for lithium rechargeable batteries[J].Journal of Power Sources,2003,123:206-215.

