山核桃青皮萃取物抗内源性H2O2致血管内皮细胞凋亡及机制研究
赵行宇, 秦迎新, 沈 楠, 赵丽静, 朱文赫, 陈默然, 张 巍
(吉林医药学院,吉林吉林132013)
山核桃青皮萃取物抗内源性H2O2致血管内皮细胞凋亡及机制研究
赵行宇, 秦迎新, 沈 楠, 赵丽静, 朱文赫, 陈默然, 张 巍
(吉林医药学院,吉林吉林132013)
目的 探讨山核桃青皮萃取物对过氧化氢 (H2O2)诱导血管内皮细胞凋亡的影响及可能机制。方法 以葡萄糖氧化酶 (GOX)催化生成内源性H2O2制作内皮细胞损伤模型;加入不同剂量的山核桃青皮萃取物,观察细胞形态学改变;Annexin/PI双标记染色,流式细胞仪检测细胞凋亡率;Western blot检测Caspase-3及Bcl-2和Bax蛋白表达量。结果 山核桃青皮萃取物改善了内源性H2O2导致的内皮细胞形态变化;流式检测结果显示萃取物对细胞模型凋亡有明显的抑制作用;电泳结果显示Caspase-3和Bax表达量降低,Bcl-2表达增加,随剂量增加,作用增加,具有剂量依赖性。结论 山核桃青皮萃取物对内源性H2O2诱导的血管内皮细胞凋亡有抑制作用,其机制可能通过启动Caspase途径实现。
山核桃;细胞凋亡;过氧化氢
血管内皮损伤是动脉粥样硬化等多种疾病发生的重要因素,在针对血管内皮损伤及保护作用进行的研究中,关于中药提取成分的作用及机制的研究,近年有所增加[1-6]。内皮细胞损伤的原因中,氧化应激受到一些研究者的关注,因为氧化应激不仅可以直接导致细胞损伤,出现凋亡,而且多种凋亡刺激都伴随有氧化应激或者增加了细胞内活性氧集团ROS水平[7-8]。研究也表明,通过抑制氧化应激可以抑制细胞凋亡,许多凋亡抑制剂都是通过增强细胞抗氧化的能力发挥作用,或者其本身就具有抗氧化活性。山核桃青皮是山核桃未成熟果实的青果皮,具有清热解毒、抑菌镇咳及抗癌等作用[7-10]。相关研究表明:山核桃青果皮萃取物在体外具有抗氧化活性[11-13],但针对内皮氧化应激损伤后,萃取物对其的作用及相关机制未见报道。本研究以GOX催化葡萄糖产生内源性H2O2制作内皮细胞损伤模型,观察山核桃青皮萃取物干预后,氧化应激损伤的血管内皮细胞凋亡变化,并对这一作用的可能机制进行探讨,为后续的研究提供进一步的证据。
1 材料方法
1.1 药物萃取 山核桃采自吉林省林区,室温下晾干。将核桃果实处理后得核桃青皮,用80%乙醇回流萃取30 min,于低温回收溶剂,萃取物用水分散后用乙酸乙酯萃取,回收溶剂得萃取物0.324 kg,采用普鲁士蓝法测定总酚的量,极性部位总酚的量为18.2%。收集于旋转蒸发瓶中蒸干,过滤除菌,萃取物称重以DMSO溶解终质量浓度为500μg/mL[14]。
1.2 试剂 胎牛血清由杭州四季青公司生产;高糖DMEM培养基购自美国GIBCO公司;胰蛋白酶(Trypsin)、过氧化氢检测试剂盒购于艾美捷科技有限公司,Annexin-V/PI双染凋亡试剂盒、葡萄糖氧化酶(GOX)、Caspase-3、Bcl-2和Bax抗体购自美国Sigma公司。
1.3 萃取物对葡萄糖氧化酶活性的影响 取24孔版,每培养孔加入高糖DMEM培养基,分5组,复孔数为5,置培养箱静置1 h,各组分别加入50μL培养基、10 mU GOX、10mU GOX+25μg/mL萃取物、10 mU GOX+50 μg/m L萃取物、10 mU GOX+100μg/mL萃取物,在1、3、6、12 h按试剂盒的检测方法测量过氧化氢产生量。
1.4 细胞株及培养 人血管内皮细胞系 (EVC-304),购于中科院上海细胞库,由吉林医药学院科学实验室保存。细胞培养于高糖DMEM培养液中,培养条件为在5%CO2、湿度95%。每2天更换1次培养液,每周按1:3传代。
1.5 内皮细胞形态学观察 取对数生长期的细胞,培养24 h,分成5组,正常对照组、10 mU GOX组、10 mU GOX+25μg/mL萃取物组、10 mU GOX+50μg/mL萃取物组、10 mU GOX+100μg/mL萃取物组,用DMEM培养基稀释液分别培养24 h后,倒置显微镜下观察内皮细胞的形态学改变。
1.6 流式细胞仪检测细胞凋亡 细胞处理同 “1.4”项,12 h后用胰酶消化,PBS洗涤细胞2次,在15 000 r/m in条件下离心10min,弃去上清液;按试剂盒说明书分别加入AnnexinⅤ-FITC和PI,用流式细胞仪检测细胞凋亡率。
1.7 Western blot检测Caspase-3及Bcl-2和Bax蛋白表达把上述分组培养的细胞用裂解液裂解后,收集提取细胞蛋
白,使用BCA法测蛋白的量。上样量取60μg蛋白,设备为SDS-PAGE电泳仪,电转凝胶上的蛋白至PVDF膜,兔抗人Caspase-3、Bcl-2及Bax抗体稀释至1:1 000,4℃冰箱中孵育过夜,再用辣根过氧化物酶标记的二抗孵育2 h后,曝光显影。以β-actin为内参,数据以正常对照组基准,计算各个样品相对于正常对照组蛋白量的相对表达量。
1.8 统计学方法 统计分析软件为SPSS 13.0版本,不同剂量组数据先进行方差齐性检验,再进行单因素方差分析和Student-Newman-Keuls(SNK)检验。
2 结果
2.1 萃取物对葡萄糖氧化酶活性的影响 葡萄糖氧化酶在不同质量浓度萃取物条件下,产生过氧化氢的量见表1。可见与正常对照组相比,不同质量浓度萃取物和GOX组反应产生过氧化氢浓度明显增加,差异显著 (P<0.01),同一时间点过氧化氢的量随萃取物质量浓度增加所有下降,但组间没有显著性差异,不同时间点过氧化氢的量没有显著性差异。
表1 不同萃取物质量浓度对葡萄糖氧化酶催化产生H2O2的量的影响

表1 不同萃取物质量浓度对葡萄糖氧化酶催化产生H2O2的量的影响
注:与正常对照组比较,**P<0.01
21.5±4.3 20.9±5.1 20.3±5.3 19.4±6.2 10 mU GOX 53.3±5.2** 48.3±6.8** 50.3±4.9** 52.3±5.9**10 mU GOX+25μg/m L山核桃青皮萃取物 52.4±6.1** 49.3±4.9** 49.6±5.7** 49.5±6.3**10 mU GOX+50μg/m L山核桃青皮萃取物 50.5±5.7** 48.3±5.0** 48.7±5.8** 48.9±6.8**10 mUGOX+100μg/mL山核桃青皮萃取物 48.8±5.9** 47.1±5.6** 48.5±6.0** 50.1±6.6 1 h 3 h 6 h 12 h正常对照组组别H2O2/(μmol.L-1)**
2.2 萃取物对EVC-304细胞形态的影响 正常对照组(图1A)细胞生长良好,贴壁生长,呈多角形或长梭形,呈鹅卵石样铺满底层。而10 mU GOX组(图1B)细胞在作用24 h后,细胞胞体变小、间隙增大,细胞变圆收缩,胞浆透明,失去细胞间连接,大多数细胞悬浮脱落;不同质量浓度萃取物与10mU GOX混合培养后(图1C~图1E)细胞形态与状态与正常对照相似,但随剂量增加,细胞形态改善越好,具有剂量依赖性。

图1 各组EVC-304细胞形态(×400)
2.3 萃取物对细胞凋亡的影响 各组内皮细胞的凋亡百分比见表2,由表可见,正常对照组的凋亡最少,10 mU GOX组凋亡最多,与正常对照组比较,其它各组差异显著 (P<0.01);与10 mU GOX组比,其它各组差异显著 (P<0.05,P<0.01);不同给药剂量组凋亡量介于正常对照组与10 mU GOX组之间,随剂量增加,凋亡增加。具有剂量依赖性。
表2 各组对EVC-304细胞凋亡的影响

表2 各组对EVC-304细胞凋亡的影响
注:与正常对照组比较,**P<0.01;与10 mU GOX组比较,#P<0.05,##P<0.01
组别 细胞凋亡率/%正常对照组 3.15±1.07##10 mUGOX组 46.31±4.85**10 mUGOX+25μg/mL山核桃青皮萃取物组 9.48±3.17**##10 mUGOX+50μg/mL山核桃青皮萃取物组 18.59±5.24**##10 mU GOX+100μg/m L山核桃青皮萃取物组 32.65±6.13**#
2.4 萃取物对Caspase-3及Bcl-2和Bax蛋白表达 各组内皮细胞的Caspase-3及Bcl-2和Bax蛋白相对表达情况见图2和表3。结果可知,正常对照组与GOX组表达量存在明显差异 (P<0.01),与正常对照组相比,不同剂量萃取物导致Caspase-3蛋白表达升高,25μg/mL组差异显著(P<0.05);Bcl-2蛋白表达降低,25μg/mL和50μg/mL山核桃青皮萃取物组差异显著 (P<0.01,P<0.05);Bax蛋白表达升高,25μg/mL和50μg/mL山核桃青皮萃取物组差异显著(P<0.01,P<0.05)。与GOX组相比,使用萃取物后,Caspase-3蛋白表达下降,不同剂量给药组差异显著(P<0.05,P<0.01);Bcl-2蛋白表达上升,50μg/mL和100μg/mL山核桃青皮萃取物组差异显著 (P<0.05,P<0.01);Bax蛋白表达下降,100μg/mL山核桃青皮萃取物组差异显著 (P<0.01)。随萃取物剂量增加,变化越明显,具有剂量依赖特性。
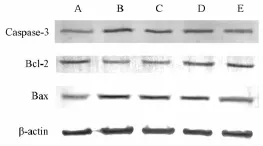
图2 萃取物对Caspase-3、BcI-2和Bax蛋白表达的影响
表3 各组Caspase-3及BcI-2和Bax蛋白相对表达量

表3 各组Caspase-3及BcI-2和Bax蛋白相对表达量
注:与10 mU GOX组比较,*P<0.05,**P<0.01;与正常对照组比较,#P<0.05,##P<0.01
Caspase-3 Bcl-2 Bax正常对照组10 mU GOX组组别1** 2.31±0.98##1** 0.31±0.16##1** 3.35±1.05##10 mUGOX+25μg/mL山核桃青皮萃取物组 2.01±0.87*# 0.43±0.17## 2.83±0.93##10 mU GOX+50μg/m L山核桃青皮萃取物组 1.65±0.74** 0.55±0.17*# 2.11±0.89#10 mU GOX+100μg/m L山核桃青皮萃取物组 1.29±0.34** 0.65±0.16** 1.75±0.90**
3 讨论
在体内正常水平的H2O2在具有一定意义,如参与免疫和信号传导的过程[15-18]。但在一些异常状态时,H2O2产生过多,就会产生破坏作用,损伤人体正常的组织细胞,损伤核酸结构,诱发突变及细胞凋亡等改变,进而引发老年痴呆症、心脏病、帕金森病和肿瘤等多种疾病[19-22]。在我们的研究中,针对人血管内皮细胞首次采用了酶催化,缓慢而持久的产生内源性H2O2诱导损伤,避免了外源性H2O2损伤严重且迅速消失、无法模拟体内H2O2损伤的缺点。从不同质量浓度的萃取物与GOX在高糖培养液中生成过氧化氢的实验结果看,过氧化氢的量比较稳定,至于高剂量萃取物质量浓度下过氧化氢的量的下降趋势,可能是由于酚类物质自身的抗氧化作用导致的过氧化氢分解造成的,但由于对过氧化氢的量的影响尚未达到显著的差异,该损伤模型可以用于实验研究。实验结果也显示:加入GOX后,细胞形态上改变明显,流式结果也显示细胞出现大量的凋亡,说明,加入GOX后,可以有效的模拟内源性H2O2损伤造成的凋亡。使用不同质量浓度的萃取物进行干预的结果表明,核桃青皮萃取物对内源性H2O2损伤导致的凋亡作用具有抑制作用,说明萃取物对由内源性H2O2损伤的血管内皮细胞具有保护作用,并且在一定剂量范围内,质量浓度越高抑制作用也越强,说明这种保护作用有一定的剂量依赖特点。同时我们也观察到萃取物干预后,Caspase-3及Bax蛋白表达下降、Bcl-2蛋白表达增加,这说明,萃取物的保护作用与对凋亡相关蛋白Bcl-2和Bax表达的调节以及Caspase凋亡通路有关,而且这种变化也具有剂量依赖的特点,说明萃取物可以影响凋亡相关蛋白的表达,实现对凋亡通路的调控。Bax蛋白在对Caspase凋亡通路的影响上,表现为促进凋亡的发生,其表达的增加会增加Bax蛋白的同源结合,激活Caspase凋亡通路,引发凋亡。而Bcl-2蛋白与Bax竞争异源结合,抑制Bax蛋白对Caspase凋亡通路的激活,发挥对H2O2损伤细胞的保护作用。实验中Caspase-3蛋白表达下降的结果也说明,除了上述的抑制凋亡作用外,其还可以通过下调Caspase凋亡通路的蛋白,来实现对细胞的保护作用。但这两种作用之间有无相互影响,以及是否还有其他的原因,仍然需要进一步的研究。
[1] 王如科,孙源源,韩建一,等.银杏叶提取物对过氧化氢刺激下的血管内皮细胞的影响[J].现代生物医学进展,2014,14(26):5038-5042.
[2] 马桂鑫,赵文文,陈修平.血管内皮细胞损伤模型及中药保护作用研究进展[J].中草药,2014,45(2):276-280.
[3] 刘海云,崔艳茹,伍庆华,等.菟丝子总黄酮对过氧化氢损伤的血管内皮细胞的保护作用[J].中国实验方剂学杂志,2013,19(18):215-218.
[4] 钱卫东,方祝元,陈 艺,等.降脂抗氧化合剂对高血压合并高脂血症患者血管内皮功能的影响[J].中成药,2014,36(5):929-933.
[5] 杨金果,李运伦,周洪雷.钩藤和莱菔子生物碱抗高血压血管内皮细胞损伤效应[J].中成药,2013,35(5):889-893.
[6] 高培国,强 辉,凌 鸣.葛根素对过氧化氢诱导的血管内皮细胞损伤的保护作用[J].西安交通大学学报:医学版,2012,33(2):245-260.
[7] 徐 巍.青龙衣的药用研究概述[J].中医药信息,2002,19(6):13-14.
[8] 郜海燕,李兴飞,陈杭君,等.山核桃多酚物质萃取及抗氧化研究进展[J].食品科学,2011,32(5):336-341.
[9] 吴峰华,杨虎清,何志平.山核桃青果皮萃取物抗氧化活性研究[J].中国食品学报,2011,11(1):40-44.
[10] 吕海宁,折改梅,郭志琴,等.核桃青皮在体外清除自由基的活性研究[J].华西药学杂志,2011,26(1):32 -34.
[11] Loor G,Kondapalli J,Schriewer JM,et al.Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis[J].Free Radic BiolMed,2010,49(12):1925-1936.
[12] Sed lic F,Sepac A,Pravdic D,et al.Mitochondrial depolarization underlies delay in permeability transition by pre-conditioning with isoflurane:roles of ROS and Ca2+[J].Am Physiol Gell Physiol,2010,299(2):C506-515.
[13] Oliveira I,Sousa A,Ferreira IC,etal.Total phenols,antioxidant potential and antimicrobial activity of walnut(Juglans regia L.)green husks[J].Food Ghem Toxicol,2008,46(7):2326-2331.
[14] 赵国建,席东亮,段江莲.核桃青皮多酚萃取工艺优化[J].陕西农业科学,2013,59(4):3-8.
[15] 刘树森.线粒体呼吸链与活性氧[J].生命科学,2008,20(4):519-527.
[16] 丁宏娟,何建成,王文武.涤痰汤对帕金森病大鼠行为学和氧化应激反应的影响[J].上海中医药杂志,2009,43(3):63-65.
[17] 吴 眉,高 颖,唐苾芯,等.“吴氏消瘤散”抗S180实体瘤及免疫调节作用的实验研究[J].上海中医药杂志,2014,48(3):66-69.
[18] 岳雅丽,郭 妍,王俊宏,等.老年高血压患者血管硬化与非酶糖基化及氧化应激的相关性研究[J].实用老年医学,2014,28(1):33-36.
[19] 张 季,严春临,张丹参,等.蒺藜皂苷对老年痴呆小鼠脑组织中H2O2、CAT、GSH-Px含量及海马超微结构的影响[J].中国老年学杂志,2011,31(6):2258-2260.
[20] 臧 琳,郭景茹,郭 爽,等.H2O2诱导BRL-3A细胞模拟大鼠肝脏氧化应激损伤的研究[J].中国兽医学报,2013,33(3):445-449.
[21] 张 莹,沐晓芹,梁海海,等.白藜芦醇对H2O2所致乳鼠心肌细胞损伤的保护机制研究[J].哈尔滨医科大学学报,2013,47(1):43-45.
[22] Liu X,Fang L,Zhou Y,et al.Comparison of UV/PDS and UV/H2O2processes for the degradation of atenolol in water[J].JEnviron Sci(Ghina),2013,25(8):1519-1528.
R285.5
B
1001-1528(2015)11-2511-04
10.3969/j.issn.1001-1528.2015.11.039
2014-10-15
吉林省科技厅科技发展项目 (20130101157JC);吉林省教育厅 “十二五”科学技术研究项目 (2012-334);吉林省教育厅“十二五”科学技术研究项目 (2014-363)
赵行宇(1970—),男,硕士,副教授,研究方向为抗氧化应激中药筛选。Tel:13844239332,E-mail:jlmmczw@163.com

