杜仲盐制前后化学成分的变化
邓 翀, 韩 磊, 张亚强, 姜 祎
(1.陕西中医药大学,陕西咸阳712046;2.陕西国际商贸学院,陕西咸阳712046)
杜仲盐制前后化学成分的变化
邓 翀1, 韩 磊2, 张亚强1, 姜 祎1
(1.陕西中医药大学,陕西咸阳712046;2.陕西国际商贸学院,陕西咸阳712046)
目的 比较杜仲盐制前后化学成分的差异,推测其炮制原理。方法 采用紫外分光度结合HPLC-UV法比较盐制杜仲前后饮片中总氨基酸、总黄酮、总多糖以及京尼平苷、京尼平苷酸、绿原酸、松脂醇二葡萄糖苷这4种化学成分含有量的差异。结果 与生品相比,杜仲盐制品中总氨基酸的含有量增加了24.232%,总多糖增加了78.169%,总黄酮降低了16.129%,而京尼平苷、京尼平苷酸、绿原酸、松脂醇二葡萄糖苷这4种化学成分的含有量分别降低了50.663%、21.925%、18.410%、32.923%。结论 杜仲盐制的原理可能是增加总氨基酸和总多糖的溶出,或改变各化学成分群的配比关系。
杜仲;盐制;化学成分;紫外分光度;HPLC-UV
1 实验材料
1.1 仪器 UV-1102紫外分光光度计、FA2004N电子分析天平 (上海天美科学仪器有限公司);SG250HPT超声波清洗器 (上海冠特超声仪器有限公司);Waters2695 HPLC色谱仪(美国Waters公司);BT224S电子天平 (赛多利斯科学仪器北京有限公司)。
1.2 试药 杜仲 (略阳县嘉木杜仲产业有限公司),经陕西中医学院药学院王继涛教授鉴定为杜仲科植物杜仲Eucommia ulmoides Oliver.的干燥树皮。谷氨酸 (批号 200501)、D-葡萄糖 (批号200503)、京尼平苷 (批号11041701)、京尼平苷酸 (批号10032101)对照品 (纯度均大于98%,供含有量测定用,天津西玛科技有限公司);芦丁(批 号 0080-9705)、绿 原酸 (批 号 110753-200413)、松脂醇二葡萄糖苷 (批号 111537-200502)对照品 (中国食品药品检定研究院)。乙腈为色谱纯(美国Fisher公司);水为纯净水;其余试剂均为分析纯。
2 方法
2.1 对照品溶液的制备 精密称取谷氨酸5.00 mg、芦丁11.4 mg、D-葡萄糖对照品5.02 mg,置于25 mL量瓶中定容,得到质量浓度分别为0.200、0.456、0.201 mg/mL的对照品溶液。
精密称取京尼平苷4.9 mg、京尼平苷酸4.7 mg、绿原酸3.3mg、松脂醇二葡萄糖苷对照品4.5 mg,乙醇定容于10 mL量瓶中,得到京尼平苷、京尼平苷酸、绿原酸、松脂醇二葡萄糖苷质量浓度分别为0.490、0.470、0.330、0.450 mg/m L的对照品溶液,4℃下保存。
2.2 样品溶液的制备 杜仲盐制饮片按照文献[3]报道的方法炮制。将炮制饮片和生品粉碎,过60目筛,分别精密称取炮制前后的饮片粉末2 g,置于50 mL圆底烧瓶中,加70%乙醇30 mL,80℃下水浴回流提取2次,每次1 h。然后,提取液在80℃水浴中挥干,残渣用70%乙醇溶解,定容到25 m L量瓶中,4℃下保存,用于测定总黄酮及HPLC多成分的含有量。
再精密称取饮片粉末2 g,置于50 mL圆底烧瓶中,加10倍量95%乙醇,80℃水浴回流1 h后滤过,重复1次,干燥滤渣。然后,将残渣置于50 mL圆底烧瓶中,加10倍量水,90℃水浴中提取1 h,重复1次,提取液在90℃水浴中挥干,残
渣用纯净水溶解,定容到25 mL量瓶中,4℃下保存,用于测定总氨基酸及总多糖的含有量。
2.3 总氨基酸、总黄酮、总多糖测定方法学考察
2.3.1 线性关系的考察 分别精密量取谷氨酸对照品溶液0.28、0.35、0.42、0.49、0.56 mL,置于10 m L具塞试管中,按照文献 [4]报道的方法测定,数据进行计算分析,得到标准曲线 Y= 7.242 9X-0.16,r=0.999 1,表明谷氨酸对照品在0.056~0.112 mg范围内线性关系良好。
分别精密量取芦丁对照品溶液 1.0、1.5、2.0、2.5、3.0 m L,置于10 mL具塞试管中,按照文献 [5]报道的方法测定,数据进行计算分析,得到标准曲线Y=0.437 3X+0.03,r=0.999 9,表明芦丁对照品在0.456~1.368 mg范围内线性关系良好。
分别精密量取D-葡萄糖对照品溶液0.12、0.16、0.20、0.24、0.28 mL,置于10 mL具塞试管中,按照文献 [6]报道的方法测定,数据进行计算分析,得到标准曲线Y=11.13X-0.003 4,r=0.999 6,表明D-葡萄糖对照品在0.024 096~0.056 224 mg范围内线性关系良好。
2.3.2 精密度试验 分别精密量取谷氨酸、芦丁、D-葡萄糖对照品溶液适量,置于10 m L具塞试管中,按 “2.3.1”项下方法测定,重复6次,RSD均小于2.00%,表明仪器精密度良好。
2.3.3 稳定性试验 精密称取同批次杜仲生品2 g,按 “2.2” 项下方法制备样品溶液,按“2.3.1”项下方法于0、10、20、30、40、50、60 min测定其吸光度。结果表明,氨基酸、黄酮、多糖在样品溶液中60 min内的稳定性均良好。
2.3.4 重复性试验 精密称取同批次杜仲生品粉末6份,按 “2.2”项下方法制备样品溶液,按“2.3.1”项下方法测定样品中氨基酸、黄酮、多糖的含有量。结果,三者RSD均小于2.50%,表明该方法重复性良好。
2.3.5 回收率试验 精密称取同批次含有量已知的杜仲生品6份,精密加入谷氨酸、芦丁和葡萄糖对照品溶液适量,按照 “2.3”项下方法测定,计算回收率。结果,三者的平均回收率分别为97.7%、98.8%、98.1%,RSD分别为2.25%、1.76%、1.22%,表明回收率良好。
2.4 HPLC法测定京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷
2.4.1 色谱分析条件 Thermo-C18色谱柱(200 mm×4.6 mm,5μm);流动相为乙腈(A)-0.1%磷酸水溶液 (B),梯度洗脱 (0~7 min,7%A;7~45 min,14%A;45~50 min,15%A);检测波长235 nm;柱温30℃,色谱图见图1。
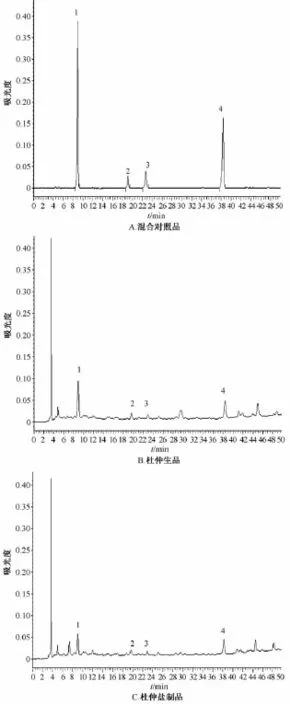
图1 混合对照品及样品的HPLC色谱图Fig.1 HPLC chromatograms of m ixed reference substances and sam p Ies
2.4.2 标准曲线的制备 精密吸取混合对照品溶
液2、4、6、8、10μL进样,在 “2.4.1”项色谱条件下测定,以对照品的质量浓度为横坐标 (X),峰面积为纵坐标 (Y)绘制标准曲线,得到回归方程,分别为京尼平苷Y=8X-12 648,r=0.999 3;京尼平苷酸Y=8×104X+55 112,r=0.999 5;绿原酸Y=8X-14 532,r=0.999 5;松脂醇二葡萄糖苷Y=8×104X+42 325,r=0.999 7。由此可知,京尼平苷在9.8×10-4~4.9×10-3mg,京尼平苷酸在9.4×10-4~4.7×10-3mg,绿原酸在6.6×10-4~3.3×10-3mg,松脂醇二葡萄糖苷9×10-4~4.5×10-3mg范围内均呈良好的线性关系。
2.4.3 精密度试验 精密量取同一混合对照品溶液10μL,在 “2.4.1”项色谱条件下连续进样6次,进样量10μL,测定峰面积。结果,RSD值分别为京尼平苷0.93%、京尼平苷酸1.99%、绿原酸1.25%、松脂醇二葡萄糖苷1.18%,表明仪器精密度良好。
2.4.4 重复性试验 精密称取同批次杜仲生品6份,按 “2.2”项下方法制备供试品溶液,进样20 μL,在 “2.4.1”项色谱条件下测定。结果,RSD值分别为京尼平苷酸0.94%、绿原酸1.09%、京尼平苷2.04%、松脂醇二葡萄糖苷1.13%,表明该方法重复性良好。
2.4.5 稳定性试验 精密称取同批次杜仲生品5份,按 “2.2”项下方法制备供试品溶液,在“2.4.1”项色谱条件下分别于0、2、4、6、8 h内进样,测定峰面积。结果,RSD值分别为京尼平苷酸1.97%、绿原酸1.30%、京尼平苷1.38%、松脂醇二葡萄糖苷1.16%,表明供试品溶液在8 h内稳定性良好。
2.4.6 加样回收率试验 精密称取同批次含有量已知的杜仲生品粉末6份,每份1 g,分别精密加入京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷对照品约3.5、1、0.5(对照品溶液)、2.5 mg,按 “2.2”项下方法制备样品溶液,在“2.4.1”项色谱条件下测定,结果见表1,表明回收率良好。
2.5 样品含有量的测定 按 “2.2”项下方法制备杜仲生品及炮制品供试品溶液6份,按“2.3.1”项下方法测定杜仲盐制前后样品中氨基酸、多糖、黄酮的含有量,在 “2.4.1”项色谱条件下测定杜仲盐制前后样品中京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷的含有量。

表1 加样回收率试验结果(n=6)Tab.1 Resu It of recovery tests(n=6)
3 结果
3.1 杜仲盐制前后饮片中总氨基酸、总黄酮、总多糖的含有量 与生品相比,杜仲炮制后氨基酸和多糖的含有量明显上升,但总黄酮有所下降,结果见表2。由表可知,杜仲炮制后,氨基酸含有量增加24.232%,总多糖增加78.169%,而总黄酮降低16.129%。

表2 杜仲盐制前后饮片中总氨基酸、总黄酮、总多糖的含有量(n=6)Tab.2 Con tents of totaIam ino acids,totaI fIavonoids and tota IpoIysaccharides in decoction pieces of Eucommia ulmoides before and after being processed with saIt(n=6)
3.2 杜仲盐制前后饮片中京尼平苷、京尼平苷酸、
绿原酸、松脂醇二葡萄糖苷的含有量 与生品相比,杜仲炮制后京尼平苷、京尼平苷酸、绿原酸、松脂醇二葡萄糖苷的含有量均有不同程度的下降,结果见表3。由表可知,杜仲炮制后,这4种成分的含有量分别降低了 50.663%、21.925%、18.410%、32.923%。
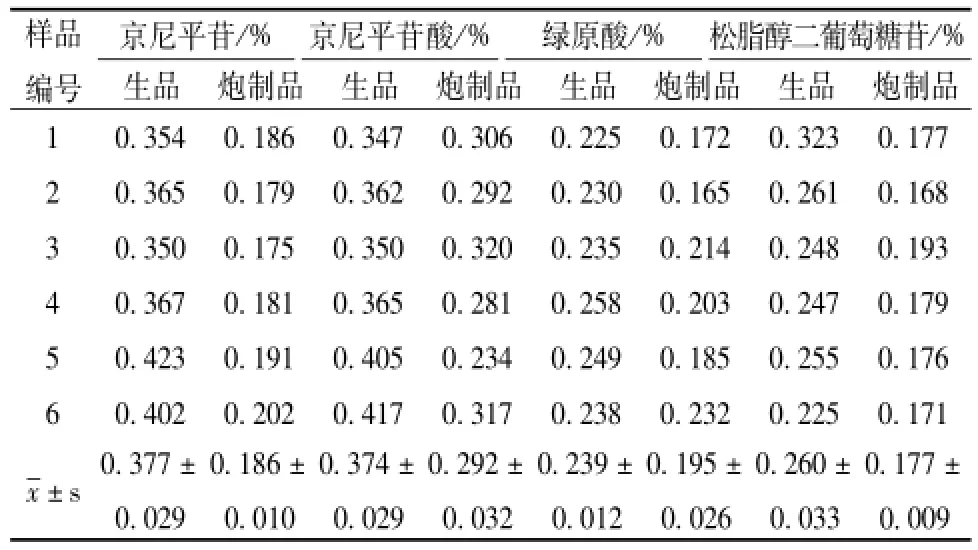
表3 杜仲盐制前后饮片中京尼平苷、京尼平苷酸、绿原酸、松脂醇二葡萄糖苷的含有量(n=6)Tab.3 Contents of geniposide,geniposidic acid,ch Iorogenic acid and pinoresinoI gIucose in decoction pieces of Eucomm ia ulmoides before and after being processed w ith saIt(n=6)
4 讨论
杜仲炮制的温度一般在160~200℃之间[7],但随着温度进一步升高,其化学成分组成将发生变化,其中盐炙后,杜仲饮片中松脂醇二葡萄糖苷、京尼平、京尼平苷、京尼平苷酸、咖啡酸、绿原酸、槲皮素的含有量相对于生品而言,均有所降低[8-9]。本实验以氨基酸、多糖、黄酮总化学部位,以及松脂醇二葡萄糖苷、京尼平苷、京尼平苷酸、绿原酸多成分含有量为评价指标,比较盐制杜仲前后化学成分的变化,发现除氨基酸和多糖总含有量升高以外,其它成分的含有量均呈降低趋势,与文献报道一致。
由此推测,可能是由于杜仲中某些大分子成分稳定性较差,部分化学键在加热时易发生断裂,生成小分子物质,而加入盐后会影响反应体系的离子强度,从而促进或抑制杜仲中某些有效成分之间的相互转化,在高温条件下,黄酮类成分会发生水解、氧化和裂解反应,导致其化学成分含有量呈降低趋势。杜仲炮制后会导致木脂素苷类成分的糖苷键断裂,而木脂素类成分的苷元显著增加,而且环烯醚萜类化合物在加热条件下会发生氧化或聚合反应,导致其含有量降低[10]。杜仲盐制品中绿原酸的含有量降低,而阿魏醛升高,这可能是在加热条件下,绿原酸裂解生成咖啡酸和奎尼酸,而咖啡酸发生脱水反应生成阿魏醛[10]。盐会影响细胞的传热传质性能,从而使杜仲在炮制时更易受到破坏,有效成分更易溶出,从而提高其极性化学成分氨基酸和多糖的提取率[11]。
另外,前期肾阳虚药效学研究显示,杜仲盐制品的作用优于生品[12]。根据文献及本实验结果分析,发现盐制能改变杜仲中大多数化学成分的结构,增加亲脂性,从而促进其体内吸收入血,提高体内生物利用度。由此可知,杜仲 “盐炙入肾”,增强其补肾功效的原理可能是盐炙可使杜仲化学成分由极性向非极性转化,增加亲脂性,从而提高其生物利用度。
[1] 董媛媛,石智华,邓 翀,等.从抗氧化角度评价杜仲“盐制入肾”的炮制机理[J].现代中医药,2013,33(1):77-79.
[2] Wang JL,Liu EW,Wu S,et al.Developmentof HPLCmethod to evaluate drug-processing technique of Eucommiae Gortex[J].Ghin Herb Med,2011,3(3):221-225.
[3] 邓 翀,宋小妹,董媛媛,等.响应面法筛选杜仲的盐制工艺[J].中成药,2014,36(3):585-588.
[4] 王 斌,张腾霄,宋相周,等.不同产地板蓝根中多糖及总氨基酸含量的分析比较[J].南方农业学报,2014,45(1):23-27.
[5] 孙启文,吴 松,方 芸.D101大孔树脂纯化雪荔组方总黄酮工艺[J].中成药,2014,36(10):2208-2211.
[6] 汪少华,乔家法.不同产地浙贝母多糖含量的比较[J].中国现代应用药学,2014,31(10):1256-1258.
[7] 赵建东.杜仲炮制温度的研究[J].中国实用医药,2014,9(15):248-249.
[8] 陶 益,盛 辰,李伟东,等.杜仲不同炮制品化学成分研究[J].中国中药杂志,2014,39(22):4352-4355.
[9] 曹 宇,贾天柱,许 枬.炮制对杜仲化学成分的影响[J].中成药,2009,31(6):900-902.
[10] 刘可鑫,周 翎,刘攀峰,等.盐制对杜仲化学成分含量变化的影响[J].中成药,2011,33(2):280-284.
[11] 杨亚军,周秋贵,梁兆昌.中药杜仲炮制的现代研究进展[J].井冈山学院学报:自然科学版,2007,28(10):99-102.
[12] 翁泽斌,颜翠萍,吴 育,等.盐制对杜仲治疗去卵巢大鼠骨质疏松症影响的研究[J].中国骨质疏松杂志,2014,20(12):1457-1463.
Changes of chem icaIconstituents in Eucomm iae cortex before and after processed w ith saIt
DENG Chong1, HAN Lei2, ZHANG Ya-qiang1, JIANG Yi1
(1.Shaanxi University of Ghinese Medicine,Xianyang 712046,Ghina;2.Shaanxi Gommerce Gollege,Xianyang 712046,Ghina)
AIM To compare the differences in chemical constituents in Eucommiae cortex before and after being processed with salt and speculate its processing principle.METHODS UV spectrophotometric and HPLC-UV were used to compare the differences in the contents of total amino acids,total flavonoids,total polysaccharides,geniposidic,geniposidic acid,chlorogenic acid and pinoresinol diglucoside.RESULTS Compared with raw Eucommiae cortex,the contents of total amino acids and total polysaccharides were increased by 24.232%and 78.169%,the content of total flavonoidswas decreased by 16.129%,and the contents of geniposidic,geniposidic acid,chlorogenic acid and pinoresinol diglucoside were decreased by 50.663%,21.925%,18.410%and 32.923%in salt products,respectively.CONCLUSION The principle of Eucommiae cortex processed with salt is likely to enhance the dissolutions of total amino acids and total polysaccharides or change the proportions of chemical component groups.
Eucommiae Gortex;processed with salt;chemical constituents;UV spectrophotometric;HPLC-UV杜仲为杜仲科植物杜仲Eucommia ulmoides Oliver.的干燥树皮,其主要功效成分为木脂素、环烯醚萜类、黄酮类等,具有补肝肾、强筋骨、降血压、抗肿瘤、安胎等诸多功效,《中国药典》2010年版规定,杜仲饮片为生杜仲和盐杜仲。一般认为,杜仲炮制可使其 “断丝”,有利于煎煮和粉碎等,其中加盐炒制后可引药入肾治下,增强杜仲补肝肾、降压作用。随着现代分析技术和药理活性研究引入传统中医药,人们对杜仲炮制工艺进行了广泛深入的研究[1-2],但一般都只对某一种单一的炮制方式进行工艺筛选,缺乏系统性和统一化,评价指标不够全面。因此,本实验对盐制杜仲炮制前后化学成分进行系统的比较,为评价其炮制原理、控制其饮片质量,及其相关产品的开发和质量控制提供科学依据。
R283
A
1001-1528(2015)11-2464-05
10.3969/j.issn.1001-1528.2015.11.028
2015-04-07
陕西省自然科学基金项目 (2010JQ4022);陕西省教育厅自然科学专项 (2010JK501)
邓 翀 (1978—),男,博士,副教授,研究方向为中药炮制化学及原理研究。Tel:(029)38185165,E-mail:fmmudz217 @126.com

