PAEs胁迫对高/低累积品种水稻根系形态及根系分泌低分子有机酸的影响
陈桐,蔡全英,吴启堂,吕辉雄,曾巧云,李慧
1. 广东高校土壤环境与废物资源农业利用重点实验室,华南农业大学资源环境学院,广东 广州 510642 2. 暨南大学环境学院,广东省高校水土环境毒害性污染物防治与生物修复重点实验室,广东 广州 510632
PAEs胁迫对高/低累积品种水稻根系形态及根系分泌低分子有机酸的影响
陈桐1,蔡全英2*,吴启堂1,吕辉雄1,曾巧云1,李慧2
1. 广东高校土壤环境与废物资源农业利用重点实验室,华南农业大学资源环境学院,广东 广州 510642 2. 暨南大学环境学院,广东省高校水土环境毒害性污染物防治与生物修复重点实验室,广东 广州 510632
以前期筛选获得的邻苯二甲酸酯(PAEs)高/低累积基因型水稻(Oryza sativa L.)品种(培杂泰丰/丰优丝苗)进行水培试验,分别于分蘖期和拔节期采集样品,采用根系扫描仪分析根系形态学特性、高效液相色谱法测定根系分泌物中低分子有机酸成分,以及采用气相色谱-质谱仪(GC-MS)测定水稻根、茎、叶中 PAEs质量分数。对比研究两种基因型水稻的根系形态特征和根系分泌物(低分子有机酸)的差异,初步探讨两种基因型水稻吸收累积PAEs差异原因,为保障农产品质量安全提供科学依据。结果表明,随着培养液中PAEs质量浓度增加,两种基因型水稻总根长、根表面积和根体积先增大后减小;相同PAEs质量浓度下,高累积型品种培杂泰丰根系形态指标大多高于丰优丝苗。两种水稻体内的PAEs质量分数均随污染物浓度增大而升高,高PAEs水平(80 mg·L-1)处理是低PAEs水平(20 mg·L-1)处理的3.8~7.3倍(邻苯二甲酸二丁酯(DBP))和2.7~20.4倍(邻苯二甲酸二(2-乙基己基)酯(DEHP)),培杂泰丰高于丰优丝苗。植物体内DBP和DEHP质量分数呈现根>叶≥茎。分蘖期两种水稻体内DBP和DEHP质量分数高于拔节期,且与营养液中PAEs的质量浓度呈显著相关,但拔节期的相关程度减弱。拔节期两种水稻根系分泌物中低分子有机酸质量浓度随培养液中PAEs质量浓度升高呈现不同的变化规律,但二者草酸质量浓度均增加(在1.11~8.13 mg·L-1之间),并与根系中DBP和DEHP的质量分数呈显著正相关。说明PAEs胁迫会影响水稻根系形态和低分子有机酸分泌,进而影响水稻对PAEs的吸收累积。
邻苯二甲酸酯;水稻;吸收累积;根系形态;低分子有机酸
邻苯二甲酸酯(PAEs,俗称塑化剂)是一类被广泛用作塑料增塑剂等生产原料的有机化合物,其中邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)是两种最常用的塑料增塑剂,在PVC塑料中其含量可达40%~60%(莫测辉等,2005)。随着PAEs在工业中的大量使用和地膜覆盖(包括塑料大棚)栽培技术的广泛应用,我国一些地区农业土壤中PAEs质量分数达到几个至几十个mg·kg-1,超过了相关土壤控制标准(Cai等,2008;Kong等,2012;Niu等,2014;Wang等,2013)。因此,农业系统中PAEs的环境归宿和生态效应越来越受到关注(Cai等,2008;杨国义等,2007)。国内外就PAEs对植物种子萌发、作物生长质量、土壤微生物和酶活性等毒性效应进行了一定的研究(Ma等,2013,2014;Yin等,2003;高军和陈伯清,2008;秦华等,2005;谢慧君等,2009)。有研究发现,当土壤中PAEs质量分数为2 mg·kg-1时,蔬菜(如萝卜、辣椒、白菜等)的生长并未受明显抑制,但在分子和细胞层面上已经产生了毒害作用;当质量分数增加至10 mg·kg-1时,则出现植株矮小、抗性降低、生长缓慢等严重的毒害效应(宋广宇等,2010;王晓娟等,2005;曾巧云等,2007)。但目前有关PAEs对水稻生长的影响研究鲜有报道(Cai等,2015;杨子江等,2013)。
PAEs是一类典型的环境内分泌干扰物,部分化合物具有潜在“三致”毒性。国内外就人体对PAEs的暴露途径及其来源等进行了一定的研究。有研究发现,美国纽约州各类食品均可检测到PAEs,以谷类的DBP和DEHP质量分数较高(Schecter等,2013)。谷类食品是我国人体每日摄入DEHP的主要来源,占DEHP总量的39.44%~44.57%(Sui等,2014)。另有研究表明,广东省农业土壤中美国环保局(USEPA)优先控制的6种PAEs总质量分数以水田的最高,其高低次序为:水田>香蕉地>菜地>甘蔗地>果园地(杨国义等,2007)。基于此,我们前期采用广东省广泛种植的20个水稻(Oryza sativa L.)品种进行土壤盆栽试验,研究了不同品种水稻对PAEs的吸收累积差异(即基因型差异),并筛选出培杂泰丰和丰优丝苗分别为PAEs高、低累积基因型水稻品种。但不同品种水稻对PAEs吸收累积差异的机理尚不明确。目前关于PAEs对水稻根系形态特征和根系分泌物的影响及其与吸收累积差异的关系等方面鲜有报道(杨子江等,2013)。因此,本研究采用溶液培养试验,对比研究培杂泰丰和丰优丝苗水稻根系形态特征和根系分泌物中低分子有机酸质量浓度的差异,初步探讨高/低累积 PAEs品种差异的机理,为保障农产品安全提供科学依据。
1 材料与方法
1.1 试验材料和培养方法
水稻采用溶液培养法,营养液为国际水稻营养液通用配方(Yoshida等,1976;张振华等,2010)。试验采用2.0 L玻璃烧杯作为容器,上盖厚0.4 mm、25 cm×25 cm圆形椴木板。木板以中心为圆点,均匀分布钻4个直径4.5 cm的圆孔,每个孔相距90°圆心角。烧杯外壁用锡箔纸和牛皮纸遮光防水。以高、低吸收累积基因型水稻品种(分别为培杂泰丰、丰优丝苗品种)为供试植物(培杂泰丰种子购自华南农业大学,丰优丝苗种子购自广东省农业科学研究院)。前期预实验设置50、100、200 mg·L-13个DBP、DEHP处理水平和空白处理,观察水稻生长发育状况,结果发现50 mg·L-1处理水稻长势良好,100 mg·L-1处理水稻生长略受抑制,根茎叶发育正常,与空白处理差异不大;200 mg·L-1处理水稻至分蘖期后停止生长,丰优丝苗品种大部分萎缩死亡。根据预实验结果,设置3个DBP、DEHP污染水平,分别为20 mg·L-1(T1)、40 mg·L-1(T2)、80 mg·L-1(T3)和未添加污染物的空白处理(T0),每个质量浓度设4个重复,随机排列。
水稻种子经蒸馏水常温浸泡(24 h)、催芽(28 ℃培养72 h)后,采用广州市园林科学研究所提供的营养基质(育苗专用)培养至3片真叶时,用蒸馏水洗净后转移至不添加污染物的 50%质量浓度营养液中培养,每个烧杯移植16株幼苗(4株幼苗为一撮),每天补充营养液至2 L,每3 d更换一次营养液。移苗第 6天将培养液质量浓度升至100%,并添加污染物,其余条件保持不变。分别于移苗第 27、48天(即分蘖期和拔节期)采集植物样品。根据水稻长势和样品分析需要,分蘖期每个烧杯采集8株水稻,拔节期采用蒸馏水收集根系分泌物后采集水稻样品,由基部剪切分为根系、茎、叶。用去离子水冲洗后进行根系形态扫描,然后分别对根、茎、叶进行PAEs含量测定。
1.2 测定项目与方法
1.2.1 根系形态学特性参数与分析方法
将洗净的水稻根系放在装有去离子水的透明有机玻璃盘中,将根系摆放整齐后,运用根系扫描仪(Epson 1460XL,日本)将根系图像扫入电脑,使用根系分析软件WinRHIZO(Regent Instruments Inc.,加拿大)对图像进行处理,获得总根长、根直径、根表面积等相关参数。
1.2.2 根系分泌物收集与HPLC测定
水稻拔节期采用蒸馏水收集法根系分泌物。收集前,用去离子水反复冲洗水稻根部,用滤纸吸干表面水分,将植物转移至装有500 mL灭菌蒸馏水的棕色磨砂广口瓶中,每个瓶中插入四株长势一致的水稻植株。瓶的外壁用锡纸和牛皮纸包住,收集12 h后,40 ℃下真空旋转蒸发浓缩至50 mL,过0.45 mm微孔滤膜,-20 ℃冷藏备用。上机前样品采用0.45 µm微孔滤膜过滤去除杂质。低分子量有机酸采用Agilent 1100液相色谱仪分析,检测草酸、酒石酸、苹果酸、柠檬酸、乙酸、丙二酸、丁二酸7种水稻常见根系分泌物中低分子有机酸(戢林等,2012)。检测条件为:色谱柱TC-C18(4.6 mm×250 mm,5 µm),柱温25 ℃,检测波长210 nm,流动相采用磷酸二氢钾和甲醇混合液(97∶3,V/V),pH为2.8,流速为0.8 mL·min-1,进样量为20 µL。7种有机酸检测限依次为草酸0.6 mg·L-1、酒石酸3 mg·L-1、苹果酸3.8 mg·L-1、乙酸6.0 mg·L-1、柠檬酸5.6 mg·L-1、丙二酸2.8 mg·L-1、丁二酸3.5 mg·L-1。
1.2.3 PAEs含量的前处理与GC/MS分析
植物样品采用二氯甲烷(色谱纯)超声波提取,方法参考USEPA 3500b(Cai等,2015)。准确称量粉碎后的植物样品1.0 g于50 mL玻璃离心管中。加入20 mL二氯甲烷超声提取10 min(重复3次),4000 r·min-1离心分离,过硅胶柱净化,旋转蒸发仪(亚荣RE-52A,上海)浓缩,转移定容后4 ℃保存待测。
待测液中DBP和DEHP采用气相色谱-质谱仪联机(GC-MS)分析,参考 USEPA8270C方法(USEPA,1996)。GC-MS联用仪型号为GC-MSQP 2010(岛津,日本),色谱柱为DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 µm),载气为高纯氦气(He)。质谱仪所用离子源为电子轰击源(EI)。采用DBP与DEHP化合物标样的0.1、0.2、0.5、1.0、2.0、4.0 mg·L-1为工作曲线。DBP回收率在76.9%至89.2%范围内,检测限为2.0 μg·L-1;DEHP回收率为87.7%~104.5%,检测限2.5 μg·L-1。水稻体内DBP与DEHP含量以干重计。
1.3 数据处理
双因素分析和多重比较等数据处理采用 SPSS 19.0,图表采用Excel处理。
2 结果与讨论
2.1 两种基因型水稻的根系形态参数差异
水稻分蘖期和拔节期的根系形态参数见表 1。在分蘖期,随着营养液中PAEs质量浓度上升,两种水稻根长均先增大后减小。与空白相比,20 mg·L-1处理的培杂泰丰和丰优丝苗其总根长分别增加了3.0%和15.3%,说明低质量浓度PAEs可促进水稻根系生长;但高质量浓度处理(80 mg·L-1)培杂泰丰和丰优丝苗的平均总根长分别比空白对照的下降了 13.5%和 20.6%,说明高质量浓度 PAEs抑制根系生长。两个品种相比,丰优丝苗对 PAEs的质量浓度变化更敏感,表现为低质量浓度促进作用或高质量浓度抑制作用更显著。就根表面积而言,随着PAEs污染质量浓度增加,两品种水稻根表面积先增大后减小,培杂泰丰在PAEs质量浓度较高的环境下根表面积显著大于丰优丝苗。类似地,低质量浓度(20 mg·L-1)环境下根体积增大,高质量浓度下(80 mg·L-1)根体积减小。培杂泰丰的根体积比丰优丝苗对应处理的高,且差异显著。拔节期两种水稻的根系形态指标变化趋势基本与分蘖期类似,与前期相比,根系总根长变长,根表面积、体积增大,与空白对照相比,高质量浓度(80 mg·L-1)处理培杂泰丰和丰优丝苗根系3项指标均达差异显著。将两个时期的水稻品种和处理水平进行双因素分析,发现分蘖期水稻品种间差异和PAEs处理水平均对根系3个指标有显著影响,其中两种水稻在根表面积和体积指标上种间差异更为显著。在拔节期,各处理水平的根长和总根表面积2个指标差异不明显,而两种水稻间3个指标均有显著差异。这说明培杂泰丰、丰优丝苗两个品种之间根系形态差异显著;一定质量浓度范围内的PAEs在水稻生长初期(分蘖期)显著影响根系发育,随着培养时间增加影响程度降低。
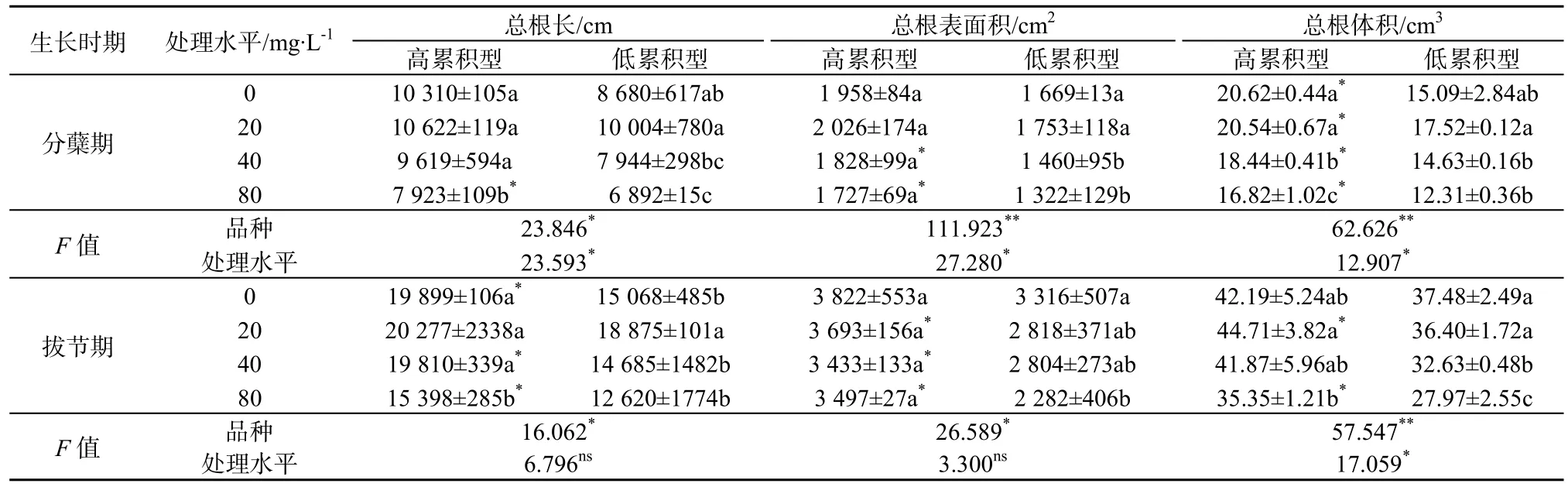
表1 两种基因型水稻根系形态特征差异(单株)Table 1 The differences in root morphology characteristics of two genotypic rice cultivars (single plant)
总体上看,PAEs污染胁迫下,培杂泰丰较丰优丝苗根系更为发达。当作物受到逆境胁迫时,根系是最先感知胁迫的植物器官,作物通过调整根系生长和代谢以适应胁迫环境(Kummerová等,2013;Zhan等,2013)。有研究发现,低质量浓度多环芳烃(PAHs)促进豌豆和玉米的根生长,但高质量浓度显著抑制根生长(Kummerová等,2013)。曾巧云等(2010)研究了PAEs高/低吸收累积基因型菜心(油青60 d和特青60 d)的根系形态差异,发现两种菜心受到DEHP污染后,根系形态指标均有一定减小,但高累积型菜心根系形态指标总体上高于相同质量浓度下的低累积型菜心,这与本研究的结果类似。两种基因型水稻根系形态差异显著,高累积型水稻(培杂泰丰)可以更好的适应环境中的PAEs胁迫,可能导致其吸收累积更多PAEs。
2.2 两种基因型水稻根系分泌物的差异
拔节期水稻根系分泌物中可以检测到7种目标低分子有机酸(表2),空白对照和低质量浓度处理检测到的有机酸化合物偏多,草酸和酒石酸在各处理中均可测出。低质量浓度(20 mg·L-1)处理培杂泰丰的有机酸种类较空白增多。随着污染物质量浓度上升,培杂泰丰处理只检测到草酸和酒石酸,且草酸质量浓度逐渐增大,酒石酸减少。丰优丝苗处理随着PAEs污染水平升高检测到的有机酸种类减少,但草酸、酒石酸、丙二酸均可检出,其中草酸随营养液中PAEs质量浓度升高而增加,酒石酸波动变化,丙二酸则逐渐减少。将草酸和酒石酸的质量浓度与品种和处理水平进行双因素分析,得出水稻品种的差异是根系分泌物中草酸和酒石酸质量浓度变化的显著影响因素。两种水稻草酸质量浓度变化受PAEs处理水平的变化极显著,酒石酸不显著。

表2 两种基因型水稻根系分泌物中七种低分子有机酸质量浓度Table 2 Contents of low molecular weight organic acid in root exudates from two genotypic rice cultivars
受污染环境影响,植物根系释放有机酸的种类和质量浓度会发生改变,以改变环境氧化还原条件和调节pH值,从而影响污染物的吸附解吸性能以及环境可利用性(Jones,1998;Wang等,2014)。例如,有研究发现植物提供的有机酸可降低重金属的毒性,增加重金属的生物可利用性和向植物体内迁移速率(Shoko和Chisato,2005;施和平等,2010;云灵,2010)。在Cd胁迫下,水稻根系分泌物中检出草酸、丙二酸、丁二酸、苹果酸、乙酸、柠檬酸6种低分子量有机酸,以草酸和苹果酸的分泌量较高,并呈现低污染质量浓度促进、高质量浓度抑制有机酸分泌的现象(王玉云,2011)。类似的现象出现在受PAHs影响的红树林(Wang等,2014)。而且,Wang等(2014)研究发现,红树林分泌的低分子量有机酸其质量浓度受PAHs质量浓度和树木品种影响,相同PAHs质量浓度下,不同品种红树林其分泌的低分子量有机酸的质量浓度存在显著差异。这与本研究的结果相似。本研究发现,两种基因型水稻的根系分泌物中草酸和酒石酸的质量浓度存在差异(空白对照除外),且随营养液中PAEs质量浓度增加培杂泰丰和丰优丝苗的草酸质量浓度升高。低分子有机酸可增加土壤中PAHs的生物有效性(Gao等,2015),根系分泌物中草酸可以促进PAHs的解吸(Gao等,2010)。因此草酸可能在水稻受PAEs胁迫过程中产生一定的作用。具体作用机制有待进一步研究。
2.3 水稻体中PAEs含量
在分蘖期,随着营养液中PAEs质量浓度上升,两种水稻根、茎、叶中DBP和DEHP质量分数显著升高(表3和表4),高质量浓度处理(80 mg·L-1)的是低质量浓度处理(20 mg·L-1)的 3.8~7.3倍(DBP)和 2.7~20.4倍(DEHP)。而且,高质量浓度(80 mg·L-1)处理根系中DBP质量分数显著高于茎和叶,培杂泰丰根、茎、叶中 DBP质量分数比丰优丝苗对应器官的高。与分蘖期不同,高质量浓度(80 mg·L-1)处理拔节期水稻根系吸收累积的DBP和DEHP质量分数与分蘖期的相当甚至更低,这可能是高质量浓度处理影响根系生长(表1),进而影响其对DBP和DEHP的吸收累积。有研究表明,植物吸收可利用的有机污染物与植物的根系形态和生理特性有关,根系生物量大有利于植物捕获有机污染物(Gao和Zhu,2004;Gao等,2005)。另外,拔节期各质量浓度处理茎和叶中PAEs质量分数较分蘖期的低,这可能与拔节期根系向地上部运移的DBP和DEHP减少,而且该时期水稻茎叶生物量快速增加,茎叶中DBP和DEHP被一定程度稀释有关。双因素分析结果表明,在分蘖期,营养液中 PAEs的质量浓度变化是两种水稻各部位PAEs质量分数变化的主要影响因素,而拔节期这种影响减弱,说明水稻抵御PAEs的胁迫能力增强。
水稻生长初期(分蘖期),两种水稻根、茎、叶中的DBP和DEHP质量分数差异不大(表3、表4),但叶部的DBP质量分数普遍大于DEHP。在拔节期,除根部外,两种水稻茎、叶中 DBP质量分数则普遍小于DEHP。这可能与DBP和DEHP的理化性质有关。DBP的正辛醇—水分配系数(Kow)低于DEHP(DBP和DEHP的lgKow分别为4.56和7.94),水溶性高于DEHP,导致DBP的生物可利用更高。但另一方面,进入水稻体内的DBP和DEHP可能存在植物体内代谢,短直链的DBP代谢/降解率高于长链且存在支链的DEHP(Zeng等,2004;王冬莹等,2014)。例如,有研究发现,植物可以通过体内代谢多环芳烃(蒽)和多溴联苯醚(DBE-28、DBE-47)(Gao等,2013;Sun等,2013;Yu等,2013)。DBP在水生植物中降解速率较高,DEHP降解缓慢,这与烷基链的长度有关,烷基链越长酯键的水解越困难,降解速率越慢(Chi和Yang,2012;刘华等,2008)。本研究中,由于DEHP较 DBP难被水稻代谢,导致其在体内积累。两个品种相比,培杂泰丰体内DBP和DEHP质量分数水平普遍比丰优丝苗高,可能存在吸收与代谢差异。具体原因有待进一步研究。
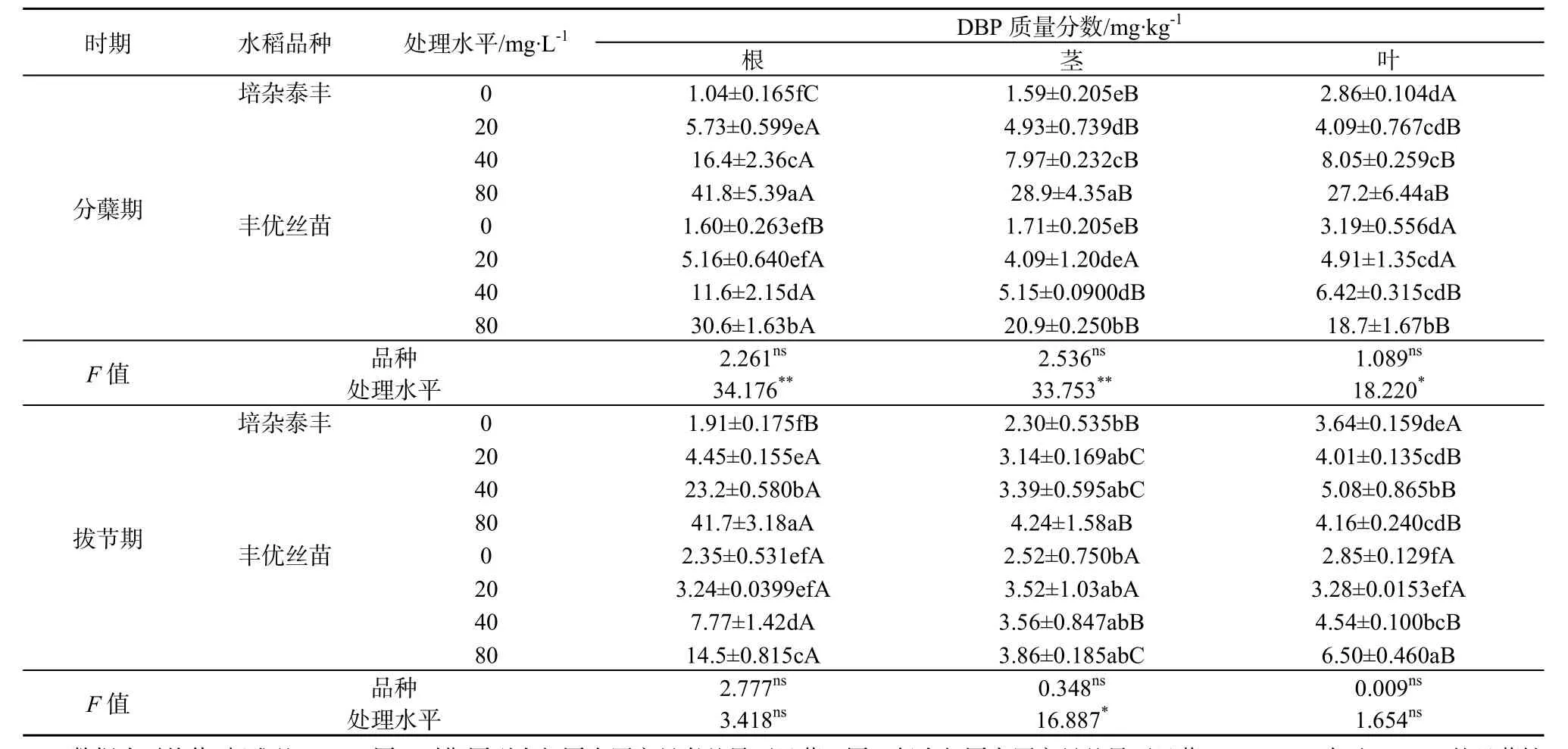
表3 两种基因型水稻植物体中DBP质量分数Table 3 DBP concentrations in plants of two genotypic rice cultivars
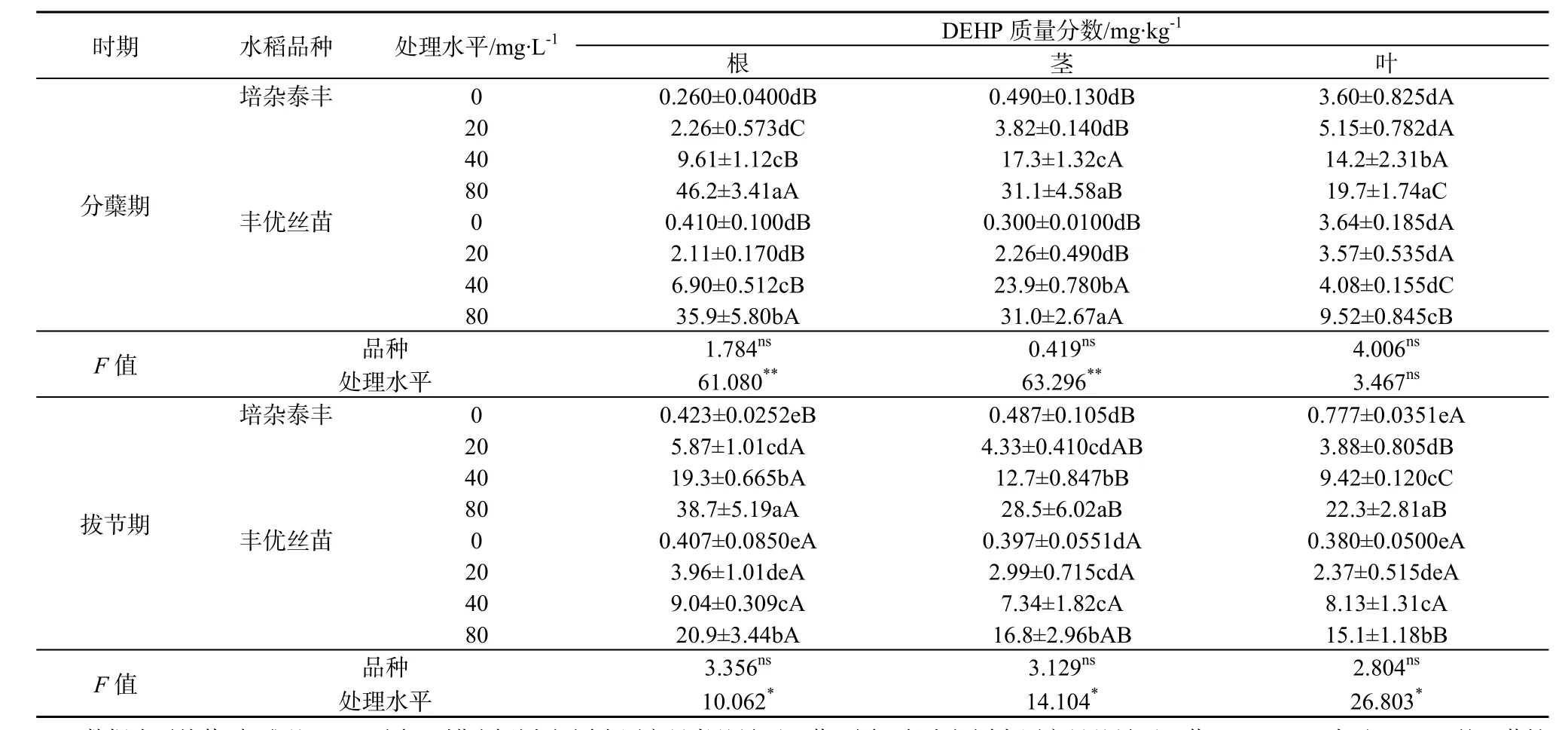
表4 两种基因型水稻植物体中DEHP质量分数Table 4 DEHP concentration in plants of two genotypic rice cultivars
如前所述,根系分泌物草酸质量浓度随营养液中PAEs质量浓度增加而升高,酒石酸则有下降趋势。将以上两种有机酸相应质量浓度与水稻体中DBP和DEHP质量分数进行相关性分析(表5)。结果发现,两种水稻根系中DBP、DEHP质量分数与草酸的质量浓度呈显著正相关关系(P<0.01),与酒石酸总体上呈负相关关系(P<0.05),但两种水稻分别比较则无相关性。有研究表明,植物分泌草酸可以调节根系环境pH值、菌群活性以及一些金属阳离子的浓度,对有机污染物生物有效性和根系吸收能力有促进作用(Bais等,2006;Gao等,2015)。推测本研究中草酸有缓解PAEs毒性甚至促进水稻根系吸收DBP和DEHP的作用。
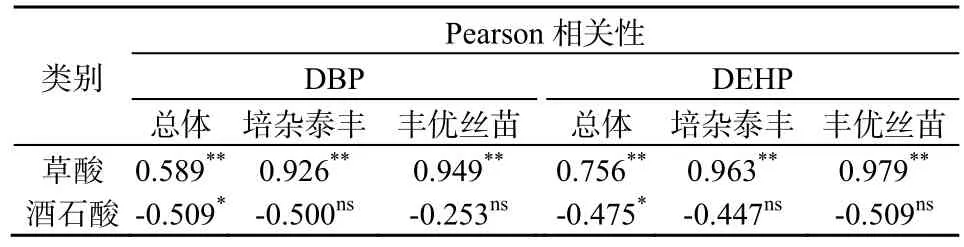
表5 水稻根系分泌物中草酸、酒石酸质量浓度与根系中DBP、DEHP质量分数的相关性分析Table 5 Correlation analysis with the contents of oxalic acid/ tartaric acid in root exudates and the concentrations of DBP, DEHP in roots
3 结论
(1)随着培养液中PAEs质量浓度增加,培杂泰丰(高累积型)和丰优丝苗(低累积型)的总根长、根表面积和根体积均先增加后减少。而且高质量浓度处理的培杂泰丰的总根长、根表面积、根体积显著高于丰优丝苗。高质量浓度PAEs处理对两种水稻分蘖期根系发育影响显著,至拔节期影响减弱。
(2)分蘖期两种水稻体内PAEs质量分数随着培养液中PAEs质量浓度升高显著增大,培杂泰丰植物体中 PAEs质量分数高于丰优丝苗;各部位DBP、DEHP质量浓度呈现根>茎≥叶。拔节期分布规律与分蘖期相似,但两种水稻体内PAEs质量分数较分蘖期降低,各部位DBP、DEHP质量浓度高低次序为根>叶≥茎。营养液中PAEs的质量浓度是影响分蘖期水稻体内PAEs质量分数的主要因素,拔节期水稻抗PAEs胁迫的能力增强。
(3)水稻根系分泌物中低分子有机酸受到PAEs胁迫后质量浓度大多降低,但草酸质量浓度均逐渐增大。草酸质量浓度变化和水稻根系中DBP、DEHP质量分数变化呈极显著正相关,推测草酸在水稻受PAEs胁迫过程中可产生一定作用。
BAIS H P, WEIR T L, PERRY L G, et al. 2006. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review Plant Biology, 57: 233-266.
CAI Q Y, MO C H, WU Q T, et al. 2008. The status of soil contamination by semivolatile organic chemicals (SVOCs) in China: A review[J]. Science of the Total Environment, 389(2-3): 209-224.
CAI Q Y, XIAO P Y, CHEN T, et al. 2015. Genotypic variation in the uptake, accumulation, and translocation of di-(2-ethylhexyl) phthalate by twenty cultivars of rice (Oryza sativa L.) [J]. Ecotoxicology and Environmental Safety, 116: 50-58.
CHI J E, YANG Q. 2012. Effects of Potamogeton crispus L. on the fate of phthalic acid esters in an aquatic microcosm[J]. Water Research, 46(8): 2570-2578.
GAO Y Z, REN L L, LING W T, et al. 2010. Desorption of phenanthrene and pyrene in soils by root exudates[J]. Bioresource Technology, 101(4): 1159-1165.
GAO Y Z, YUAN X J, LIN X H, et al. 2015. Low-molecular-weight organic acids enhance the release of bound PAH residues in soils[J]. Soil & Tillage Research, 145: 103-110.
GAO Y Z, ZHANG Y, LIU J, et al. 2013. Metabolism and subcellular distribution of anthracene in tall fescue (Festuca arundinacea Schreb.)[J]. Plant Soil, 365: 171-182.
GAO Y Z, ZHU L Z, LING W T. 2005. Application of the partition-limited model for plant uptake of organic chemicals from soil and water[J]. Science of the Total Environment, 336: 171-182.
GAO Y Z, ZHU L Z. 2004. Plant uptake, accumulation and translocation of phenanthrene and pyrene in soils[J]. Chemosphere, 55: 1169-1178.
JONES D L. 1998. Organic acids in the rhizosphere——a critical review[J]. Plant and Soil, 205: 25-44.
KONG S F, JI Y Q, LIU L L, et al. 2012. Diversities of phthalate esters in suburban agricultural soils and wasteland soil appeared with urbanization in China[J]. Environmental Pollution, 170: 161-168.
KUMMEROVÁ M, ZEZULKA Š, BABULA P, et al. 2013. Root response in Pisumsativum and Zea mays under fluoranthene stress: Morphological and anatomical traits[J]. Chemosphere, 90(2): 665-673.
MA T T, CHRISTIE P, TENG Y, et al. 2013. Rape (Brassica chinensis L.) seed germination, seedling growth, and physiology in soil polluted with di-n-butyl phthalate and bis(2-ethylhexyl) phthalate[J]. Environmental Science and Pollution Research, 20(8): 5289-5298.
MA T T, CHRISTIE P, LUO Y M, et al. 2014. Physiological and antioxidant responses of germinating mung bean seedlings to phthalate esters in soil[J]. Pedosphere, 24(1): 107-115.
NIU L L, XU Y, XU C, et al. 2014. Status of phthalate esters contamination in agricultural soils across China and associated health risks[J]. Environmental Pollution, 195: 16-23.
SCHECTER A, LORBER M, GUO Y, et al. 2013. Phthalate concentrations and dietary exposure from food purchased in New York State[J]. Environmental Health Perspectives, 121(4): 473-479.
SHOKO I, CHISATO T. 2005. Effect of dissolved organic matter on toxicity and bioavailability of copper for lettuce sprouts [J]. Environment International, 31(4): 603-608.
SUI H X, ZHANG L, WU P G, et al. 2014. Concentration of di(2-ethylhexyl) phthalate (DEHP) in foods and its dietary exposure in China[J]. International Journal Hygiene and Environmental Health, 217(6): 695-701.
SUN J T, LIU J Y, YU M, et al. 2013. In Vivo Metabolism of 2,2’,4,4’-tetrabromodiphenyl ether (BDE-47) in young whole pumpkin plant[J]. Environmental Sciences Technology, 47(8): 3701-3707.
USEPA. 1996. Method 8270C Semivolatile organic compounds by gas chromatography-mass spectrometry (GC/MS). Revision 3 ed. United States Environmental Protection Agency.
WANG J, LUO Y, TENG Y, et al. 2013. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film[J]. Environmental Pollution, 180: 265-273.
WANG Y, FANG L, LIN L, et al. 2014. Effects of low molecular-weight organic acids and dehydrogenase activity in rhizosphere sediments of mangrove plants on phytoremediation of polycyclic aromatic hydrocarbons[J]. Chemosphere, 99: 152-159.
YIN R, LIN X G, WANG S G, et al. 2003. Effect of DBP/DEHP in vegetable planted soil on the quality of capsicum fruit[J]. Chemosphere, 50(6): 801-805.
YOSHIDA S, FORNO D A, COCK J H, et al. 1976. Laboratory manual for physiological studies of rice[M]. Philippines Laguna: IRRI: 66-78.
YU M, LIU J Y, WANG T, et al. 2013. Metabolites of 2,4,4′-tribrominated diphenyl ether (BDE-28) in pumpkin after in vivo and in vitro exposure[J]. Environmental Science and Technology 47(23): 13494-13501.
ZENG F, CUI K Y, LI X D, et al. 2004. Biodegradation kinetics of phthalateesters by Pseudomonas fluoresences FS1[J]. Process Biochemistry, 39: 1125-1129.
ZHAN X H, LIANG X, XU G H, et al. 2013. Influence of plant root morphology and tissue composition on phenanthrene uptake: Stepwise multiple linear regression analysis[J]. Environmental Pollution, 179: 294-300.
高军, 陈伯清. 2008. 酞酸酯污染土壤微生物效应与过氧化氢酶活性的变化特征[J]. 水土保持学报, 22(6): 166-169.
刘华, 沈新天, 孙丽娜, 等. 2008. 普通小球藻对邻苯二甲酸二丁酯的富集与降解研究[J]. 农业环境科学学报, 27(6): 2391-2395.
戢林, 李廷轩, 张锡洲, 等. 2012. 水稻氮高效基因型根系分泌物中有机酸和氨基酸的变化特征[J]. 植物营养与肥料学报, 18(5): 1046-1055.
莫测辉, 李云辉, 蔡全英, 等. 2005. 农用肥料中有机污染物的初步检测[J]. 环境科学, 26(3): 209-213.
秦华, 林先贵, 陈瑞蕊, 等. 2005. DEHP对土壤脱氢酶活性及微生物功能多样性的影响[J]. 土壤学报, 42(5): 829-834.
施和平, 曾宝强, 王云灵, 等. 2010. 镉及其与钙组合对褐脉少花龙葵毛状根生长、抗氧化酶活性和吸收镉的影响[J]. 生物工程学报, 26(2): 147-158.
宋广宇, 代静玉, 胡锋. 2010. 邻苯二甲酸酯在不同类型土壤-植物系统中的累积特征研究[J]. 农业环境科学学报, 29(8): 1502-1508.
王冬莹, 萧玺琴, 杨子江, 等. 2014. 农田土壤酞酸酯的生物降解及真菌生长动态试验研究[J]. 环境科学与技术, 37(2): 38-43.
王晓娟, 金樑, 陈家宽. 2005. 环境激素 DBP对拟南芥体外培养叶片超微结构的影响[J]. 西北植物学报, 25(7): 1362-1367.
王玉云. 2011. Cd胁迫对不同水稻根系分泌有机酸和氨基酸及根系Cd含量的影响[D]. 四川农业大学: 59.
谢慧君, 石义静, 腾少香, 等. 2009. 邻苯二甲酸酯对土壤微生物群落多样性的影响[J]. 环境科学, 30(5): 1286-1291.
杨国义, 张天彬, 高淑涛, 等. 2007. 广东省典型区域农业土壤中邻苯二甲酸酯的分布特征[J]. 应用生态学报, 18(10): 2308-2312.
杨子江, 饶刚顺, 肖立中, 等. 2013. 酞酸酯污染胁迫对2个水稻品种生长和生理特性的影响[J]. 广东农业科学, 7: 1-6.
云灵. 2010. 镉对南美蟛蜞菊毛状根生长、镉吸收及细胞毒性的影响以及钙的缓解效应[D]. 华南师范大学: 65.
曾巧云, 莫测辉, 蔡全英, 等. 2007. 不同基因型菜心-土壤系统中邻苯二甲酸二(2-乙基己基)酯的分布特研究[J]. 农业环境科学学报, 26(6): 2239-2244.
曾巧云, 莫测辉, 蔡全英, 等. 2010. 两种基因型菜心根系形态和生理特性差异对其吸收累积 DEHP影响的初步研究[J]. 环境科学学报, 30(6): 1280-1285.
张振华, 刘强, 宋海星, 等. 2010. K+, Ca2+和 Mg2+对不同水稻(Oryza sativa L.)基因型苗期耐盐性的影响[J]. 中国农业科学, 43(15): 3088-3097.
Effects of PAE Stress on Root Morphology and Low Molecular Weight Organic Acid (LMWOC) in Root Exudates of Rice (Oryza sativa L.) Cultivars with Highand Low-PAE Accumulation
CHEN Tong1, CAI Quanying2*, WU Qitang1, LV Huixiong1, ZENG Qiaoyun1, LI Hui2
1. Key Laboratory of Soil Environment and Waste Reuse in Agriculture of Guangdong Higher Education Institutions, College of Resources and Environment, South China Agricultural University, Guangzhou 510642, China 2. Key Laboratory of Water/Soil Toxic Pollutants Control and Bioremediation of Guangdong Higher Education Institutions, School of Environment, Jinan University, Guangzhou 510632, China
Two different genotypic cultivars of rice (Oryza sativa L.) with PAE (phthalic acid esters) high-accumulation (cultivar Peizataifeng) and low-accumulation (cultivar Fengyousimiao), were grown in hydroponic systems contaminated with PAEs (0, 20, 40, and 80 mg·L-1). Plant samples were collected at tillering and jointing stage, root morphological properties were analyzed by root scanner, low molecular weight organic acids in root exudates were determined by HPLC, and di(2-ethylhexyl) phthalate (DEHP) and di-n-butyl phthalate (DBP) in roots, stems, and leaves of rice were analyzed using gas chromatography coupled with mass spectrometry (GC/MS). The responses of root morphological characteristics (including total root length, root surface area, and root volume) and low molecular weight organic acid (LMWOC) in root exudates were analyzed to investigate the variation factors of high- and low-PAE accumulation of rice cultivars. The results show that, with the increase of PAE concentrations in solution, total root length, root surface area, and root volume of two cultivars increased firstly and then decreased. In the same PAE concentration, root morphological parameters of cultivar Peizataifeng were generally higher than cultivar Fengyousimiao. Change of PAE concentrations in solution was a key factor affecting early growth differences in root morphology of the two rice cultivars. PAE concentrations in the plants of two cultivars increased with PAE concentrations in solution, and those of cultivar Peizataifeng were also higher than cultivar Fengyousimiao. The concentrations of DEHP and DBP in different tissues decrease in the order of roots>leaves≥stems. At tillering stage, PAE concentrations in the plants of two cultivars were significantly correlated with PAE concentrations in solution, but poorly correlated at jointing stage. LMWOC concentrations in root exudates of two cultivars displayed different change trends with PAE concentrations in solution, but concentrations of oxalic acid increased (ranging from 1.11 to 8.13 mg·L-1). Moreover, concentrations of oxalic acid were significantly positively correlated with the concentrations of DBP and DEHP in roots. These results suggested that PAE stress had effects on root morphology and LMWOC of two rice cultivars, and then affected the uptake and accumulation of PAEs in rice plants.
phthalic acid esters; rice; accumulation; root morphology; low molecular weight organic acid
10.16258/j.cnki.1674-5906.2015.03.019
X171.5
A
1674-5906(2015)03-0494-07
陈桐,蔡全英,吴启堂,吕辉雄,曾巧云,李慧. PAEs胁迫对高/低累积品种水稻根系形态及根系分泌低分子有机酸的影响[J]. 生态环境学报, 2015, 24(3): 494-500.
CHEN Tong, CAI Quanying, WU Qitang, LV Huixiong, ZENG Qiaoyun, LI Hui. Effects of PAE Stress on Root Morphology and Low Molecular Weight Organic Acid (LMWOC) in Root Exudates of Rice (Oryza sativa L.) Cultivars with High- and Low-PAE Accumulation [J]. Ecology and Environmental Sciences, 2015, 24(3): 494-500.
国家自然科学基金项目(41273113);广东省科技计划项目(2013B020310008);中央高校基本科研业务费专项资金资助(21613329)
陈桐(1990年生),硕士研究生,研究方向为土壤有机污染与农产品安全。Email: 657372645@qq.com *通信地址:蔡全英(1974年生),教授,研究方向为土壤有机污染与农产品安全。Email: cai_quanying@yahoo.com
2015-01-21

