氮素形态对泥炭沼泽土壤有机碳矿化的影响
陶宝先,宋长春
1. 聊城大学环境与规划学院,山东 聊城 252059;2. 中国科学院东北地理与农业生态研究所,吉林 长春 130102
氮素形态对泥炭沼泽土壤有机碳矿化的影响
陶宝先1,宋长春2,*
1. 聊城大学环境与规划学院,山东 聊城 252059;2. 中国科学院东北地理与农业生态研究所,吉林 长春 130102
大气氮沉降是全球变化的主要因素之一。硝态氮、氨态氮是大气氮沉降的两种主要氮素形态,且两者在大气氮沉降中的比例具有较大的空间变异性。目前,多数研究侧重于探讨氮输入量与土壤碳循环过程之间的关系,很少有研究关注不同氮素形态对沼泽湿地土壤有机碳矿化的影响。以东北地区多年冻土区及季节冻土区泥炭沼泽为例,利用室内模拟实验,在100%土壤最大持水量条件下,将土样于15 ℃好氧培养60 d,研究不同形态氮输入对泥炭沼泽土壤有机碳矿化的影响。结果表明,多年冻土区和季节冻土区泥炭沼泽0~30 cm深度的土壤有机碳贮量分别为17.60、13.06 kg·m-2。多年冻土区泥炭沼泽土壤有机碳的累积矿化量显著大于季节冻土区(P<0.001)。同一泥炭沼泽中,表土(0~15 cm)有机碳累积矿化量显著大于下层(15~30 cm;P<0.001)。氨态氮抑制土壤有机碳矿化,使多年冻土区泥炭沼泽土壤有机碳累积矿化量下降12.08%~14.90%,季节冻土区下降7.28%~12.57%,而硝态氮及硝酸氨对土壤有机碳矿化无显著影响。此外,氮素形态、土壤深度及泥炭沼泽类型对土壤有机碳矿化有显著的交互作用(P<0.05)。因此,区分不同氮素形态对土壤碳排放的影响是非常有必要,有利于深入了解大气氮沉降对泥炭沼泽土壤碳库稳定性的影响。
氮形态;有机碳矿化;泥炭沼泽;东北地区
泥炭沼泽约占陆地总面积的 2%~3%,却存贮了近 1/3的陆地土壤有机碳(Gorham,1991)。北半球高纬地区湿地具有寒冷、滞水、缺氧及土壤pH较低等环境特征(Currey等,2010),植被固碳量及凋落物归还量超过了土壤碳排放量(Hill等,2007),使其成为全球重要的碳库(Bragazza等,2006)。近百年来,陆地生态系统大气氮沉降量已增加一倍,且在持续增加(Vitousek等,1997)。据预测,到 2030年,亚洲地区的大气氮沉降量将增加 1.4~2倍(IPCC,2007)。然而,大气氮沉降对土壤有机碳矿化的影响仍不确定。前期研究发现,大气氮沉降促进泥炭沼泽土壤碳排放(Currey等,2010)。然而,大气氮沉降量与土壤碳排放速率间并非呈线性关系,随着大气氮沉降量的增加,它对土壤碳排放的促进作用在逐渐减弱(Bragazza等,2006)。此外,也有研究发现,大气氮沉降抑制土壤碳排放(Johnson等,2010)或无显著影响(Song等,2010)。
目前,大多数学者侧重研究氮沉降量与土壤碳排放之间的关系,很少有研究区分不同氮素形态对土壤碳循环过程的影响(Min等,2011;Huang等,2011;Ramirez等,2010)。硝态氮、氨态氮具有相反的离子电荷,它们对土壤pH可能产生相反的作用(Söderberg和Bååth,2004)。这是否影响湿地土壤有机碳的矿化?目前仍不确定。有研究发现,两种形态氮沉降对土壤pH产生不同影响,并导致土壤酶活性产生不同的响应,最终改变湿地土壤有机碳矿化(Min等,2011)。但是,相反的结论表明,不同形态氮输入虽然对土壤pH有不同的影响,但影响土壤有机碳矿化的主要因素是氮沉降量,而非氮沉降对土壤pH的改变(Ramirez等,2010)。近期研究发现,氨态氨或脲素输入对土壤碳排放有促进(Min等,2011;Huang等,2011)、抑制作用(Ramirez等,2010),或无显著影响(Song等,2010);硝态氮输入也呈现类似的结果(Currey等,2010;Song等,2010;Min等,2011)。此外,有机碳质量及氮输入量也影响有机碳矿化对不同形态氮输入的响应。长期培养实验的初期及末期的有机碳矿化速率可以反映易分解、难分解碳组分的矿化速率,硝酸氨输入促进培养初期有机碳矿化,抵制培养末期有机碳矿化(Hobbie等,2012)。Enrique等也发现,少量的氨态氮输入促进土壤有机碳矿化,而高水平氨态氮输入却抑制有机碳矿化(Enrique等,2008)。目前,鲜有研究区分不同氮形态对湿地土壤碳循环的影响,且现有的少量研究结论也不统一,限制了我们深入理解湿地土壤氮的可利用性与碳循环过程之间的关系。因此,区分不同形态氮输入对土壤有机碳矿化的影响是非常有必要的。
东北地区湿地面积占全国湿地总面积的48.3%(刘兴土,2005),且该区域湿地多处于亚欧大陆多年冻土区的南缘(周幼吾等,2000)。据预测,全球变暖使亚欧大陆多年冻土区的气温逐渐升高(Rey等,2005),这可能增加土壤氮的可利用性,改变土壤有机碳矿化,影响陆地生态系统碳平衡(Mack等,2004)。目前,关于不同形态氮输入对东北地区泥炭沼泽土壤有机碳矿化的研究仍不多见。本研究以东北地区多年冻土区及季节冻土区泥炭沼泽为例,利用室内模拟实验,研究不同形态氮输入对泥炭沼泽土壤有机碳矿化的影响,以期深入了解氮的可利用性与泥炭沼泽土壤碳库稳定性之间的关系,为我国湿地土壤碳库管理提供科学依据。
1 材料与方法
1.1 研究区概况
采样点位于东北地区多年冻土区(52°56′N,122°52′E)和季节冻土区(47°29′N,133°21′E)泥炭沼泽。其中,多年冻土区泥炭沼泽发育于大兴安岭的沟谷平地,该区降水量440~490 mm,年均温-4.3 ℃,主要植被类型为笃斯越桔(Ledum palustre-Vaccinium)、泥炭藓(uliginosum-Sphagnum)等(Jin等,2007)。季节冻土区泥灰沼泽主要发育于三江平原,该区降水量558 mm,超过65%的降水集中在7、8月份,年均温2.5 ℃,主要植被类型为毛果苔草(Carex lasiocarpa)、狭叶甜茅(Glyceria spiculosa)等。
1.2 样品采集与分析
2012年9月,于上述地区选择泥炭沼泽,采集0~15、15~30 cm的土壤样品,每种类型泥炭沼泽多点取样,并尽快送回实验室。手工挑出根系、新鲜凋落物、石块等杂物,过2 mm筛,4 ℃冷藏保存。其中一部分土样于阴凉处风干,测试最大持水量及土壤pH,并取部分风干样研磨、过0.25 mm筛,测试土壤总氮、有机碳含量。另一部分新鲜土样用于室内培养实验。
土壤最大持水量测试采用Rey等的方法(Rey等,2005)。土壤总氮含量采用凯氏定氮法,土壤有机碳含量采用硫酸——重铬酸钾湿氧化法测定,土壤pH采用pH计测定(鲁如坤,2000)。土壤有机碳分子结构采用固态13C核磁共振波谱法(13C-NMR)测试。土壤基本属性见表1。

表1 土壤样品基本性质Table 1 The basic characteristics of soil sample at two study sites
将10 g土样(干重)放置于500 mL广口瓶中,加入适量NaNO3、NH4Cl、NH4NO3溶液,随后用去离子水调节土壤含水量至 100%最大持水量。用纱布将瓶口封住,即保持瓶内空气流通、又减缓水分损耗,于15 ℃恒温培养60 d。相关研究表明,本研究区大气氮沉降量约为N 1.43 g·m-2·a-1(Lü和Tian,2007),且大气氮沉降量将持续增加(IPCC,2007)。因此,本研究的氮输入量为N 3 g·m-2·a-1。
实验的前20 d,每5 d测试一次土壤有机碳矿化速率,其后每 10 d测试一次土壤有机碳矿化速率。测试前,用新鲜空气替换瓶内空气,然后用带三通的胶塞密封瓶口,24 h后用带三通的注射器抽取20 mL瓶内空气,用气相色谱(Agilent 7820A,USA)测试CO2含量。用气体样品与新鲜空气CO2含量差值计算土样释放CO2的量。取样后,去掉胶塞,重新用纱布封口。每隔3 d用称重法补充瓶内水分。
1.3 统计分析
采用 SPSS11.5软件对不同处理之间的数据进行方差分析和显著性检验,其中显著性差异P<0.05。采用Origin8.0作图。
2 结果
多年冻土区泥炭沼泽土壤有机碳、总氮、C/N及土壤有机碳累积矿化量均大于季节冻土区;在同类泥炭沼泽中,上述指标值随土壤深度增加而下降(表 1,图 1)。多年冻土区、季节冻土区泥炭沼泽0~30 cm 的有机碳贮量分别为 C 17.60、13.06 kg·m-2。根据13C-NMR分析(图2),两类泥炭沼泽土壤在45~110 ppm波谱范围的有机碳官能团的比例为35.67%~54.17%。

图1 土壤有机碳累积矿化量(n=3)Fig. 1 Cumulative CO2production in two peatlands (n=3)
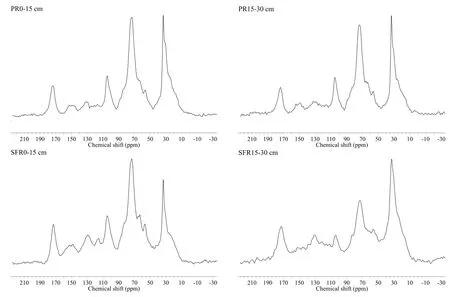
图2 土壤有机碳固态13C核磁共振波谱分析。PR代表多年冻土区,SFR代表季节冻土区Fig. 2 Results of13C-NMR analysis. PR = permafrost region, SFR = seasonally frozen region
经过60 d的培养,多年冻土区泥炭沼泽土壤有机碳的累积矿化量显著大于季节冻土区(P<0.001)。同一泥炭沼泽中,表土有机碳累积矿化量显著大于下层(P<0.001)。氨态氮输入显著抑制土壤有机碳矿化(P<0.05),使多年冻土区泥炭沼泽土壤有机碳累积矿化量下降12.08%~14.90%,季节冻土区下降7.28%~12.57%。硝态氮及硝酸氨对土壤有机碳矿化无显著影响。三因素方差分析表明,氮素形态、土壤深度及泥炭沼泽类型均对土壤有机碳矿化有显著影响,且存在显著的交互作用(P<0.05;表2)。
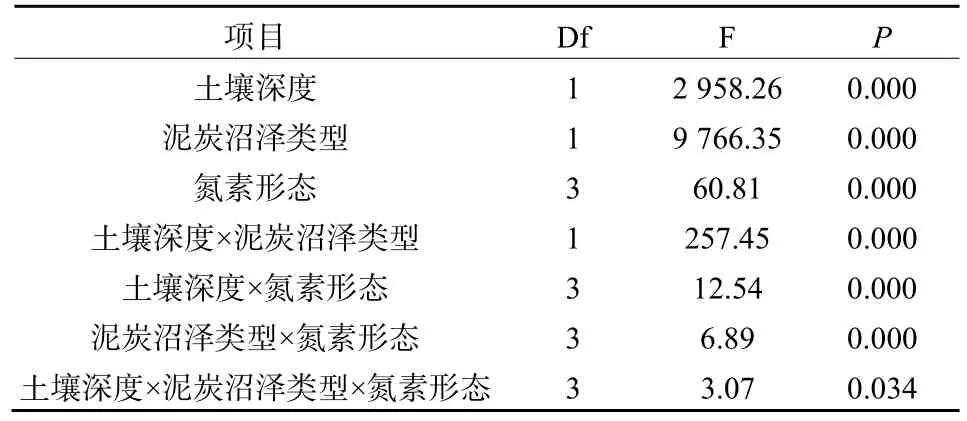
表2 有机碳累积矿化量的三因素方差分析结果Table 2 Results of three-way analysis of ANOVA
3 讨论
短期培养实验常用于评价土壤碳排放的时空变异性(Turetsky,2004)。大尺度上影响土壤碳排放时空变异性的主要是温度等环境因素(Knorr等,2005)。在本研究区,多年冻土区的年均温低于季节冻土区,有助于土壤有机碳的累积。因此,多年冻土区0~30 cm深度的土壤有机碳贮量大于季节冻土区。13C-NMR是分析有机质分子结构的有效手段,它可以精确测定各种有机碳官能团在有机质中的比例。通常,波谱范围45~60 ppm的有机碳官能团代表多糖类物质;60~110 ppm的有机碳官能团代表碳水化合物等(Rovira和Vallejo,2002)。13C-NMR分析表明,两类泥炭沼泽土壤中,多糖、碳水化合物等易分解碳组分在土壤有机碳中的比例高达35%~55%(表1,图2)。虽然季节冻土区表层土壤中易分解碳组分在有机质中的比例要大于多年冻土区,但季节冻土区泥炭沼泽土壤有机碳的含量要低于多年冻土区。因此,多年冻土区泥炭沼泽土壤中含有更多的易分解碳组分,使得多年冻土区泥炭沼泽土壤有机碳的累积矿化量大于季节冻土区。此外,两类泥炭沼泽表土有机碳含量较高,且表土有机碳含有更多的易分解碳组分(表1),使表土有机碳的累积矿化量明显大于下层土壤(图1)。因为,土壤深度可以反映土壤有机碳矿化的难易程度,深层土壤有机碳由于含有较多的“老碳”(old carbon),因此,具有较低的矿化速率(Rey等,2005)。
根据资源分配模型(Resource Allocation Models),氮输入理论上增加了土壤微生物对碳的需求(Sinsabaugh和Moorhead,1994)。因此,氮沉降通常能够加速土壤有机碳分解(Currey等,2010;Huang等,2011)。早期研究也发现,土壤C/N小于30时,土壤异养呼吸受碳的限制(Kaye和Har,1997)。在三江平原,氮输入促进沼泽化草甸土壤碳排放(Zhang等,2007a)和植物生长(Zhang等,2007b),表明此生态系统仍受氮限制。我们的研究却发现,氨态氮输入抑制泥炭沼泽土壤有机碳矿化(图1),这与上述研究结论相反,表明无机氮输入可能减缓泥炭沼泽土壤碳分解。
产生上述结果的原因可能是:(1)Min等发现,氨态氮输入抑制了湿地土壤有机碳矿化,但加速了碳水化合物的消耗(Min等,2011)。Schimel和Weintraub也认为,外源氮输入降低氮限制生态系统土壤呼吸速率是因为氮素主要促进微生物生长,而非呼吸损耗(Schimel和Weintraub,2003)。据此推测,本研究区土壤微生物活性可能仍受氮素限制,但土壤有机碳矿化被抑制可能是因为氨态氮输入主要用于促进微生物生长,而非异养呼吸损耗。(2)早期研究发现,土壤pH的改变可以预测碳排放的趋势(Evans等,2008)。而且,氨态氮输入可以降低土壤pH(Song等,2010;Min等,2011),改变土壤酶活性(McAndrew和Malhi,1992),影响土壤有机碳分解。Toberman等也发现,酚氧化酶活性随土壤pH下降而降低(Toberman等,2008)。我们前期在三江平原沼泽化草甸的研究也发现,高水平输入显著降低土壤 pH,且土壤微生物量碳与土壤pH显著相关(Tao等,2013)。据此推测,氨态氮输入降低了土壤 pH,抑制了与土壤碳循环相关的微生物及酶活性,减缓了土壤有机碳矿化。
本研究发现,硝态氮输入对土壤有机碳矿化无显著作用。其原因可能是:(1)异养微生物通过分泌胞外酶分解有机质,且β-葡萄糖苷酶是与土壤碳循环密切相关一种土壤酶,而硝态氮输入对湿地土壤β-葡萄糖苷酶活性无显著影响(Min等,2011),这可能是产生上述结果的一种原因。(2)微生物对不同形态氮素有选择性吸收趋势。前期研究发现,土壤微生物优先吸收氨态氮(王春阳等,2010),因为吸收氨态氮消耗的能量较小(Puri和Ashman,1999);在黄土高原地区,随着土地利用类型的变化,森林、草地生态系统土壤微生物也有优先利用氨态氮的趋势(王春阳等,2010),这可能是产生上述结果的另一原因。(3)外源氮输入可能改变微生物种群结构,影响土壤有机碳分解。有研究表明,土壤微生物种群结构从真菌为主向细菌为主转变,能降低有机碳的分解速率(Allison等,2008)。早期研究表明,氮输入降低了真菌生物量(Frey等,2004),增加了细菌生物量(Min等,2011)。其他研究也发现,硝态氮输入对根际细菌活性无显著作用,而氨态氮输入却有抑制作用(Söderberg和Bååth,2004)。据此推测,微生物对两种氮素的选择性吸收有可能改变土壤微生物种群结构,对土壤有机碳矿化产生不同影响。
此外,硝酸氨输入对土壤有机碳矿化也无显著作用,这与同区域其它类型湿地的研究结论不同(Zhang等,2007;Tao等,2013)。有研究表明,氮输入量能够很好地解释它对土壤有机碳矿化的抑制作用(Ramirez等,2010)。我们前期的研究也发现,硝酸氨对该区域沼泽化草甸土壤有机碳矿化的抑制作用随输入量增加而增强(Tao等,2013)。在本研究中,氨态氮输入抑制土壤有机碳矿化,但硝态氮输入对土壤有机碳矿化无显著作用。且硝酸氨中仅有一半氮素是氨态氮,较少的氨态氮可能不足以对土壤有机碳矿化产生明显的抑制作用。
硝态氮和氨态氮是大气氮沉降的两种主要形态(van Den Berg等,2008)。大气氮沉降中两种氮素的比例呈现较大的空间变异性(Klemm和Wrzesinsky,2007)。由于植物生长对两种氮素具有选择性吸收趋势(Verhoeven等,2011),且两种形态氮输入对土壤pH有不同影响(Enrique等,2008),这会影响土壤微生物活性(Currey等,2010),并进一步改变植物的固碳潜势及土壤有机碳的分解。本研究已初步发现,两种形态无机氮输入对土壤有机碳矿化产生不同的影响。后续研究应详细区分不同形态氮输入对生态系统碳循环过程诸环节的影响,并着重探讨其机理,以便进一步了解土壤氮的可利用性与土壤碳循环过程之间的关系。此外,在利用相关模型预测大气氮沉降对土壤碳库稳定性的影响时,也应区分不同形态氮素的影响,以利于更精确地评估未来土壤碳排放对大气氮沉降的响应。
4 结论
硝态氮和硝酸氨输入对两类泥炭沼泽土壤有机碳矿化无显著作用。氨态氮输入抑制土壤有机碳矿化,这有利于泥炭沼泽土壤有机碳的累积,增强泥炭沼泽的碳“汇”功能。本研究表明:详细区分不同形态氮输入对生态系统碳循环过程诸环节的影响是非常有必要的。同时,在预测氮沉降对土壤碳排放的影响时,也有必要区分不同形态氮素影响的差异,以精确评估大气氮沉降对土壤碳排放的影响。
ALLISON S D, CZIMCZIK C I, TRESEDER K K. 2008. Microbial activity and soil respiration under nitrogen addition in Alaskan boreal forest [J]. Global Change Biology, 14(5): 1156-1168.
BRAGAZZA L, FREEMAN C, JONES T, et al. 2006. Atmospheric nitrogen deposition promotes carbon loss from peat bogs [J]. PNAS, 103(51): 19386-19389.
CURREY P M, JOHNSON D, SHEPPARD L J, et al. 2010. Turnover of labile and recalcitrant soil carbon differ in response to nitrate and ammonium deposition in an ombrotrophic peatland [J]. Global Change Biology, 16(8): 2307-2321.
DENMAN K L, BRASSEUR G, CHIDTHAISON A, et al. 2007. Couplings between changes in the climate system and biogeochemistry[C]//Solomon S, Qin D, Manning M, et al. Climate Change 2007: The physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA.
ENRIQUE A G, BRUNO C, CHRISTOPHER A, et al. 2008. Effects of nitrogen availability on microbial activities, densities and functional diversities involved in the degradation of a Mediterranean evergreen oak litter (Quercus ilex L.) [J]. Soil Biology & Biochemistry, 40(7): 1654-1661.
EVANS C, GOODALE C, CAPORN S, et al. 2008. Does elevated nitrogen deposition or ecosystem recovery from acidification drive increased dissolved organic carbon loss from upland soil? A review of evidence from field nitrogen addition experiments [J]. Biogeochemistry, 91(1): 13-35.
FREY S D, KNORR M, PARRENT J L, et al. 2004. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests [J]. Forest Ecology and Management, 196(1): 159-171.
GORHAM E. 1991. Northern peatlands: role in the carbon cycle and probable responses to climatic warming [J]. Ecological Applications, 1: 182-195.
HILL P W, MARSHALL C, WILLIAMS G G. 2007. The fate of photosynthetically-fixed carbon in Lolium perenne grassland as modified by elevated CO2and sward management [J]. New Phytologist, 173(4): 766-777.
HOBBIE S E, EDDY W C, BUYARSKI C R, et al. 2012. Response of decomposing litter and its microbial community to multiple forms of nitrogen enrichment [J]. Ecological Monographs, 82(3): 389-405.
HUANG Z Q, CLINTON P W, BAISDEN W T, et al. 2011. Long-term nitrogen additions increased surface soil carbon concentration in a forest plantation despite elevated mineralization [J]. Soil Biology & Biochemistry, 43(2): 302-307.
JIN H J, YU Q H, GUO D X. 2007. Degradation of permafrost in the Xing’an Mountains, Northeast China [J]. Periglac Process, 18(3): 245-258.
JOHNSON D, MOORE L, GREEN S, et al. 2010. Direct and indirect effects of ammonia, ammonium and nitrate on phosphatase activity and carbon fluxes from decomposing litter in peatland [J]. Environmental Pollution, 158(10): 3157-3163.
KAYE J P, HART S C. 1997. Competition for nitrogen between plants and soil microorganisms [J]. Tree, 12(4): 139-143.
KLEMM O, WRZESINSKY T. 2007. Fog deposition fluxes of water and ions to a mountains site in Central Europe [J]. Tellus Series B: Chemical and Physical Meteorology, 59(4): 705-714.
KNORR W, PRENTICE I C, HOUSE J I, et al. 2005. Long-term sensitivity of soil carbon turnover to warming [J]. Nature, 433(7023): 298-301.
LÜ C Q, TIAN H Q. 2007. Spatial and temporal patterns of nitrogen deposition in China: Synthesis of observational data [J]. Journal of Geophysical Research 112, doi: 10.1029/2006JD007990.
MACK M C, SCHUUR E A G, BRET-HARTE M S, et al. 2004. Ecosystem carbon storage in arctic tundra reduced by long-term nutrient fertilization [J]. Nature, 431: 440-443.
MCANDREW D W, MALHI S D. 1992. Long-term N fertilization of a solonetzic soil: effects on chemical and biological properties [J]. Soil Biology & Biochemistry, 24(7): 619-623.
MIN K, KANG H, LEE D. 2011. Effects of ammonium and nitrate additions on carbon mineralization in wetland soils [J]. Soil Biology & Biochemistry, 43(12): 2461-2469.
PURI G, ASHMAN M. 1999. Microbial immobilization of15N-labelled ammonium and nitrate in a temperate woodland soil [J]. Soil Biology and Biochemistry, 31(6): 929-931.
RAMIREZ K S, CRAINE J M, FIERER N. 2010. Nitrogen fertilization inhibits soil microbial respiration regardless of the form of nitrogen applied [J]. Soil Biology and Biochemistry, 42(12): 2336-2338.
REY A, PETSIKOS C, JARVIS P G, GRACE J. 2005. Effect of temperature and moisture on rates of carbon mineralization in a Mediterranean oak forest soil under controlled and field conditions [J]. European Journal of Soil Science, 56(5): 589-599.
ROVIRA P, VALLEJO V R. 2002. Labile and recalcitrant pools of carbon and nitrogen in organic matter decomposing at different depths in soil: an acid hydrolysis approach [J]. Geoderma, 107(1): 109-141.
SCHIMEL J P, WEINTRAUB M N. 2003. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: a theoretical model [J]. Soil Biology and Biochemistry, 35(4): 549-563.
SINSABAUGH R L, MOORHEAD D L. 1994. Resource allocation to extracellular enzyme production: a model fro nitrogen and phosphorus control of litter mineralization [J]. Soil Biology and Biochemistry, 26(10): 1305-1311.
SÖDERBERG K H, BÅÅTH E. 2004. The influence of nitrogen fertilization on bacterial activity in the rhizosphere of barely [J]. Soil Biology and Biochemistry, 36(1): 195-198.
SONG M H, JIANG J, CAO G M, et al. 2010. Effects of temperature, glucose and inorganic nitrogen inputs on carbon mineralization in a Tibetan alpine meadow soil [J]. European Journal of Soil Biology, doi: 10.1016/j.ejsobi. 2010.09.003.
TAO B X, SONG C C, GUO Y D. 2013. Short-term effects of nitrogen additions and increased temperature on wetland soil respiration, Sanjiang Plain, China [J]. Wetlands, 33(4): 727-736.
TOBERMAN H, FREEMAN C, ARTZ R R E, et al. 2008. Impeded drainage stimulates extracellular phenol oxidase activity in riparian peat cores [J]. Soil Use and Management, 24(4): 357-365.
TURETSKY M R. 2004. Mineralization and organic matter quality in continental peatlands: the ghost of permafrost past [J]. Ecosystems, 7(7): 740-750.
VAN DEN BERG L J L, PETERS C J H, ASHMORE M R, et al. 2008. Reduced nitrogen has a greater effect than oxidized nitrogen on dry heathland vegetation [J]. Environmental Pollution, 154(3): 359-369.
VERHOEVEN J T A, BELTMAN B, DORLAND E, et al. 2011. Differential effects of ammonium and nitrate deposition of fen phanerogams and bryophytes [J]. Applied Vegetation Science, 14(2): 149-157.
VITOUSEK P M, ABER J D, HOWARTH R W, et al. 1997. Human alteration of the global nitrogen cycle: sources and consequences [J]. Ecological Applications, 7(3): 737-750.
ZHANG L H, SONG C C, WANG D X, et al. 2007b. Effects of exogenous nitrogen on freshwater marsh plant growth and N2O fluxes in Sanjiang Plain, Northeast China [J]. Atmospheric Environment, 41: 1080-1090.
ZHANG L H, SONG C C, ZHANG X H, et al. 2007a. Effects of nitrogen on the ecosystem respiration, CH4and N2O emissions to the atmosphere from the freshwater marshes in northeast China [J]. Environmental Geology, 52: 529-539.
刘兴土. 2005. 东北湿地 [M]. 北京: 科学出版社.
鲁如坤. 1999. 土壤农业化学分析方法 [M]. 北京: 北京农业科技出版社.
王春阳, 周建斌, 董燕婕等. 2010. 黄土区六种植物凋落物与不同形态氮素对土壤微生物量碳氮含量的影响[J]. 生态学报, 30(24): 7092-7100.
周幼吾, 郭东信, 邱国庆. 2000. 中国冻土 [M]. 北京: 科学出版社.
Effects of Nitrogen Forms on Carbon Mineralization in Peatland Soils
TAO Baoxian1,2, SONG Changchun2,*,
1. Liaocheng University, College of Environment and Planning, Liaocheng 252059, China; 2. Northeast Institute of Geography and Agoecology, Chinese Academy of Sciences, Changchun 130102, China
Nitrogen (N) deposition is one of the most significant environmental change factors for terrestrial ecosystems. The N deposition could be in two forms as ammonium and nitrate, while the proportions of these two N forms in atmospheric N depositon have great spatial variation. How various N forms affect carbon (C) mineralization is critically important while is lacking of investigation. In this study, an incubation experiment was carried out to investigate the effects of N forms on C mineralization using peat samples collected from permafrost (PR) and seasonally frozen region (SFR) in Northeast China. The samples were incubated for 60 days under the conditions of 15 ℃ and 100% water holding capacity. We found that the storage of C was larger in PR (C 17.60 kg·m-2) than that in SFR (C 13.06 kg·m-2). The cumulative CO2production was larger in PR compared with those in SFR, while the surface peat layer (0~15 cm) produced more CO2than subsurface peat layer (15~30 cm) within the same peatland. Ammonium addition suppressed C mineralization, and the cumulative CO2production was decreased ranging from 12.08% to 14.90% in PR, and from 7.28% to 12.57% in SFR. However, nitrate and ammonium nitrate additions produced neutral effect on C mineralization. Moreover, soil depth, peatland types and N forms had significant and interactive effects on C mineralization. This study highlights the importance of distinguishing nitrate and ammonium when estimating/projecting C fluxes in response to N addition. The ecosystem models should separately simulate nitrate and ammonium when estimating the effects of N addition on C storage.
Nitrogen forms; carbon mineralization; peatlands; Northeast China
10.16258/j.cnki.1674-5906.2015.03.002
S153
A
1674-5906(2015)03-0372-06
陶宝先,宋长春. 氮素形态对泥炭沼泽土壤有机碳矿化的影响[J]. 生态环境学报, 2015, 24(3): 372-377.
TAO Baoxian, SONG Changchun. Effects of Nitrogen Forms on Carbon Mineralization in Peatland Soils [J]. Ecology and Environmental Sciences, 2015, 24(3): 372-377.
国家自然科学基金项目(41125001;40930527);中国科学院战略性先导科技专项-应对气候变化的碳收支认证及相关问题(XDA05050508;XDA05020502);中国科学院知识创新工程重要方向项目(KZCX2-YW-JC301);山东省自然科学基金(ZR2014DQ015);聊城大学博士启动基金(318051430)
陶宝先(1981年生),男,讲师,博士,主要研究方向为湿地生态过程。E-mail: taobaoxian@lcu.edu.cn *通讯联系人,E-mail: songcc@neigae.ac.cn
2015-01-12

