珠江口双胞旋沟藻Cochlodinium geminatum赤潮生消过程的环境特征初步分析
庞勇,聂瑞,吕颂辉
1. 海南省海洋与渔业科学院,海南 海口 570125;2. 海南省海洋监测预报中心,海南 海口 570206;3. 暨南大学赤潮与海洋生物学研究中心,广东 广州 510632
珠江口双胞旋沟藻Cochlodinium geminatum赤潮生消过程的环境特征初步分析
庞勇1,3,聂瑞2,3,吕颂辉3
1. 海南省海洋与渔业科学院,海南 海口 570125;2. 海南省海洋监测预报中心,海南 海口 570206;3. 暨南大学赤潮与海洋生物学研究中心,广东 广州 510632
为了解2009年珠江口双胞旋沟藻赤潮生消过程,探索其生消机制,对赤潮进行了连续10 d(10月28日─11月6日)的跟踪监测,设置了3条监测断面,共12个站位。通过现场测定和实验室分析,研究赤潮藻密度、叶绿素a、营养盐、温度、盐度、pH和溶解氧的变化规律。赤潮区双胞旋沟藻的密度先升高后降低,最高密度达到2.765×107cells·L-1,叶绿素a含量呈先升后降的趋势,最大值达到172.76 μ·L-1,监测海域无机氮和无机磷均处于富营养化水平,无机氮表现出先增加后减少,在赤潮末期稍有回升的趋势,无机磷总体呈现下降趋势。赤潮区水温变化范围为19.33~27.66 ℃,盐度的变化范围为9.16~31.5,pH的变化范围为7.45~8.51,溶解氧的变化范围为5.50~11.45 mg·L-1。通过对赤潮期间的环境因子分析,并结合2006年该海域发生的双胞旋沟藻赤潮事件和近几年周边海域发生赤潮的情况,得出以下结论:2009年珠海双胞旋沟藻赤潮规模较大,是中国沿海由双胞旋沟藻引起的最大规模赤潮。10月25日─10月27日为赤潮的起始发展阶段,10月28日─11月1日为赤潮形成维持阶段,11月2日─11月6日为赤潮消亡阶段。赤潮生消过程浮游植物群落结构发生了变化,赤潮持续期双胞旋沟藻占主要优势,赤潮消亡期间硅藻(骨条藻Skeletonema spp.和角毛藻Chaetoceros spp.)数量增加,演替双胞旋沟藻成为优势种。此次赤潮事件中有机氮浓度较高,约占总氮的 60%,是赤潮藻大量繁殖代谢所致。研究海域处于严重富营养化水平,这是诱发赤潮发生的基础。同时,长时间处于高温、低盐的环境,使双胞旋沟藻急剧繁殖,诱发赤潮。在赤潮后期,恶劣的气象条件是赤潮消退的主要原因。
珠江口;赤潮;双胞旋沟藻;环境因子
改革开放 30年多以来,经济的飞速发展带来了巨大的环境问题,尤其是近海海域的环境污染问题,大量的陆源污染物随河流排入海洋,使近岸海域海水富营养化加剧,赤潮爆发频繁,严重影响和制约我国海洋经济的发展。近年来,旋沟藻属(Cochlodinium)在全球众多海域发生过赤潮,由于该属中某些种类发生赤潮时会产生毒素,如多环旋沟藻(Cochlodinium polykrikoides)能产生致鱼死亡的毒素,对渔业经济造成巨大的损失而引起极大的关注(Kim等,2004;Matsuoka等,2008;Kudela等,2008)。旋沟藻赤潮在我国还比较少见,尤其是双胞旋沟藻赤潮,但是近年来,由旋沟藻引发的赤潮在我国海域逐渐增多(Du等,2004;欧林坚等,2010)。2006年在珠江口桂山岛附近海域首次爆发双胞旋沟藻赤潮,同年10月至11月,在珠海香洲渔港附近海域先后发生两起由该种引发的赤潮。2009年10月至11月,在珠江口珠海海域再次爆发大规模的双胞旋沟藻赤潮,为了解此次赤潮生物生态特征,本文根据赤潮跟踪监测资料,对赤潮生消过程的环境特征进行初步分析,探索和研究赤潮的发展过程,为赤潮防控提供科学依据。
1 材料与方法
1.1 站位的设定
根据赤潮面积的范围,设置3个监测断面,分别为淇澳岛断面(A断面)、唐家湾断面(B断面)和香洲湾断面(C断面),每个断面设置4个监测站位,每天采样时间为 10:00─16:00,经度范围为113.5°~113.8°N,纬度为22.2°~22.5°E(图1)。
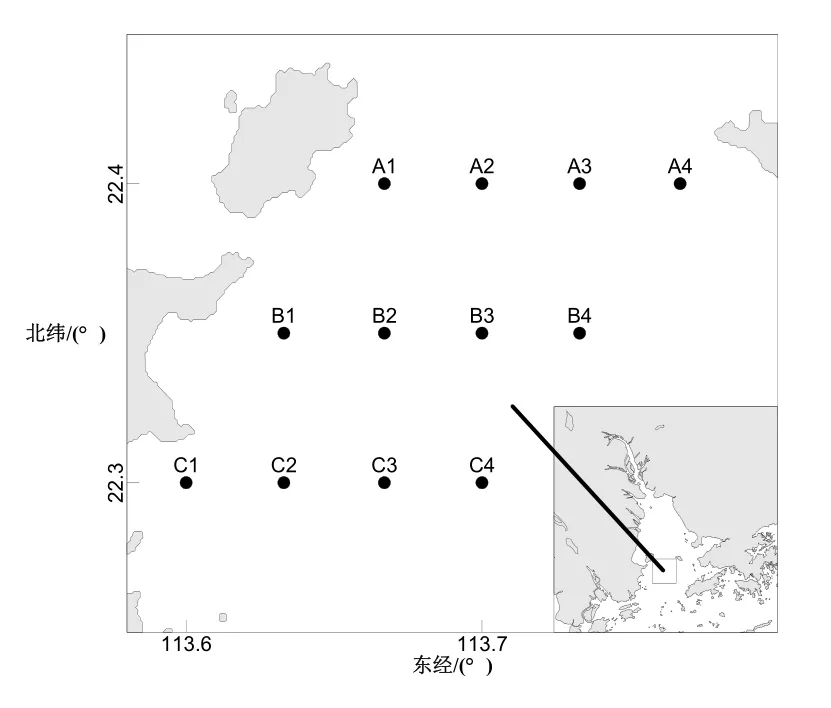
图1 采样站位Fig. 1 Sampling stations in Zhuhai
1.2 采样及测定方法
浮游植物的调查方法依照《海洋调查规范》(国家质量监督检验检疫总局和国家标准化管理委员会,2008),采用孔径为76 μm的浅水Ⅲ型浮游生物网自底至表垂直拖取,采集到的浮游植物样品用甲醛固定保存,保持甲醛的终体积浓度为 5%。样品带回实验室,静置沉淀48 h后,用虹吸管轻轻吸掉上清液,将样品浓缩至100~200 mL,浓缩的终体积具体视浮游植物细胞丰度而定。使用 LEICA DM1000光学显微镜和0.1 mL浮游植物计数框定量进行种类鉴定和数量统计。
水温、盐度、pH和溶解氧(DO)使用YSI多参数水质分析仪(YSI6600V2)现场测定,叶绿素a(Chl-a)按《海洋调查规范》规定的荧光法进行测量分析(Turner Designs Trilogy),营养盐使用美国HACH的LACHAT QC8500流动注射分析仪分析(KLAUS,1976;国家质量监督检验检疫总局和国家标准化管理委员会,2008),其中DIN为NO3-N、NO2-N和NH4-N之和,DIP为活性磷酸盐,DON为溶解性有机氮,DOP为溶解性有机磷,TDN为总溶解氮,TN为总氮。
2 结果
2.1 双胞旋沟藻赤潮事件描述
2009年10月下旬,在珠海海域爆发双胞旋沟藻赤潮,野狸岛-香炉湾-淇澳岛东-内伶仃-九洲港-湾仔等海域均有分布,面积约300 km²,其中香洲港及邻近近岸海域、内伶仃岛至香洲港中部海域受赤潮影响程度最为严重,大面积连续分布,水色呈褐色至深褐色,形似油污(图2A)。连续跟踪监测从10月27日开始,按照设置的断面和站位实施,直到2009年11月6日赤潮完全消失,跟踪监测结束。

图2 珠海双胞旋沟藻赤潮(A)及细胞的光学显微照片(B)Fig. 2 C. geminatum bloom (A) and the microscopcial photo of the two-cell colony (B)
10月28日,天气晴朗,气温偏高,赤潮区主要位于香洲湾断面和唐家湾断面;10月30日和10月 31日天气晴朗,气温持续偏高,为赤潮最严重时段,所有监测站位均有赤潮分布,唐家湾断面最为严重,赤潮区域由近岸向远岸漂移;10月31日,天气晴朗且有风,赤潮发生的主要区域在唐家湾和淇澳岛至内伶仃岛的断面,面积有所减少;从 11月1日开始,气温下降,赤潮面积减小,赤潮区域主要位于唐家湾和淇澳岛附近海域,赤潮强度减弱;11月2日,海上大风大浪,气温剧降,未出海监测;11月3日,继续大风天气,赤潮被吹散,水体浑浊,透明度降低;11月4日,天气转晴,赤潮面积继续减小,仅在香洲港到内伶仃岛海域及唐家湾附近海域有块状狭长赤潮带分布,且可见白色泡沫状物质;11月6日,泡沫状漂浮物随处可见,赤潮基本消失,跟踪调查结束。根据调查及走访,赤潮发生期间及消退之后,均未见鱼类异常死亡现象或报道。
2.2 赤潮藻种及其在赤潮发生期间的变化
本次赤潮原因种为双胞旋沟藻,该藻有游泳单细胞和成对细胞两种形态,多为两两成对的群体(图 2B)。细胞近椭圆形,背腹略扁,细胞长宽为30~40 μm,横沟深,左旋,绕细胞约1.5圈,细胞核圆形,中位,色素体网状黄褐色,充满细胞内部(欧林坚等,2010)。
赤潮发生期间,浮游植物除双胞旋沟藻外,还有一定数量的甲藻(如链状亚历山大藻Alexandrium catenatum和血红哈卡藻Akashiwo sanguinea)和硅藻(如骨条藻和角毛藻)。赤潮前期和中期,双胞旋沟藻在浮游植物群落中占绝对优势,约占80%~90%,其细胞密度最高达2.765×107cells·L-1;赤潮后期,双胞旋沟藻数量减少,硅藻增多;末期,除了硅藻外,还出现少量球形棕囊藻(Phaeocystisglobosa)。本次赤潮最高密度出现在B2站位,该海域为此次赤潮发生的中心区域,定为赤潮区;A4站位受珠江冲淡水影响较大,且位于珠江口航道区域,受此次赤潮影响较小,属于赤潮强度较弱的区域,定为对照区。
根据跟踪监测的结果,2009年10月28日至11月1日,双胞旋沟藻占主要优势,其密度均大于106cells·L-1,如图3所示,10月29日达最大值,为1.89×107cells·L-1;11月2—3日调查海域大风大浪,气象条件恶劣,双胞旋沟藻密度剧降;11月4日,气温回暖,双胞旋沟藻密度有所回升,4日以后,旋沟藻密度逐步减小,低于105cells·L-1。此外,本文选取硅藻中数量较多的角毛藻和骨条藻作为硅藻的代表,进行了跟踪监测,结果如图3所示,赤潮前期,双胞旋沟藻的密度保持较高密度,且有小幅增加,角毛藻和骨条藻密度较低,赤潮中、后期,双胞旋沟藻密度大幅减小,角毛藻和骨条藻等硅藻数量明显增加。
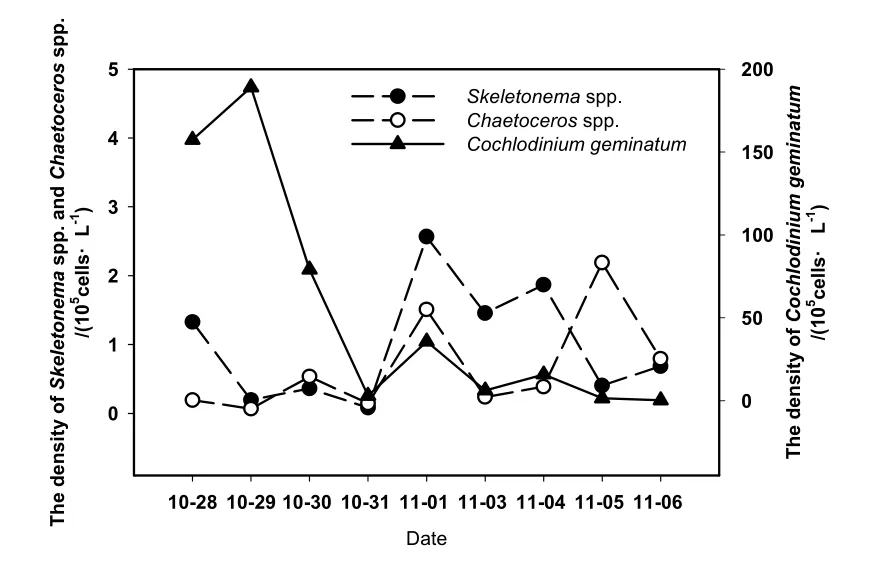
图3 赤潮双胞旋沟藻与硅藻的变化Fig. 3 Variations of C. geminatum and diatom in the center of red tide
2.3 赤潮生消过程中各环境要素的时间变化
2.3.1 Chl-a含量的变化
Chl-a的变化能够表现赤潮生消过程赤潮原因藻的变化情况,也是赤潮监测的主要指标。赤潮发生过程中,Chl-a含量变化规律明显(图4),在赤潮区域,10月28日Chl-a的峰值为134.35 μg·L-1,10月29日为172.76 μ·L-1;11月1日,该区域的Chl-a仍高达85.1 μg·L-1,到11月2日以后,迅速下降至5 μg·L-1左右,恢复到该海区正常范围(黄良民等,1997);在对照区,叶绿素 a显著低于赤潮区域,范围约在 5~20 μg·L-1,仍略高于该海域Chl-a的正常水平。
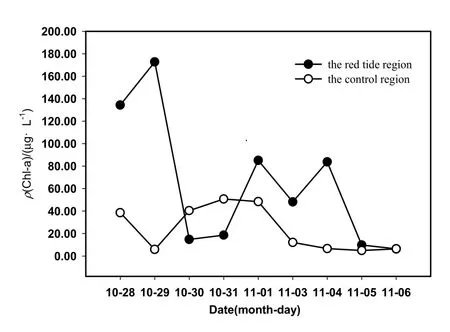
图4 赤潮过程中叶绿素a的变化Fig. 4 Variations of Chl-a concentration during red tide
2.3.2 营养盐含量和组成变化
水体富营养化是赤潮爆发的主要原因之一,海水富营养化阈值范围一般DIP为15~20 μg·L-1、DIN为 200~300 μg·L-1,营养盐对赤潮的发生起着基础性作用(霍文毅等,2001;钟思胜等,2002;王汉奎等,2003;李涛等,2005)。根据跟踪监测的结果显示:DIP都大于15 μg·L-1,DIN大于300 μg·L-1,全部监测海域均属于富营养化水体,见图 5。在赤潮发前期,赤潮区域的DIN和DIP含量很高,随着赤潮的持续,藻类急剧繁殖,消耗大量DIP和DIN,导致DIP和DIN下降,随着赤潮的消退,DIP和DIN恢复到一定水平;对照区的DIP和DIN水平基本维持的一定水平,无较大的波动。
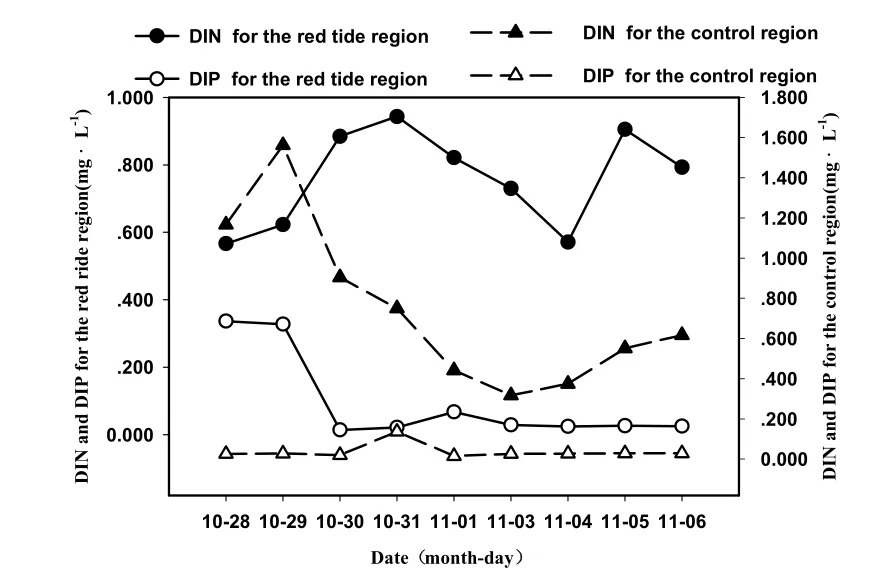
图5 赤潮过程中DⅠN和DⅠP的变化Fig. 5 Variations of DIN and DIP concentration during red tide
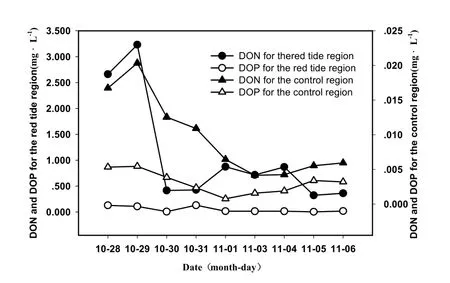
图6 赤潮过程中DON和DOP的变化Fig. 6 Variations of DON and DOP concentration during red tide
有机营养盐的分析结果显示,赤潮区域和对照区的DON和DOP的变化趋势一致,见图6。赤潮区域,DON和DOP测值在赤潮前期较高,随着赤潮原因藻类的大量繁殖,赤潮区域无机营养盐含量减少,海区有机营养盐也被分解消耗,DON和DOP均出现下降趋势且维持的一定水平;赤潮后期,大量赤潮生物消亡代谢,导致有机营养盐高于无机营养盐。
赤潮前期,浮游植物中双胞旋沟藻占主要优势,在参与对环境因子竞争中,硅藻所占比例比较小,以致SiO3-Si的测值在赤潮前期比较高(图7);随着赤潮的持续,浮游植物群落发生演替,硅藻逐步取代旋沟藻的优势地位,以致 SiO3-Si呈明显的下降趋势;在赤潮末期,硅藻的分泌物或死亡使SiO3-Si的测值又略有增加,同时加上珠江口径流补充机制,SiO3-Si测值又呈上升趋势。
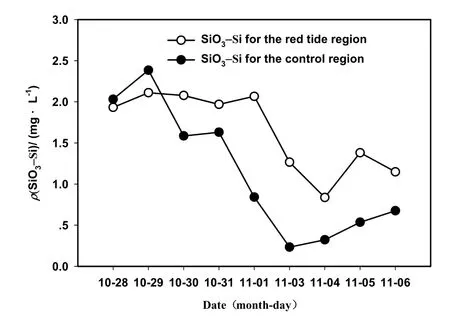
图7 赤潮过程中SiO3-Si的变化Fig. 7 Variations of SiO3-Si concentration during red tide
2.3.3 各形态氮的变化
有研究(王汉奎等,2003)报道,引起近岸海域有机质污染和富营养化的重要原因是各种形态氮化合物的不断积累。本次赤潮区域的 NO3-N、NO2-N、NH4-N、DON和TDN的平均质量浓度分别为0.61、0.09、0.07、1.10和1.86 mg·L-1,各形态氮分别占总溶解氮的32.8%、4.8%、3.8%和59%。在对照区域,NO3-N、NO2-N、NH4-N、DON和TDN的平均质量浓度分别为 0.51、0.13、0.10、0.01和0.75 mg·L-1,各形态氮分别占总氮的68.0%、17.3%、13.3%和1.4%。可见,赤潮区域的氮以有机氮居多,在赤潮持续过程中,赤潮生物繁殖消耗大量无机氮,致DIN含量降低,而赤潮生物的消亡或腐败,导致赤潮区域DON含量高于DIN,赤潮区域DON对总氮贡献值很大,根据有关研究,DIN含量较低时,赤潮生物能够有效利用DON作为氮源维持自身生长(李斌等,2009)。
2.3.4 温度、盐度、pH和溶解氧的变化
调查期间,赤潮区域和对照区的水温、盐度、pH变化趋势一致(图8)。整个赤潮区水温变化范围为 19.33~27.66 ℃,平均为(24.97±2.13) ℃;盐度的变化范围为 9.16~31.50,平均为 20.64±4.44; pH的变化范围为7.40~8.51,平均为7.39±0.19;DO的变化范围为5.25~12.08 mg·L-1,平均为7.39±1.07。赤潮期间,赤潮区域和对照区的pH和DO值均较高(图9),pH值略有上升趋势且维持一定水平,DO随着赤潮的减弱和浮游植物密度的降低,呈降低的趋势;赤潮前期,调查区域的盐度值较低,随着赤潮的持续,盐度值有所升高;赤潮前期,持续高温,在赤潮后期气温剧降,水温也与气温具有同样的变化趋势。
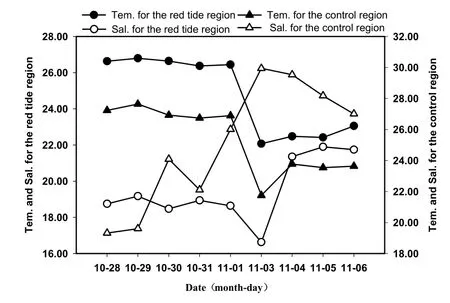
图8 赤潮区域与对照区温度和盐度的变化Fig. 8 Variations of DON and DOP concentration the center and edge region during red tide
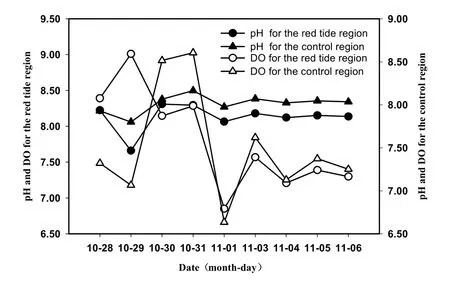
图9 赤潮区域与对照pH和DO的变化Fig. 9 Variations of pH and DO concentration the center and edge region during red tide
3 讨论
在对赤潮生消过程的监测发现,珠江口海域受环境影响较大,水文、气象条件复杂,同时加上珠江径流带来的大量营养物质,近年来,珠江口海域的赤潮爆发频繁,受各种环境因子共同影响所致,根据根据跟踪监测结果,此次赤潮区域的水域处于富营养化水平,富营养化是赤潮爆发的基础条件。
3.1 本次赤潮事件分析
3.1.1 赤潮生物
赤潮期间,甲藻和硅藻数量高峰的交替出现,表明赤潮生物之间存在着营养竞争和互相演替的过程,也印证了赤潮消亡过程由通常的硅藻群落取代甲藻的生态特征,与以往在该海域发生赤潮的研究结果相一致(黄长江和董巧香,2000;王朝晖等,2001;钟思胜等,2002)。
3.1.2 Chl-a
Chl-a是主要赤潮监测指标,能够很好表现区域海域的浮游植物情况,由本文监测结果分析可知,Chl-a的平均值为32.99 μg·L-1,远大于该海域的正常水平。随着水温的降低,Chl-a也明显降低,水温回升后,Chl-a也随之稍有回升,但随后逐渐降低,直到赤潮完全消失,Chl-a降至海区正常值。
浮游植物数量的变化趋势与Chl-a相一致,赤潮原因种出现的最高密度为1.89×107cells·L-1,Chl-a与赤潮藻密度有很强的正相关(P<0.01),Chl-a越高,赤潮藻密度越高,Chl-a能够反映赤潮生消过程中赤潮原因藻的变化情况。
3.1.3 营养盐
富营养化是赤潮爆发的主要原因,营养盐对赤潮的发生起着基础性作用,结合本文调查结果,本文调查海域水体均呈富营养化状态。研究发现,赤潮区域DIN在赤潮持续过程中先减少,后又有所回升,最后基本保持在一定水平,但均高于富营养化水平,其主要原因是在赤潮初期,赤潮原因种的大量繁殖,消耗大量的DIN,随着赤潮的持续,赤潮原因种及其他海洋生物的死亡或腐败,使DIN的值回升。对照区域受珠江冲淡水和附近航道的影响,DIN的变化较大。从整个调查区域来看,DIN测值在0.5~1.5 mg·L-1之间,赤潮区域的DIP与DIN有相同的变化趋势,赤潮前期DIP较高,随着赤潮的持续,赤潮原因种生长繁殖,DIP有所减少,在对照区域,DIP的变化比较平稳,赤潮区域的DIP显著大于对照区域(P<0.05)。另外,整个监测海域的DIP随叶绿素a的升高而升高,呈极显著正相关性(P<0.01)。
赤潮区域的DON和DOP远大于对照区域,DON与Chl-a有极显著正相关(P<0.01),Chl-a随DON的增高而增大。赤潮区域的DOP均大于0.120 mg·L-1,而对照区域的DOP仅为0.006 mg·L-1左右,Chl-a与DOP有极显著正相关(P<0.01)。对各种形态的氮的分析可知,赤潮区域的DON所占的比重高于DIN,与之相对应的对照区域,则占主要的是DIN,赤潮区域 DON异常的高,能够很好反映该区域的赤潮原因种分泌或腐败的情况,也能反映出赤潮区域DON对DIN的补充机制,这也是诱发赤潮持续的原因之一。
对照区域DON和TN均明显低于赤潮区域,且赤潮区域DON对TN贡献较大,而对照区域则以DON贡献较大。由于赤潮生物大量吸收DIN,致赤潮区域含量较低,而海洋生物排泄物或赤潮生物死亡被降解产生DON,导致DON含量明显高于DIN。结果表明,赤潮区域各种形态氮化合物的不断积累是的有机质污染和富营养化的重要原因,该结果与珠江口海域条纹环沟藻赤潮的生消过程的研究结果一致(王汉奎等,2003)。
跟踪监测中的 SiO3-Si的含量先逐渐降低,然后缓慢上升至一定水平,在赤潮前期,浮游植物中双胞旋沟藻占主要优势,硅藻较少,对海域中的SiO3-Si消耗较少,以致SiO3-Si的含量较高;随着赤潮的持续,营养结构发生变化,赤潮生物也发生演替,硅藻逐步演替旋沟藻成为海域的优势种群,同时,消耗大部分的SiO3-Si,以致SiO3-Si明显下降;在赤潮末期,硅藻分泌或死亡,SiO3-Si略有上升趋势,最终保持在一定水平,这一现象与以往的相关研究一致(王朝晖等,2001;钟思胜等,2002;欧林坚等,2010)。
3.1.4 其他理化因子
赤潮发生期间,DO最高达12.08 mg·L-1,pH最高达8.51,调查海域pH和DO值均较高,与以往的相关调查结果一致(霍文毅等,2001;王汉奎等,2003)。由于浮游植物的大量繁殖,消耗水体中的CO2,使pH值升高,释放出大量O2,使DO值增大,所以调查海域pH值略呈上升趋势且维持在一定水平,DO随着赤潮的减弱,略呈下降的趋势。在赤潮前期,赤潮区域受珠江口径流影响较大,区域的盐度值较低,随着赤潮的持续,外海高盐海水在该区域内占有优势,盐度值也相应升高。赤潮前期,持续高温,在赤潮后期气温突降,可见,温度的变化也是赤潮生消的主要原因之一。
3.2 与相关赤潮事件的比较分析
3.2.1 珠海海域双胞旋沟藻赤潮比较分析
双胞旋沟藻是近年来我国沿海新出现的赤潮藻,已在广东珠江口海域多次引发较大规模的赤潮,对该赤潮藻的研究,有利于丰富我国赤潮藻生理、生态学研究的研究基础。本文就2006年4月和2009年10─11月珠海双胞旋沟藻赤潮事件进行分析研究,探究双胞旋沟藻赤潮发生的机理,并进一步做好赤潮的预防预报。
2006年在该海域发生的双胞旋沟藻赤潮原因种的最高密度远低于2009年该种的密度,2006年与2009年珠海双胞旋沟藻主要指标见表1。此次赤潮发生区水温变化范围较大,赤潮前期温度较高,赤潮生物密度较大,赤潮后期,随着气温降低赤潮逐步消退;盐度的变化范围也相对较大,主要原因可能是此次赤潮发生前降雨少,陆地径流减少,以致赤潮前期盐度较高;而赤潮中期有一次小规模的降雨,盐度随之有所下降,受盐度变化影响较大。而 2006年赤潮爆发的温度范围较小,波动范围在4 ℃左右,盐度变化范围小,赤潮面积也较小,赤潮生消受盐度和水温的影响也较小。
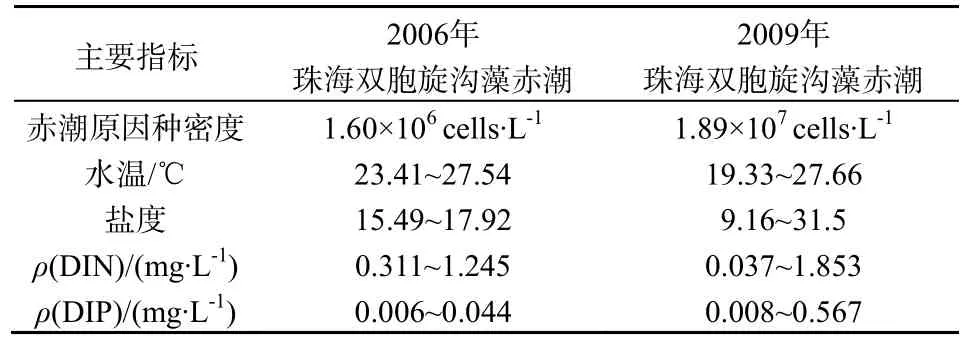
表1 2006年与2009年珠海双胞旋沟藻赤潮主要指标(欧林坚等,2010)Table 1 Main indicators of the C. geminatum blooms in 2006 and 2009
2009年的赤潮事件中,温度与双胞旋沟藻密度呈极显著的正相关关系(P<0.01),盐度与双胞旋沟藻密度呈显著负相关关系(P<0.05),温度与Chl-a呈极显著正相关关系(P<0.01),盐度与Chl-a呈极显著负相关关系(P<0.01)。相比之下,2006年的赤潮事件中,双胞旋沟藻密度与温度呈显著正相关关系(P<0.05),与盐度呈显著正相关关系(P<0.05)。可见,温度和盐度是影响 2009年赤潮生消的重要环境因子,与 2006年赤潮事件不同之处在于盐度的影响,在珠江口海域,盐度主要受径流影响,在赤潮初期,赤潮海域盐度较低,珠江径流对其影响较大,径流直接体现在高浓度的营养盐水平,可见,本次赤潮发生时,该海域正处于低盐、高温、高营养盐的环境。
2006年赤潮事件的溶解氧变化情况与此次赤潮基本一致,白天监测时段溶解氧浓度偏高,均与Chl-a呈现正相关关系(P<0.05),这是由于浮游植物夜间只进行呼吸作用,而白天同时进行呼吸作用和光合作用,因此在营养条件充足的情况下,浮游植物快速生长,溶解氧较高。
此次赤潮期间,DIN的最大值为1.853 mg·L-1,高于2006年赤潮中DIN最大值(1.245 mg·L-1),DIP的最大值为0.567 mg·L-1,远高于2006年赤潮中DIP最大值(0.044 mg·L-1),SiO3-Si的变化范围为(0.089~2.933)mg·L-1,本次赤潮期间,N/P、Si/P和Si/N的变化范围分别为3~193、5~193和0~2,平均分别为78、71和1,根据Dortch和Whitledge(1992)、Justic等(1995)确定限制性因子的方法(DORTCH,1992;JUSTICE,1995),可确定本次赤潮发生海域的限制性因子为DIP。从N/P值的变化趋势看,N/P的值先是升高后降低,然后又有所回升,赤潮期间,N/P>16的区域达到 92.59%,N/P>22的区域达90.47%,Si/P值的变化趋势与N/P值变化趋势一致,Si/P>22的区域达85.19%,Si/N值的总体呈下降趋势,Si/N<1的区域达 65.74%。有研究发现N/P的减少和磷源的输入,有利于赤潮的爆发(Hodgkiss和Ho,1997),此次赤潮期间,Si/N的平均值较低,有利于甲藻的生长,这与赤潮原因种为甲藻相符合。
根据与2006年赤潮事件比较可知,2次赤潮发生的前提条件均是丰富的营养盐和适宜的温度,可见,营养盐和温度是诱发赤潮的主要原因,不同之处在于2009年赤潮的消退是由于气象环境的突变,而 2006年赤潮的消退是由于浮游生物正常的演替所致。
3.2.2 与近年周边海域赤潮比较分析
本文研究的赤潮发生于 2009年的珠江口珠海海域,为了进一步对本次赤潮发生的特点进行分析和研究,收集近年来我国沿海赤潮发生的相关报道,研究赤潮发生的异同,为赤潮的防控提供一定的数据支撑。
2006年夏季,渤海湾赤潮重点监控区发生夜光藻(Noctiluca scintillans)赤潮,尹翠玲等人对夜光藻赤潮的生消过程进行了初步分析和研究,结果显示 pH值、Chl-a、DO、化学需氧量(COD)和营养盐的变化均与夜光藻快速增值前浮游植物的迅速生长有关,与温度和盐度的关系不大,可见,夜光藻赤潮与营养盐和有机物含量有密切关系,由于夜光藻属于混合营养方式,这种特殊的营养方式,导致夜光藻赤潮频繁发生(尹翠玲等,2013)。彭模等人利用 2004─2008年连云港海州湾赤潮监控区监测站位资料,对赤潮发生与水文、气象和环境等因子进行研究,结果显示在连云港海州湾附近赤潮发生时期一般在5─10月,主要以甲藻和硅藻赤潮为主,赤潮发生阶段水温较高,消亡阶段水温呈下降趋势,水温是影响赤潮生消的主要环境因子(彭模等,2010)。2007年在烟台四十里湾发生血红哈卡藻赤潮,根据作者分析,诱发此次赤潮的主要化学因素为DIP、盐度和COD,而DIP是该赤潮生消发展的最关键化学因素,极端降雨下大量陆源污染物注入该海域是此次赤潮发生的直接外因,同时,雨后高温、晴朗的天气为赤潮藻的迅速增殖提供了有利条件(刘义豪等,2012;喻龙和郝彦菊,2009)。李鸿妹等人对2010年春季东海赤潮发生前后的营养盐及溶解氧进行了研究,结果显示甲藻赤潮消耗大量的 DIN和 DIP,甲藻的繁殖不消耗SiO3-Si,虽然,在赤潮末期浮游植物群落会发生演替,但是由于长江冲淡水的补充,SiO3-Si的浓度在赤潮前后变化不大(李鸿妹等,2013)。2012年在福建三都湾发生血红哈卡藻赤潮,研究结果显示,赤潮发生与水温、盐度和营养盐有密切联系,适宜水温和气候条件对赤潮生物的萌发提供了有利的条件,盐度的降低与降雨和径流有关,降雨和径流带来大量的陆源营养物质,赤潮区域处于富营养化状态而诱发赤潮(黄伟卿等,2012)。2012年在渤海湾赤潮监控区发现2次赤潮,均为复合型硅藻赤潮,赤潮发生时水温的变化范围为24.95~28.75 ℃,盐度变化范围为 18.639~28.645,赤潮发生期间的DIN、DIP和SiO3-Si随赤潮的发展先降低后升高的趋势,研究结果显示,赤潮海域处于富营养化状态,诱导赤潮发生的主要原因是高浓度的营养盐(尹翠玲等,2014)。2013年在福建小岞杜厝海域发生的2次赤潮,均为硅藻复合型赤潮,在高温、高湿、无风浪的条件下,促进藻类繁殖,导致该海域发生赤潮,出现降雨是赤潮消退的主要原因(李星,2014)。2012年福建长乐海区发生东海原甲藻(Prorocentrum donghaiense)赤潮,研究结果显示东海原甲藻在低磷贫瘠的环境中仍能快速增长并聚集,可见东海原甲藻对适应磷胁迫能力较强,并能较好的利用 DIN作为主要的营养成分,NO3-N、NO2-N、水温和盐度为该赤潮的限制性因子(李正华,2012)。2012年冬季厦门海域发生血红哈卡藻赤潮,研究结果显示,在赤潮初期中肋骨条藻和血红哈卡藻的密度相当,随着赤潮的持续,在种间竞争中血红哈卡藻占据了优势,赤潮发生过程中有一段持续升温的过程,是导致该赤潮持续时间很长的主要原因(陈国斌,2012)。2012年厦门同安湾海域发生1次三相型赤潮,三相型赤潮原因种为中肋骨条藻(Skeletonema costatum)、血红哈卡藻和角毛藻,研究结果显示水体的富营养化和持续的高温天气,加上水文气象环境的相对稳定是诱发赤潮的主要原因,消退的原因主要为台风的影响(俞秀霞,2012)。2012年山东烟台四十里湾再次发生血红哈卡藻赤潮,研究结果显示赤潮爆发的原因为较高的水温、良好的光照条件和充足的DIP(喻龙等,2014)。
可见,近几年诱发赤潮的原因因海域差异存在着多样性,基本上营养盐是赤潮爆发的基础,营养盐主要来源于地表径流,径流的注入使盐度降低,因此,径流与盐度密切相关。另外一个重要因素就是温度,有丰富的营养盐仅仅是赤潮诱发的基础,温度适宜才能使赤潮藻繁殖聚集,同时温度也是赤潮消退的重要因素。水文环境也是赤潮生消的重要因素,无风无浪、潮流作用小,对小范围内的营养物质扩散能力弱,对赤潮爆发有一定的促进作用,同时,极端水文条件也能促使赤潮快速消退。
结合本文的双胞旋沟藻赤潮事件,本文研究海域呈富营养化水平,这是诱发赤潮的基础,加上长时间处于高温、低盐的环境中,致使双胞旋沟藻快速繁殖聚集,在赤潮后期受极端天气的影响,气温下降,大风大浪,赤潮被吹散,营养盐扩散加快,赤潮消退,这与近几年有关赤潮生消的研究结果基本一致。
4 结论
2009年珠海双胞旋沟藻赤潮规模较大,是中国沿海由双胞旋沟藻引起的最大规模赤潮,赤潮的生消过程中,10月25日─10月27日为赤潮的起始发展阶段,10月28日─11月1日为赤潮形成维持阶段,11月2日─11月6日为赤潮消亡阶段。赤潮生消过程浮游植物群落结构发生了变化,赤潮持续期由双胞旋沟藻占主要优势,赤潮消亡期间双胞旋沟藻数量减少,硅藻(骨条藻和角毛藻)数量增加,演替双胞旋沟藻成为优势种。此次赤潮事件中,赤潮藻大量繁殖代谢,致使有机氮浓度较高,占总氮的比例约60%,而磷是珠江口海域的限制性因子,是本次赤潮的重要限制性因子,研究海域处于严重富营养化水平,这是诱发赤潮发生的基础。本次赤潮发生时,由于降雨较少,气温较高,该海域正处于低盐、高温、高营养盐的环境之中,双胞旋沟藻快速繁殖聚集,诱发赤潮;而在赤潮后期受极端天气的影响,气温下降,大风大浪,赤潮被吹散,营养盐扩散加快,是赤潮消退的主要原因。
DORTCH Q, WHITLEDGE T E. 1992. Does nitrogen or silicon limit phytoplankton production in the Mississippi River plume and nearby regions[J]. Continental Shelf Research, 12: 1293-1309.
DU Q, HUANG Y J, WANG X F. 1993. Toxic dinoflagellate tide by a Cochlodinium sp. along the coast of Fujian, China [C]//SMAYDA T J, SHIMIZU Y. Toxic Phytoplankton Blooms in the Sea. Elsevier, New York: 235-238.
HODGKISS I J, HO K C. 1997. Are changes in N: P ratios in coastal waters the key to increased red tide blooms[J]. Hydrobiologia, 353: 141-147.
JUSTIC D, RABALAIS N N, TURER R E, et al. 1995. Changes in nutrientstructure ofriver-dominated coastalwaters: Stoichiometric nutrientbalance and its consequences[J]. Estuarine, Coastal and shelfScience, 40: 339-356.
KIM D, MATSUYAMA Y, NAGASOE S, et al. 2004. Effect of temperature,salinity and irradiance on the harmful red tide dinoflagellate Cochlodinium polykrikoides Margalef(dinophyceae)[J]. J Plankton Res, 26(1): 61-66.
KLAUS GRASSHOFF. 1976. Methods of Seawater Analysis[M]. Verlag Chemie Weinheim New York: 117-178.
KUDELA R M, RYAN J P, BLAKELY M D, et al. 2008. Linking the physiology and ecology of Cochlodinium to better understand harmful algal bloom events: A comparative approach[J]. Harmful Algae, 7(3): 278-292.
MATSUOKA K, IWATAKI M, KAWAMI H. 2008. Morphology and taxonomy of chain-forming species of the genus Cochlodinium (Dinophyceae)[J]. Harmful Algae, 7(3): 261-270.
陈国斌. 2012. 厦门海域一次冬季血红哈卡藻赤潮的初步分析[J]. 福建水产, 34(5): 392-397.
国家质量监督检验检疫总局和国家标准化管理委员会. 2008. 中华人民共和国国家标准-海洋调查规范GB 17378—2007[M]. 北京: 中国标准出版社.
黄良民, 陈清潮, 尹健强, 等. 1997. 珠江口及邻近海域环境动态与生物结构初探[J]. 海洋环境科学, 16(3): 1-7.
黄伟卿, 陈彩珍, 张艺, 等. 2012. 诱发三都湾海域赤潮的原因探讨[J].河北渔业, 225(9): 33-36.
黄长江, 董巧香. 2000. 1998年春季珠江口海域大规模赤潮原因生物的形态分类和生物学特征Ⅱ[J]. 海洋与湖沼, 31(3): 233-238.
霍文毅, 愈志明, 邹景忠, 等. 2001. 胶州湾浮动弯角藻赤潮生消动态过程及其成因分析[J]. 水产学报, 25(3): 222-226.
李斌, 欧林坚, 吕颂辉. 2009. 不同氮源对海洋卡盾藻生长和硝酸还原酶活性的影响[J]. 海洋环境科学, 28(3): 264-267.
李鸿妹, 石晓勇, 陈鹏, 等. 2013. 春季东海赤潮发生前后营养盐及溶解氧的平面分布特征[J]. 环境科学, 34(6): 2159-2165.
李涛, 刘胜, 黄良民, 等. 2005. 大亚湾一次赤潮生消期间浮游植物群落变化研究[J]. 热带海洋学报, 24(3): 18-24.
李星. 2014. 2013年小岞杜厝海域赤潮发生过程分析[J]. 海洋预报, 31(4): 68-76.
李正华. 2012. 福建长乐海区一次东海原甲藻赤潮生消过程分析[J]. 福建水产, 34(3): 196-202.
刘义豪, 宋秀凯, 靳洋, 等. 2012. 一次陆源降雨污水引起血红哈卡藻赤潮的成因[J]. 生态学报, 32(15): 4836-4843.
欧林坚, 张玉宇, 李扬, 等. 2010. 广东珠海双胞旋沟藻 Cochlodinium geminatum赤潮事件分析[J]. 热带海洋学报, 29(1): 1-5.
彭模, 梁晓红, 赵爱博. 2010. 连云港海州湾海域赤潮发生与水文气象环境因子特征分析[J]. 海洋开发与管理, 27(9): 48-53.
王朝晖, 齐雨藻, 尹伊伟, 等. 2001. 1998年春深圳湾环节环沟藻赤潮及其发生原因的探讨[J]. 海洋科学, 25(5): 47-49.
王汉奎, 黄良民, 黄小平, 等. 2003. 珠江口海域条纹环沟藻赤潮的生消过程和环境特征[J]. 热带海洋学报, 22(5): 56-62.
尹翠玲, 张秋丰, 刘洋, 等. 2014. 2012年渤海湾赤潮监控区赤潮发生及富营养化状况[J]. 海洋湖沼通报, 1: 137-142.
尹翠玲, 张秋丰, 邹涛, 等. 2013. 渤海湾天津近岸海域夜光藻赤潮生消过程初探[J]. 海洋湖沼通报, 2: 99-104.
俞秀霞. 2012. 厦门同安湾海域一次三相型赤潮及其成因分析[J]. 福建水产, 34(3): 203-207.
喻龙, 郝彦菊. 2009. 烟台四十里湾一次血红哈卡藻赤潮过程的分析[J].海洋科学进展, 27(4): 516-522.
喻龙, 马兆虎, 郝彦菊, 等. 2014. 四十里湾 2012年一次血红哈卡藻赤潮的调查分析[J]. 海洋科学进展, 32(1): 84-91.
钟思胜, 李锦蓉, 罗一丹. 2002. 大亚湾五角多甲藻赤潮发生的环境因素分析[J]. 海洋环境科学, 21(1): 34-38.
Preliminary Environmental Analysis of the Evolution of Cochlodinium geminatum Bloom in the Pearl River Estuary
PANG Yong1,3, NIE Rui2,3, LU Songhui3
1. Hainan Academy of Oceanographic and Fishery Sciences, Haikou 570125, China; 2. Marine Monitoring and Forecasting Center of Hainan Province,Haikou 570206, China; 3. Research Center for Harmful Algae and Marine Biology, Jinan University, Guangzhou, 510632, China
The bloom of Cochlodinium geminatum Schütt in the Pearl River Estuary was monitored for 10 days (from October 28thto November 6th) in order to explore its evolution. Accordingly, three monitoring sections which include 12 sites in total were set up. Dynamics of the algae density, chlorophyll a, nutrient, temperature, salinity, pH and dissolved oxygen were studied by field monitoring and laboratory analysis. The results showed that the algae density increased firstly and then decreased, with the highest density at 2.765×107cells·L-1. The content of Chlorophyll a rose firstly and then decreased, with the maximum at 172.76 μ·L-1. Inorganic nitrogen and inorganic phosphorus were both at the level of eutrophication, in which inorganic nitrogen increased firstly and then decreased, and rebound at the end of the red tide; while inorganic phosphorus showed an overall downward trend. The water temperature in the red tide area ranged between 19.33 and 27.66 ℃, the salinity changed in the range of 9.16~31.5, pH changed in the range of 7.45~8.51, and dissolved oxygen changed in the range of 5.50~11.45 mg·L-1. Through the analysis of environmental factors during the red tide, in combination with the Cochlodinium geminatum bloom of the waters in 2006, and the bloom events occurred in surrounding waters in recent years, the following conclusions could be obtained: the bloom of Cochlodinium geminatum in Zhuhai waters in 2009 was in very large scale, and was the largest-scale bloom caused by C. geminatum in the Chinese coast. The initial stage of the bloom was from October 25thto October 27th, the maintenance stage was from October 28thto November 2nd, and the extinction stage was from November 2ndto November 6th. The community structure of phytoplankton had changed during the bloom evolution: in the maintenance stage, the Cochlodinium geminatum was dominant species, while the number of diatoms (Skeletonema spp. and Chaetoceros spp.) increased, and replaced the Cochlodinium geminatum as the dominant species at the extinction stage. The organic nitrogen that was in high concentration and was about 60% of the total nitrogen was caused by metabolism of C. geminatum. Serious eutrophication was a fundamental factor for inducing a bloom, and persistent high temperature and low salinity help stimulate the massive development of C. geminatum. Bad weather condition with dropping temperature and strong wind was the driving force for dispersing nutrients, and thus terminating the bloom.
Pearl River Estuary; Red tide; Cochlodinium geminatum; environmental factors
10.16258/j.cnki.1674-5906.2015.02.016
X171.5
A
1674-5906(2015)02-0286-08
庞勇,聂瑞,吕颂辉. 珠江口双胞旋沟藻Cochlodinium geminatum赤潮生消过程的环境特征初步分析[J]. 生态环境学报, 2015, 24(2): 286-293.
PANG Yong, NIE Rui, LU SongHui. Preliminary Environmental Analysis of the Evolution of Cochlodinium geminatum Bloom in the Pearl River Estuary [J]. Ecology and Environmental Sciences, 2015, 24(2): 286-293.
国家自然科学基金(U0733006);国家973研究计划项目(2010CB428702);国家科技部海洋公益性专项(200805015)
庞勇(1983年生),男,助理研究员,硕士,研究方向为海洋生态环境研究。E-mail:yongpang520@163.com
2014-08-19

