八角莲中黄酮类化合物的分离纯化工艺研究
陈仕学,万 鹏,杨双双,许佐娟
(铜仁学院材料与化学工程学院,贵州铜仁 554300)
·科学研究·
八角莲中黄酮类化合物的分离纯化工艺研究
陈仕学,万 鹏,杨双双,许佐娟
(铜仁学院材料与化学工程学院,贵州铜仁 554300)
研究了八角莲中黄酮类化合物的分离纯化工艺。考察各种因素对树脂吸附和洗脱效果的影响,确定了AB-8型大孔树脂分离纯化八角莲中黄酮类化合物的最佳工艺参数。最佳工艺参数为:静态吸附,树脂与样液比为1:20 g/mL、吸附时间为3 h,静态解吸过程解吸液(乙醇)体积分数为70%、树脂与解吸液的比例为1∶50 g/mL;动态吸附中动态流速为0.5mL/min、静置时间为80min,动态解吸中洗脱液(乙醇)的体积分数为60%、树脂与洗脱液的比例为1∶40 g/mL。
八角莲;黄酮类化合物;分离纯化;大孔树脂
八角莲为小檗科八角莲属植物,全世界约有7种,为我国特有属种,主要分布于湖南、湖北、贵州等地[1]。八角莲以干燥根茎入药,具有清热解毒、活血散瘀的功效,用于腮腺炎症、乳腺癌肿等疾病的治疗[2]。近年的植物化学研究从八角莲属植物中分离、提取鉴定了约25个已知结构的成分,分别属于木质素和黄酮类成分[3]。八角莲中含有大量的黄酮类化合物,本实验采用大孔吸附树脂法对其黄酮类化合物进行分离纯化工艺研究,为本地八角莲开发利用提供一定的理论依据。
1 试验过程
1.1 材料、试剂与仪器
材料:八角莲采于梵净山,洗净、切碎,于60℃电热鼓风干燥箱中烘干,粉碎,室温保存备用。
试剂:AB-8型、DM101型和DM130型大孔树脂(勤实科技大孔树脂);亚硝酸钠(成都金山化学试剂有限公司);硝酸铝(天津市恒兴化学试剂制造有限公司);氢氧化钠(天津石英钟厂霸州化工分厂);无水乙醇(天津市富宇精细化工有限公司);石油醚(天津市富宇精细化工有限公司);盐酸(衡阳市凯信化工试剂有限公司);以上试剂均为分析纯。
仪器:PL602-S型电子天平(梅特勒-托利多仪器(上海)有限公司);101-3型电热鼓风干燥箱(北京科伟永兴仪器有限公司);FW80型高速万能粉碎机(北京科伟永兴仪器有限公司);HH-2型数显恒温水浴锅(国华电器有限责任公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市子华仪器有限责任公司);RE-2000A型旋转蒸发仪(上海豫康科教仪器设备有限责任公司);KR800型医用低速离心机(常州市康仁医疗器械有限公司);2004(C)紫外可见分光光度计(北京普析通用仪器有限责任公司);GL-3250B型磁力搅拌器、98-Ⅱ-B型磁力搅拌电热套(天津市泰斯特仪器有限公司)。
1.2 实验方法
1.2.1 芦丁标准溶液曲线的配制及标准曲线的绘制
精密称取干燥至恒重的芦丁标准品10.0 mg,加体积分数为80%的乙醇溶解,水浴中微微加热,定容至100 mL容量瓶中,摇匀制成 0.1
mg/mL标准溶液[4]。分别取上述芦丁标准溶液0、0.2、0.5、1.0、2.0、3.0、4.0 mL于10 mL容量瓶中,加5 g/mL亚硝酸钠0.4mL,放置6 min,加10 g/100 m L硝酸铝0.4 mL,放置6 min,再加4 g/100 mL氢氧化钠4 mL。加蒸馏水至刻度,摇匀,放置15min。取1mL稀释10倍,在510 nm波长下分别测其吸光度,用空白试剂作对照;以芦丁标准样品质量浓度ρ(mg/m L)为横坐标,吸光度A为纵坐标绘制标准曲线。见图1,得回归方程:A=0.084ρ-0.004,相关系数R=0.999。
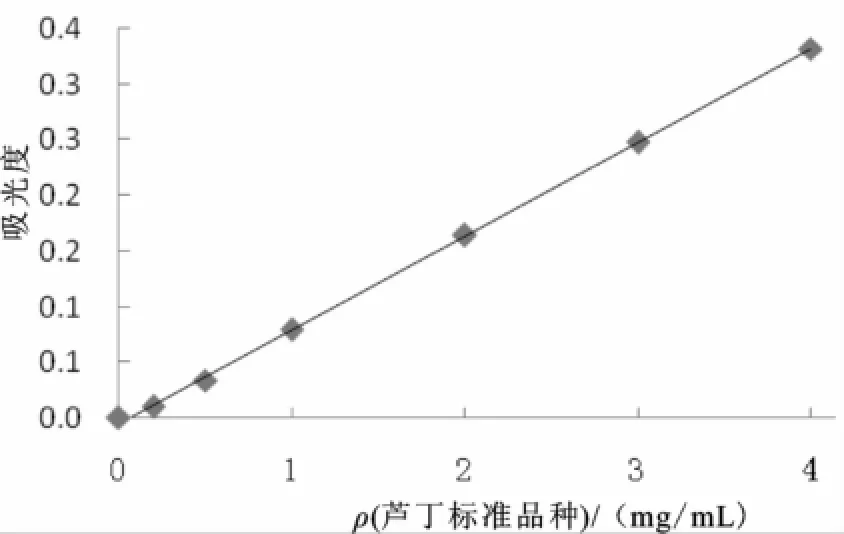
图1 芦丁标准曲线Fig.1 Rutin standard graph
1.2.2 大孔吸附树脂的预处理
分别称取一定量的3种大孔吸附树脂,用4倍体积95%的乙醇浸泡24 h以后,用95%的乙醇反复洗脱,洗至洗脱液与水(体积比为1∶5)混合不产生白色浑浊为止,再用蒸馏水反复洗至无醇味,再用4倍体积的2%NaOH溶液浸泡3 h,再反复用蒸馏水洗脱至洗脱液呈中性,再用4倍体积的0.5%HCl溶液浸泡3 h后,用水洗至呈中性,后抽滤去水分备用[5-7]。
1.2.3 样品溶液的制备
将八角莲样品置于广口瓶中,按1∶3(g/mL)的比例加入石油醚,浸泡4 h后,除去色素,抽滤后烘干,将烘干后的粉末与60%乙醇按1∶20(g/mL)比例放入锥形瓶中,将锥形瓶放入70℃恒温水浴锅中,加热1.5 h,冷却后抽滤,将所得的滤液在60℃下进行旋蒸,将旋蒸出的溶液在离心机中离心分离(3000 r/min)10 min,冷藏备用。测定黄酮类化合物含量[8-9]。
2 结果与分析
2.1 树脂类型的选择
采用静态吸附法测定各树脂对八角莲黄酮类化合物的吸附率,通过吸附率高低选择树脂类型。实验结果见图2。
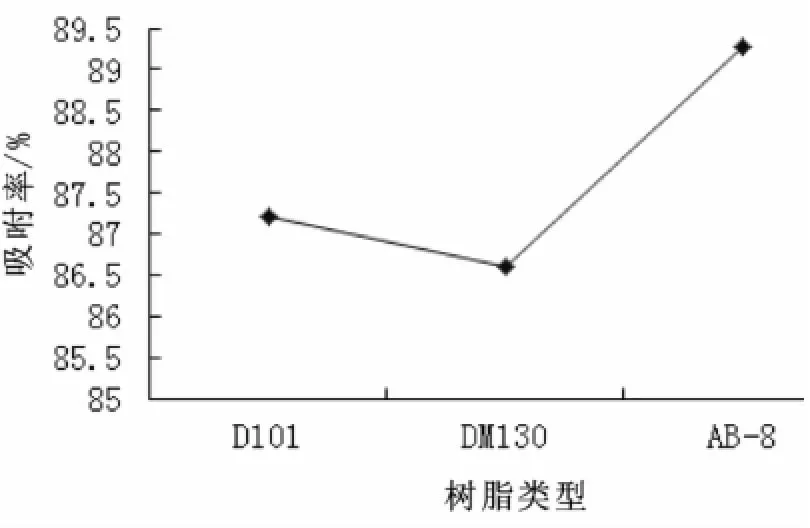
图2 大孔树脂吸附实验结果Fig.2 Macroporous resin adsorption experiments
由图2知,AB-8型大孔树脂对八角莲黄酮类化合物的吸附率高于其他两种树脂。由于吸附率越高,其静态吸附率也越大[10]。所以选择AB -8型大孔树脂进行吸附实验。
2.2 静态吸附与解吸实验
2.2.1 静态吸附条件选择
(1)树脂与样液比对静态吸附的影响
分别准确称取经预处理过的树脂1 g于5个100m L具磨口三角瓶中,分别加入10、20、30、40、50 mL黄酮溶液,25℃ 恒温振荡24 h充分吸附后,抽滤,吸取1 m L溶液,测定滤液中黄酮浓度。实验结果见图3。树脂对八角莲黄酮的吸附率按(1)式计算。
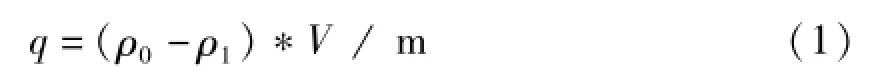
式中q为吸附率(mg/g);ρ0为提取液原液质量浓度(mg/mL);ρ1为吸附后剩余溶液质量浓度(mg/m L);V为提取液体积(mL);m为树脂质量(g)。
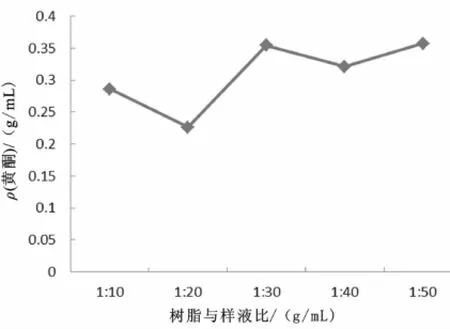
图3 树脂与样液比对静态吸附的影响Fig.3 Effect of resin-sam p le liquid ratio on static adsorption
吸附后黄酮溶液中的黄酮浓度越低,说明被吸附的黄酮越多。由图3可知,当树脂与样液比为1∶20 g/m L时,吸附后黄酮浓度最低,所以树脂与样液的最佳比例为1∶20 g/mL。
(2)吸附时间对静态吸附的影响
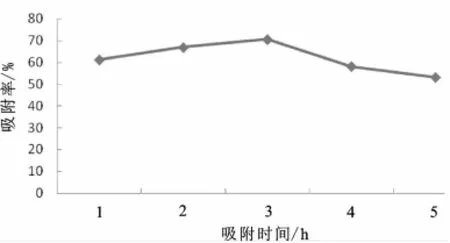
图4 吸附时间对静态吸附的影响Fig.4 Effect of adsorption time on static adsorption
由图4知,吸附时间在3 h前时,吸附率逐渐增加,在3 h时达到顶峰,3 h后吸附率逐渐降低,所以吸附时间3 h为最佳。
2.2.2 静态解吸条件选择
(1)洗脱液体积分数对静态解吸的影响
将按最佳样液比和最佳吸附时间下得到的吸附有总黄酮的树脂,分别用40%、50%、60%、70%、80%的乙醇溶液洗脱,恒温振荡3 h后,抽滤,测定滤液的总黄酮含量,计算解吸率,根据解吸率选择洗脱液(乙醇)的最佳体积分数。实验结果见图5。
解吸率(%)=ρ2*V2*100/(ρ0-ρ1)*V1(2)
式中,ρ0为原液质量浓度(mg/mL);V1为原液体积(mL);ρ1为吸附后溶液质量浓度;ρ2为解吸后剩余溶液质量浓度;V2为洗脱液体积。
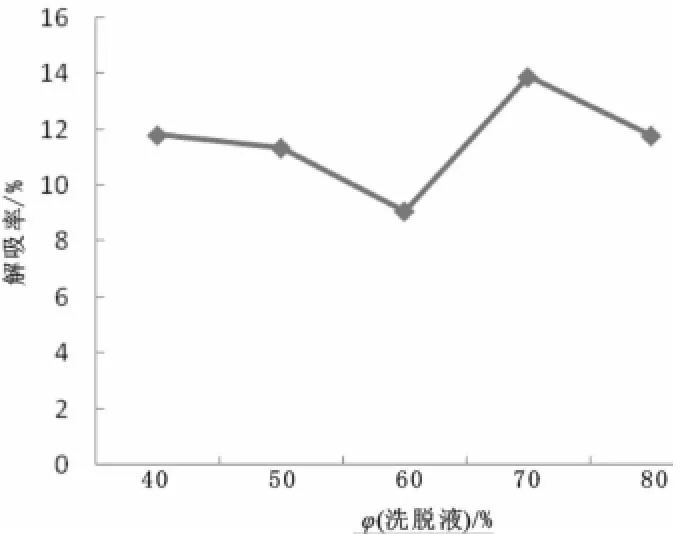
图5 洗脱液体积分数对静态解吸的影响Fig.5 Effect of elution volume fraction on static desorption
由图5可知,解吸率在乙醇体积分数为60%之前一直下降,当乙醇体积分数为70%时达到到最大值,随后又降低,所以最佳乙醇体积分数为70%。
(2)洗脱液用量对静态解吸的影响
电子设计自动化技术即EDA技术,主要包含两个方面的内容,一是电子系统仿真,二是电子系统设计,都是借助相应的软件在计算机上完成。常见的软件如EWB,Protel,PSpice,由于它能增强感性认识,有利于验证与分析理论,易于发挥学生的想象力,因而日益受到大家的重视。在高校实验教学中,EDA技术也已成为教学的一项主要内容。一些学校和专业教学指导委员会已将EDA技术列为主干课程,作为主要教学活动进行研究。
用70%乙醇按照1∶20、1∶30、1∶40、1∶50、1∶60 g/mL树脂和洗脱液的比例,恒温振荡3 h,抽滤,测定滤液的黄酮含量,计算解吸率。实验结果见图6。
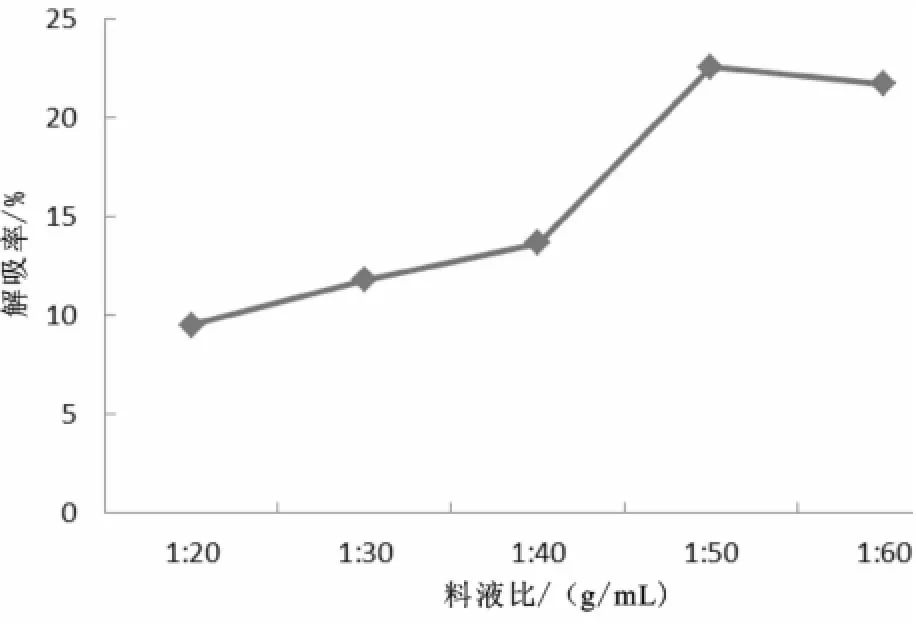
图6 树脂与洗脱液的比例对静态解吸的影响Fig.6 Effect of ratio of resin and an eluent on static desorption
由图6知,随着树脂与解吸液的比例逐步增大时,解吸率呈逐渐上升趋势,在树脂与解吸液的比例为1∶50 g/m L时达到最大,所以1∶50 g/mL为最佳的树脂与洗脱液的比例。
2.3 动态吸附与解吸实验
2.3.1 动态吸附条件选择
(1)动态流速对动态吸附作用的影响
准确称取与处理好的树脂装柱,通过恒流泵将样品液流经树脂柱床,流速分别为0.1、0.5、1.0、1.5 mL/min。控制流速,每10 min收集一流分,检测黄酮浓度,计算其吸附率,吸附率高的流速为最佳流速。实验结果见图7。
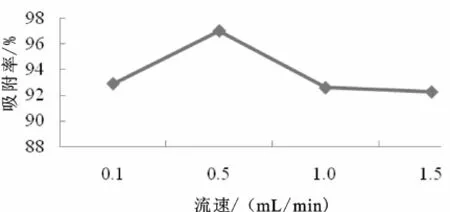
图7 动态流速对动态吸附的影响Fig.7 Effect of dynam ic velocity on dynam ic adsorption
由图7知,流速在0.5 mL/min以前,吸附率逐渐增加,在流速为0.5mL/min时吸附率达到最大值。之后呈下降趋势,所以流速为0.5 m L/min是最佳的动态流速。
(2)静置时间对动态吸附的影响
确定黄酮的初始浓度,将树脂与原液比1∶20的溶液分别静置40、60、80、100、120 min,将溶液以最佳流速流出,取1 mL流出液测黄酮含量,根据吸附率,确定最佳静置时间。实验结果见图8。
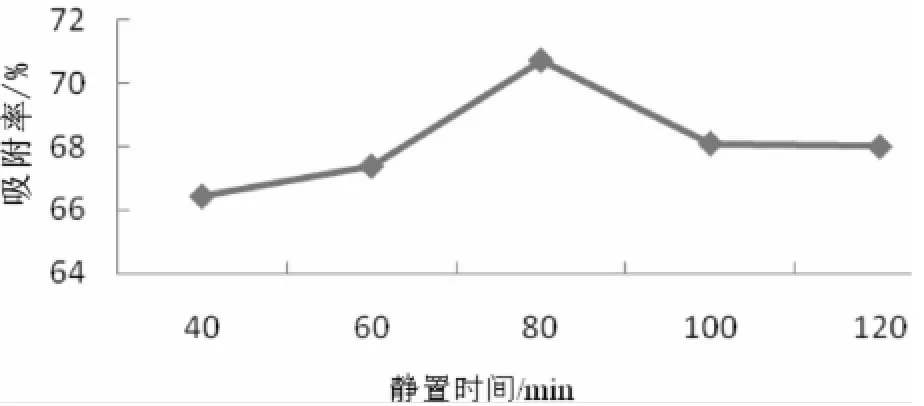
图8 静置时间对动态吸附的影响Fig.8 Effect of standing time on the dynam ic adsorption
由图8知,80 min以前吸附率随静置时间的增加而增加,在80 min时达到最高,之后呈下降趋势,所以最佳静置时间为80 min。
2.3.2 动态解吸条件选择
1)解吸液体积分数对动态解吸的影响
称取2.0 g树脂,吸附完全后,依次用不同体积分数的乙醇溶液洗脱,收集并测定洗脱液中黄酮含量,计算解吸率,考察乙醇体积分数对解吸率的影响。实验结果见图9。
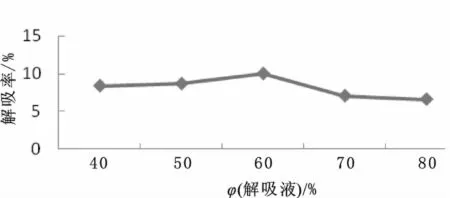
图9 解吸液体积分数对动态吸附解吸的影响Fig.9 Effect of desorption liquid fraction on the adsorption and desorption
由图9可得,在乙醇体积分数为60%之前其解吸率呈上升趋势,在60%时达到最高,以后解吸率逐渐下降,所以乙醇的体积分数为60%。
2)洗脱液用量对动态解吸的影响
用60%体积分数的乙醇溶液按照1∶20、1∶30、1∶40、1∶50、1∶60 g/m L树脂和解吸液的比例进行解吸,计算解吸率,确定最佳的洗脱剂用量。实验结果见图10。
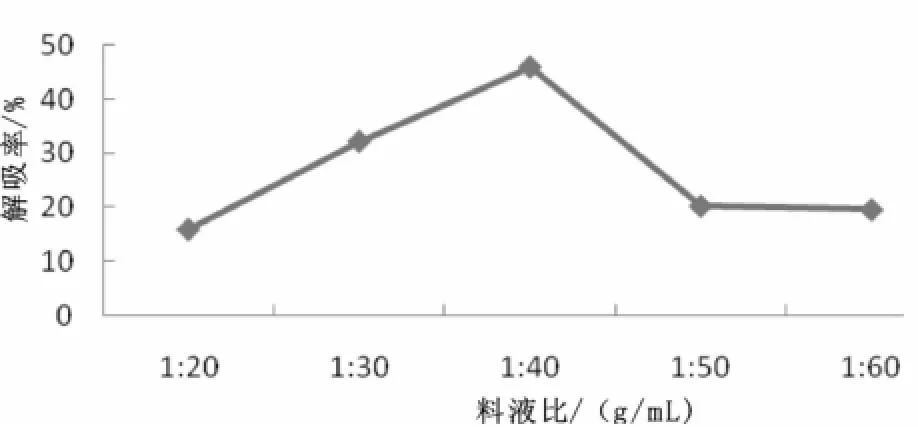
图10 树脂和解吸液的比例对动态解吸的影响Fig.10 Effect of ratio of resin and desorption fluid on dynam ic desorption
由图10可知,树脂与解吸液的比例在1∶40 g/mL以前,解吸率随树脂与解吸液的比例增加而增加,到1∶40 g/mL时达到最大,之后有下降趋势,所以树脂与解吸液的比例为1∶40 g/mL解吸率最大。
3 结论
AB-8型大孔树脂对八角莲中黄酮类化合物具有良好的吸附性,能较好的分离纯化八角莲中黄酮。其最佳工艺参数静态吸附为树脂与样液比为1∶2 g/mL、吸附时间为3 h,静态解吸过程解吸液(乙醇)的体积分数为70%、树脂与解吸液的比例为1∶50 g/mL;动态吸附中动态流速为0.5 m L/min、静置时间为80 min,动态解吸中洗脱液(乙醇)的体积分数为60%、树脂与洗脱液的比例为1∶40 g/mL。
[1] 张燕,黎斌,李思峰,八角莲的保护生物学研究进展[J].亚热带植学,2011,40(4):89-92.
[2] (清)顾观光.神农本草经[M].北京:学苑出版社,2004.
[3] 尚明英,蔡少青,李萍,等.秕鳞八角莲的化学成分研究[J].中草药,2000,31(6):412-414.
[4] 陈仕学,龚孝芳,冯胜蓉,等,超声波辅助提取八角莲黄酮类化合物的初步研究[J].广州化工,2014,24(21):99-101.
[5] 史柳芝,史恒芝,李小凤,等.茉莉花花蕾黄酮类化合物的体外抗氧化活性初步研究[J].中国处方药,2013(2):121-123.
[6] 黛玉锦,卢明,冯玲.微波法从柚皮中提取黄酮类化合物的工艺研究[J].江苏农业科学,2006,(1):121-123.
[7] 李超,王乃馨,郑义.等,AB-8型大孔吸附树脂分
离纯化大叶金花草总黄酮[J].食品科学,2011,32 (16):31-35.
[8] 李姣姣,李超,王乃馨.等,AB-8型大孔吸附树脂分离纯化了哥王总黄酮[J].食品研究与开发,2012,33(5):52-56.
[9] 杨国伟,白立敏,苏东海,等.大孔吸附树脂纯化红树莓总黄酮的研究[J].西北农业学报,2008,17 (2):147-150;154.
[10] 杨佳,张国文,汪佳蓉,等.大孔树脂分离纯化脐橙皮中橙皮苷的工艺研究[J].食品科技,2010,35 (6):210-213.
Studies on Separation and Purification of Flavonoids in Dysosma Versipellis
CHEN Shi-xue,WAN Peng,YANG Shuang-shuang,XU Zuo-juan
(School ofmaterials and chemical engineering,Tongren University,Tongren 554300,China)
Through the investigation of various factors on the resin adsorption and elution effect,the best separation parameter extraction and purification process of flavonoid compounds in Dysosma versipellis with AB-8 macroporous resin are determined.The optimum process parameters for static adsorption resin and sample liquid ratiowas1:20 g/mL,the adsorption time is3h,the static desorption as eluate volume fraction is70%,the ratio of desorption solution and the resin was1:50 g/mL,dynamic adsorption and dynamic velocity is 0.5m L/m in,holding time is80min,the dynamic desorption elution volume fraction is60%,ratio of resin and eluate is1:40 g/mL.
Dysosma versipellis;flavonoids;separation and purification;macroporous resin
R284
A
1004-275X(2015)03-0001-05
12.3969/j.issn.1004-275X.2015.03.001
收稿:2015-03-24
地方高校国家级大学生创新创业训练计划项目(201310977003);贵州省大学生创新训练计划项目(201310977003);六盘水市煤系固体废弃物资源化利用创新团队(52020-2012-04-01-02)
杨乐浩(1993-),男,山东济南人,六盘水师范学院2012级化学工程与工艺专业本科生。
*通信联系人:孔德顺(1974-),男,山东临沂人,教授,主要从事矿产资源的深加工与利用研究。
收稿:2015-05-21
基金项目:贵州省科学技术基金项目:黔科合LH字〔2014〕7493;贵州省教育厅特色实验室建设项目“梵净山特色动植物资源重点实验室”〔黔教合KY字(2011)005〕;院级学生项目(trxyS1410)。
作者简介:陈仕学(1976-),女,贵州铜仁人,蒙古族,硕士,副教授,主要从事生化分离及天然药物研究。E-mail:tongrencsx01@126.com

