旅游干扰对庐山风景区微生物多样性的影响
刘光荣
新乡学院管理学院,河南新乡453003
旅游干扰对庐山风景区微生物多样性的影响
刘光荣
新乡学院管理学院,河南新乡453003
随着旅游业的不断发展,一些自然风景区越来越受人们的青睐,因此旅游区频繁的人类活动对土壤微生物多样性产生一定程度的影响。为了探讨不同程度旅游干扰区土壤微生物群落结构的变化,本研究以庐山这一典型的旅游风景区的原始森林区(A)、较少旅游干扰的次生林恢复区(B)以及旅游干扰区(C)土壤为研究对象,利用BIOLOG微平板法和磷脂脂肪酸甲酯法(FAMEs)系统研究比较了三种地域之间土壤微生物代谢和微生物碳、微生物群落结构和功能多样性的差异。结果表明:原始森林区土壤微生物量碳、氮含量显著高于次生恢复区和旅游干扰区,原始森林区土壤微生物活性>次生恢复区>旅游干扰区,三个地域间土壤微生物利用碳源类型也存在差异,原始森林区土壤微生物群落均匀度也显著优于其他两地域;FAMEs分析表明,原始森林区土壤微生物磷酸脂肪酸生物标记的数量最高,功能性最强,且细菌、真菌特征脂肪酸相对含量也最高。群落稳定性和功能多样性依次是:原始森林区、次生林恢复区、旅游干扰区,这些都说明旅游干扰显著减弱土壤微生物群落多样性和功能性。
旅游干扰;土壤微生物群落多样性;功能性;BIOLOG;FAMEs
土壤微生物是整个生态系统的重要部分,它积极参与生态系统物质循环和能量流动,在生物地化循环过程调控和生态系统功能维持方面起着关键作用[1-3],直接或间接影响植物生长,促进植被的演替[4]。随着人类生活水平的不断提高,旅游文化的兴起,人们热衷于走向自然界,旅游风景区参观人数日渐增多,这对自然风景区的生态环境也产生了一定的影响,土壤微生物作为土壤有机质和土壤养分(C,N,P,S等)转化和循环的重要组成部分[5],也受到了干扰。
庐山被誉为世界地质公园,有丰富的地质资源和生物自然资源,庐山山地自然环境的复杂性,提供了保存植物的古老类型和引种新的植物种类的有利的环境,也因此现存许多未开发的原始森林。庐山旅游风景区以其自然地貌和人文资源每年吸引着大量游客前往。人们在游览的同时或是开发的同时对庐山自然生态环境产生了影响,首当其冲的是来往的游人脚下的土壤中的微生物微生态环境。土壤微生物作为生命元素循环的驱动者,主导和参与地下生态系统中一系列重要生态过程,对土壤能否正常有序地执行各项生态功能至关重要[6-9]。目前国内外学者陆续开展了针对高原草甸等生态系统多样性与稳定性的研究工作[10-12],但是旅游干扰对旅游区土壤微生物群落多样性影响的研究还比较少。本研究系统探讨了旅游干扰是如何影响旅游区土壤微生物多样性、代谢及功能性,揭示生态环境的改变与土壤微生物群落的相关性,从而为旅游区的自然生境的管理做生物指示。
1 材料与方法
1.1研究区概况
庐山地处江西省九江市东南,北临长江,东濒潘阳湖,包括庐山风景区、九江及庐山南麓星子县的大部,位于东经115°52'~116°08'、北纬29°26'~29°41'之间,总面积约为800 km2。它具有亚热带中部过度到亚热带北部的特点,四季分明,具有鲜明的季风气候特征,全年雨量丰沛,平均降雨量1833.6 mm,雨日年平均为167.7 d,每年7~9月,平均温度16.9℃,最高只有30℃左右,最低-15.9℃。此外,庐山的植被资源非常丰富,以热带和亚热带植物为主,由于庐山自然风景区与日俱增的旅游人数,人为干扰较大,现状植被属于在自然恢复中的次生植被,但也有相当一部分的原始植被,呈现较为明显的垂直分布特征。
1.2样地设置与样品采集
于2013年6~9月期间,选取庐山风景区海拔400 m~800 m三个人为干扰递增的区域:原始森林区(A)、次生植被恢复区(B)以及人为干扰较大的旅游区(C),在每个区域随机设置6块样地,每个样地取约1 m2小样方(如图1)内0~10 cm土层的土壤100 g,样品袋保存并编号。实验室中过2 mm网筛,一部分保存于4℃,另一部分自然风干,取一部分过80目筛网。

图1 三个区域采样地点分布Fig.1 Distribution of sampling positions in three different areas
1.3研究方法
土壤含水率(SM)采用120℃连续烘干24 h后前后重量差计算得出,采用环刀法取样测定土壤容重,pH指采用酸度计测定,电导率(EC)用电导率仪(土:水为1:2.5)测定,有机碳(SOC)用重铬酸钾氧化加热法测定,全氮(TN)用半微量凯氏定氮法测定,全磷(TP)用硫酸-高氯酸消煮法测定,全钾(TK)用NaOH熔融火焰光度法测定[13]。
土壤微生物生物量碳(MBC)采用氯仿熏蒸浸提法,氯仿熏蒸和未熏蒸土壤用0.5 mol/L K2SO4溶液浸提,浸提液中有机碳含量采用Tekmar-Dohrmann公司UV-Persuate有机碳分析仪测定,转换系数KC取0.45[14],土壤微生物生物量氮(MBN)参照Brookes[15]方法测定,微生物熵(Microbial quptient)通常指微生物生物量碳占土壤有机碳的百分比。
土壤微生物群落功能通过BIOLOG法[16-19]测定微生物代谢能力,取10 g烘干土壤,加入90 mL无菌的0.145 mol·L-1NaCl溶液,摇床震荡30 min,样品稀释1000倍,用BIOLOG排枪取100µL接种于ECO板上,初次读书后,于25℃恒温培养,每隔12 h于波长590 nm的BIOLOG仪器上读数,共培养240 h[20]。微生物总体群落功能活性用平均颜色变化率AWCD值来表征。其中,pi为第i个有培养基的孔与对照组孔的光度值差和整个平板光密度总差的比值;Ci是每个有培养基孔的光密度值,R为对照组孔的光密度值,n为培养基数据(BIOLOG ECO Plate,n=31)。计算公式如下:

微生物群落功能多样性采用Shannon-Wiener指数(H')和均匀度指数(E)来描述,计算公式如下:

主成分分析采用培养72 h后的光密度值,提取两个主因子进而分析三种不同区域土壤利用碳源的结构。
参考用磷酸脂肪酸甲酯法结合气相色谱分析测定土壤微生物群落结构多样性[21-24]。
1.4数据处理
采用SPSS16.0数据分析软件进行数据处理,运用最小显著差数法(LSD)进行显著性分析。用OriginPro 8.0软件作图。
2 结果与分析
2.1不同区域土壤特性
当自然生态环境受到人为干扰时,干扰程度不同其土壤特性有所差异(如表1)。在旅游干扰区土壤PH、含水率、容重、有机碳含量、氮磷钾等都显著(P<0.05)低于未被干扰的原始森林和次生恢复区土壤理化指标,土壤电导率大小(P<0.05)依次是旅游干扰区>次生恢复区>原始森林区。说明在旅游干扰区土壤的特性因为人类频繁活动而发生改变,含水率下降,养分减弱。

表1 庐山不同区域土壤理化性质Table 1 Chemical and physical properties of soils in different areas of Lu Mountain
2.2土壤微生物量
氯仿熏蒸浸提法测定三个旅游干扰区土壤微生物碳氮含量(如表2所示),随着旅游干扰程度的增强,土壤微生物碳(MBC)和氮(MBN)量逐渐减少,原始森林未受旅游干扰区最大MBC和MBN分别为301.56 mg·kg-1和24.27 mg·kg-1,而在旅游干扰去区最大MBC和MBN分别为244.71 mg·kg-1和14.66 mg·kg-1,显著(P<0.05)低于原始森林区。土壤中细菌、真菌、放线菌、革兰氏阳性菌和革兰氏阴性菌等主要微生物量也是旅游干扰区显著低于原始森林区和次生林恢复区。
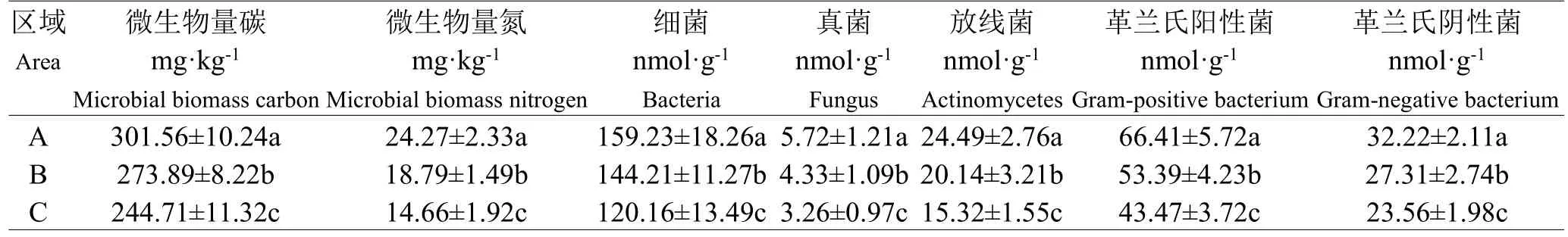
表2 土壤微生物碳氮Table 2 Carbon and Nitrogen of soil microorganism
2.3微生物代谢多样性类型
碳源平均颜色变化率AWCD值表示微生物利用单一碳源的能力,可作为微生物群落整体活性的一个重要指标。如图2所示,在培养的240 h内,随着培养时间的延长,微生物的代谢活性前36 h缓慢上升,后急速上升,最后趋于平缓。在不同的旅游区内,旅游干扰区土壤微生物活性显著(P<0.05)低于原始森林区和次生恢复区土壤微生物活性,以培养时间72 h为例(AWCD值接近0.5),微生物代谢活性大小为原始森林区>次生恢复区>旅游干扰区。
分别测定各旅游区土壤微生物对不同碳源利用,如图3所示,糖类,氨基酸和脂肪酸AWCD值最大(在1.7~1.8之间),而代谢中间物AWCD为1.5~1.6,说明各旅游区土壤微生物对糖类、氨基酸类和脂肪酸类碳源利用程度较高,对代谢中间产物碳源利用率较低,并且土壤微生物对四种碳源利用程度大小为:原始森林区>次生恢复区>旅游干扰区。
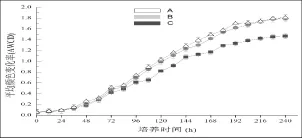
图2 庐山不同区域微生物群落代谢活性Fig.2 Microbial activity of different areas in Lu Mountain soils

图3 三种区域土壤对不同碳源利用的平均颜色变化率Fig.3 AWCD for different carbon sources utilized by microbe of soils in three areas
2.4碳源利用类型的主成分分析
对三个旅游区土样微生物培养72 h后,BIOLOG测定结果分析,提取两个主成分做载荷图,如图4所示,原始森林区土壤微生物群落投影点最为集中,表现出低水平稳态的微生物群落结构,次生恢复区次之,旅游干扰区土壤微生物群落投影点较为弥散,微生物群落呈现多元化。

图4 不同区域采样点培养72 h后土壤碳源利用的主成分分析Fig.4 Principal component analysis of carbon utilization profiles in different areas at 72 hours incubation
2.5微生物群落结构及功能多样性分析
磷酸脂肪酸生物标记的总含量能够基本反映出微生物总的含量[25],分别测定原始森林区(A)、次生恢复区(B)和旅游干扰区(C)土壤磷酸脂肪酸总含量,如图5所示,旅游干扰程度越大土壤中磷酸脂肪酸含量越低,微生物量也低。如图6所示,以土壤中细菌、真菌的生物量以及细菌/真菌比值变化分析不同旅游干扰区土壤微生物群落结构差异,发现土壤中优势微生物为细菌,且原始森林区、次生恢复区及旅游干扰区细菌和真菌存在差异,原始森林区>次生恢复区>旅游干扰区。多样性指数可用于评价不同土壤的微生物群落多样性,多样性指数值高则表明土壤有高的微生物群落多样性[26],对三种区域土壤微生物多样性指数进行分析(如图7所示),不同干扰下土壤微生物Shannon-Wiener指数存在显著差异,基本上旅游干扰区微生物群落结构多样性要大于原始森林区和次生恢复区,土壤微生物均匀度比较:原始森林区<次生恢复区<旅游干扰区,三者土壤微生物功能性多样性也具有差异,原始森林区土壤微生物功能性强于后两者。
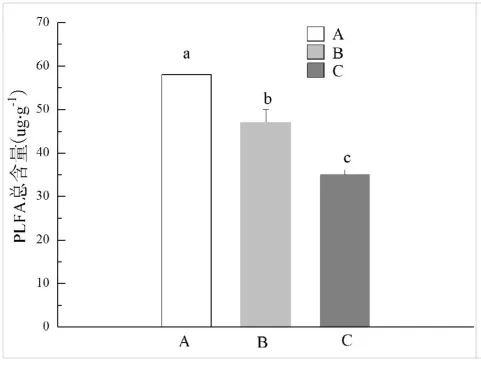
图5 不同旅游干扰区土壤微生物PLFA总含量变化Fig.5 Changes of the total PLFA in different areas

图6 不同旅游干扰区土壤细菌、真菌及细菌/真菌特征性磷酸脂肪酸标记含量的变化Fig.6 Changes of PLFAmarker of bacteria,fungi and bacteria/fungi in different areas
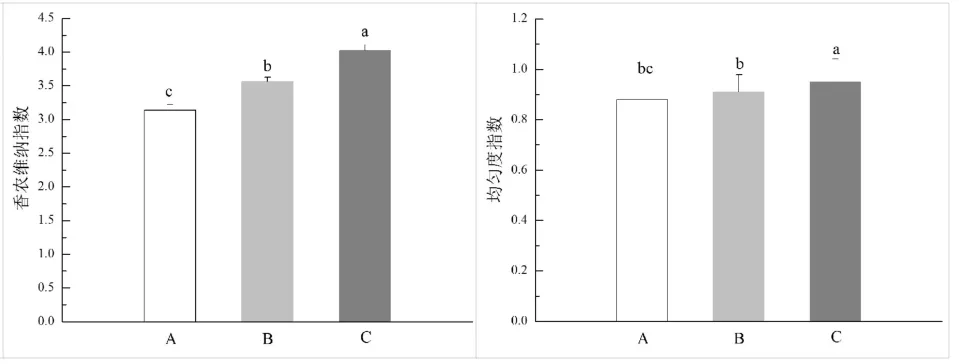
图7 不同旅游干扰区域土壤微生物香农维纳指数和均匀度指数Fig.7 The shannon wiener index and evenness index of soil microbial in different tourism disturbance areas
3 讨论
研究微生物群落对不同碳源利用能力的差异,可深人了解微生物群落的功能变化,而土壤中微生物生物量是反映土壤肥力、土壤健康状况和人类活动影响的一个稳定的、可靠的生态学指标[14,27]。本研究BIOLOG数据表明各植被带土壤微生物群落利用单一碳源的能力不同,原始森林区土壤微生物利用单一碳源能力最强,土壤微生物群落代谢活性最强,其功能性也越强。而旅游干扰大的区域,其AWCD值最小,土壤微生物代谢活性最弱,原始森林区经过长年的自然演替,未受到外界人为的干扰,土壤中微生物较稳定,代谢强,反之,旅游干扰区长期受人类频繁活动的干扰,土壤微生物群落结构不稳定,群落代谢活性减弱。目前应用较广的丰富度Shannon指数和均匀度等参数,基本能代表土壤微生物群落多样性的特征[28]。原始森林区、次生恢复区和旅游干扰区之间土壤微生物多样性指数和均匀度指数存在一定的差异,人为干扰到带来外源微生物、污染物等使得该区域土壤微生物种型丰富度增加,多样性较其他两区域丰富,而旅游干扰虽然使得土壤微生物多样性增加,但是却显著影响了各区域土壤微生物功能性,原始森林区土壤微生物功能性要较旅游干扰区和次生恢复区强,土壤微生物群落功能多样性是反映该土壤生态系统稳定性的重要指示因子。
此外,生物多样性的影响因素很多,如土壤有机质、质地、温度、水分和通气性等[29],本研究中细菌生物量和真菌生物量均和各功能多样性指数存在显著相关性(P<0.05),而放线菌对代谢功能多样性的贡献较小。磷酸脂肪酸生物标记的测定也发现各旅游区土壤中所含磷酸脂肪酸种类和数量各不相同,其中旅游干扰严重区磷酸脂肪酸含量最低,原始森林区最高。这可能与周围环境自身演替和土壤微生物自身进化有关,然而想要进一步了解在旅游干扰下土壤微生物多样性和其功能性的关系,还需要更多更有力的数据支持。
[1]Bell T,Newman JA,Silverman B W,et al.The contribution of species richness and composition to bacterial services[J]. Nature,2005,436(7054):1157-1160
[2]Liu B R,Jia G M,Chen J,et al.A review of methods for studying microbial diversity in soils[J].Pedosphere,2006,16(1):18-24
[3]Fierer N,Jackson R B.The diversity and biogeography pf soil bacterial communities[J].Proceeding of the National Academy of Sciences of the United States ofAmerica,2006,103(3):626-631
[4]Walker L R,Clarkson B D,Silvester W B,et al.Colonization dynamics and facilitative impacts of a nitrogen-fixing shrub in primary succession[J].Journal of Vegetation Science,2003,14(2):227-290
[5]Harris J A,Birch P.Soil microbial activity in opencast coalmine restoration[J].Soil Use and Management,1989,5(4):155-160
[6]Allison S D,Martiny J B H.Resistance,resilience,and redundancy in microbial communities[J].Proceedings of the NationalAcademy of Science,2008,105:11512-11519
[7]Berga M,Szekely A J,Langenheder S.Effects of disturbance intensity and frequency on bacterial community composition and function[J].PloS ONE,2012,7:936-959
[8]Caporaso J G,Paszkiewicz K,Fild D,et al.The Western English Channel contains a persistent microbial seedbank[J]. International Society for Microbial Ecology,2012,6(6):1089-1093
[9]Didier L B,Hannes P,Lars J T.Resistance and resilience of microbial communities temporal and spatial insurance against perturbations[J].Environment Microbiology,2012,14:2283-2292
[10]McCann K S.The diversity-stability debate[J].Nature,2000,405:228-233
[11]Tilman D.Reich P B,Knops J M H.Biodiversity and ecosystem stability in a decade-long grassland experiment[J]. Nature,2006,441:629-632
[12]Wang G H.Further thoughts on diversity and stability in ecosystem[J].Biodiversity Science,2002,10:126-134
[13]Lu R K.Analytical Methods of SoilAgrochemistry[M].Beijing:ChineseAgricultrue Science Technology Press,1999
[14]Wu J,Joergensen R G,Pommerening B,et al.Measurement of soil microbial biomass C by fumigation extraction an automated procedure[J].Soil Biology and Biochemistry,1990,22(8):1167-1169
[15]Brookes P C,Landman A,Pruden G,et al.Chloroform fumigation and the release of soil nitrogen:a rapid direct extraction method to measure microbial biomass nitrogen in soil[J].Soil Biology and Biochemistry,1985,17(6):837-842
[16]张小磊,何宽,安春华,等.不同土地利用方式对城市土壤活性有机碳的影响--以开封市为例[J].生态环境,2006,15(6):1220-1222
[17]李忠佩,吴晓晨,陈碧云.不同利用方式下土壤有机碳转化及微生物群落功能多样性变化[J].中国农业科学,2007,40(8):1712-1721
[18]杨元根,Paterson E,Campbell C.BIOLOG方法在区分城市土壤与农村土壤微生物特性上的应用[J].土壤学报,2002,39(4):582-589
[19]张燕燕,曲来叶,陈立顶,等.黄土丘陵沟壑区不同植被类型土壤生物特性[J].应用生态学报,2010,21(1):165-173
[20]陈帅,王效科,逯非.城市与郊区森林土壤微生物群落特征差异研究[J].土壤通报,2012,43(3):614-620
[21]刘秉儒,张秀珍,胡天华,等.贺兰山不同海拔典型植被带土壤为生物多样性[J].生态学报,2013,33(22):7211-7220
[22]Zhang S X,Chen F L,Zheng H.Response of soil microbial community structure to the leaf litter decomposition of three typical broadleaf species in mid-subtropical area,sourhern China[J].Acta Ecologica Sinica,2011,31(11):3020-3026
[23]Chen H H,Zhang R,Zhang Y,et al.Analysis of microbial community function diversity in gravel-mulched filed[J]. Chinese Journal of Soil Science,2011,42(1):51-55
[24]Zheng H,Chen F L,Ouyang Z Y,et al.Utilization of different cabon types in biolog-GN microplates by soil microbial communities from four forest types[J].Environmental Science,2007,28(5):1126-1130
[25]Guckert J B,Hood M A,White D C.Phospholipid ester-linked fatty acid profile changes during nutrient deprivation of Vibrio cholerae:increase in trans/cis ratio and proportions of cyclopropyl fatty acid[J].Applied and Environmental Microbilogy,1986,52(4):794-801
[26]Klose S,Acosta-Marrinez V,Ajwa H A.Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides[J].Soil Biology and Biochemistry,2006,38(6):1243-1254
[27]Brookes P C,Landman A,Pruden G.Chloroform fumigation and the release of soil nitrogen:a rapid direct extraction method to meature microbial biomass nitrogen in soil[J].Soil Biology and Biochemistry,1985,17(6):837-842
[28]Fu S L.Areview and perspective on soil biodiversity research[J].Biodiversity Science,2007,15(2):109-115
[29]Zhong Y Y,Qu L Y,Cheng L D.An amendment on information extraction of Biolog Ecoplate(TM)[J].Microbiology, 2009,36(7):1083-1091
Impacts of Tourist Disturbance on Microbial Diversity in Lu Mountain Scenic Area
LIU Guang-rong
School of Management,Xinxiang University,Xinxiang 453003,China
There is more and more people to be enjoyed to a natural landscape areas with the development of tourism,so frequent tourists action take some effects on microbial in soil in scenic areas.In order to explore the ecological effect of tourist disturbance on the tourism development in primeval forest,secondary recovery area and tourist disturbance area soil, this paper took some methods of BIOLOG and FAMEs to comparate and analyze the population diversity difference among microbial metabolism,carbon and nitrogen,microbial community structure and diversity of function.Results showed that the carbon and nitrogen content in the primeval forest was significantly higher than that in the secondary recovery area and tourist disturbance area.Microbial activity in them fell in turn,and there was difference in carbon source among them.The community evenness in original forest was better than the others.Phosphate fatty acid content and the function of microbial were the highest in three areas using the FAMEs,so did the bacteria and fungi.Community stability and function diversity were decreasing in three areas.These explain that tourism disturbance significantly decreased the microbial community diversity in soil and its function.
Tourist disturbance;microbial community diversity;function;BIOLOG;FAMEs
Q149
A
1000-2324(2015)02-0274-06
2013-05-11
2013-06-23
刘光荣(1979-),女,河南淇县人,硕士,讲师.研究方向旅游企业管理.E-mail:liugr8575@163.com

