小麦籽粒多酚氧化酶活性的QTL分析
赵勇,王杰,杨学芳,李晓云,张树华,田纪春,杨学举*
1.河北农业大学农学院/河北省作物种质资源实验室,河北保定071000
2.河北农业大学生命科学学院,河北保定071000
3.山东农业大学农学院,山东泰安271018
小麦籽粒多酚氧化酶活性的QTL分析
赵勇1,王杰1,杨学芳1,李晓云1,张树华2,田纪春3,杨学举2*
1.河北农业大学农学院/河北省作物种质资源实验室,河北保定071000
2.河北农业大学生命科学学院,河北保定071000
3.山东农业大学农学院,山东泰安271018
多酚氧化酶(Polyphenol oxidase,PPO)是引起面团(片)颜色褐变的主要原因。由小麦品种花培3号和豫麦57杂交获得DH群体168个株系,种植于2年6个环境中,利用324个多态性标记构建遗传连锁图谱,对小麦多酚氧化酶活性进行QTL分析。利用完全区间作图法,共检测到15个加性效应位点,其中2D染色体上主效QTL(标记Xcfd168-Xbarc349.2)在4个环境下均能被检测到,贡献率为11.65%~65.84%,适用于分子标记辅助育种。
小麦;多酚氧化酶(PPO);QTL分析
面制食品是我国人民的传统主食,在人们的膳食结构中占有非常重要的地位,我国居民在制作面制食品时对面粉白度有较高要求,细腻洁白的面粉及其制品备受消费者青睐。小麦籽粒中的多酚氧化酶(Polyphenol Oxidase,简称PPO)活性及其相应的底物是导致酶促褐变的主要原因,可解释面条、水饺、馒头等面制半成品颜色变异的55~70%[1-5]。环境和基因型都影响PPO的活性,但PPO活性主要受基因型影响,不同品种间PPO活性相差很大,因此,通过遗传育种途径改良面制品颜色的褐变是可行的[6]。
Jimenz等[7]通过对代换系PPO活性的测定,推测控制小麦PPO主效基因为1~2个,同时指出针对PPO底物的专化性存在多个等位基因。葛秀秀等[8]应用植物数量性状基因+多基因混合遗传模型对中国冬小麦PPO活性的遗传分析表明,PPO活性受2对独立主基因控制。Udall等[9]和Demekes等[10]利用RFLP标记以重组近交系群体为材料,Mares等[11]利用AFLP标记以DH群体为材料,都发现控制PPO活性的主效基因位于第2同源群染色体上。Anderson等[12]利用非整倍体小麦中60~62KDPPO活性的蛋白电泳,将PPO活性的主要控制位点定位在2D染色体上。张立平等[13]利用中优9507/CA9632的构建的71个DH系为材料在1年2种环境下种植,检测到位于2AL和2DL上的两个主效QTL,可分别解释PPO活性变异的50.0%和29.1%。常成等[14]利用中国春的缺体-四体材料,将两个PPO基因(PPO-1,PPO-2)分别定位在染色体2A和2D上,但未明确具体标记区间。
虽然人们对小麦籽粒PPO活性的QTL定位进行了研究,但是由于遗传图谱、群体类型和大小、数量性状位点定位所使用的模型和环境等因素的影响,导致定位的结果在数目、位置和效应上研究结果不尽一致。因此进一步发掘和鉴定小麦籽粒PPO活性的QTL,研究它们的分布和遗传效应,对于实现PPO活性的QTL精细定位、图位克隆以及定向改良具有重要的理论意义和应用价值。本研究以花培3号和豫麦57构建的168个DH系为材料,在2年6种环境条件下,鉴定小麦籽粒PPO活性的基因位点,为了解小麦籽粒中PPO活性的遗传基础提供参考和依据,并为该性状的遗传改良提供基因资源和技术支撑。
1 材料与方法
1.1试验材料和田间试验
1.1.1DH群体高产、多抗的花培3号和综合性状优良的豫麦57杂交F1通过花药培养,经染色体加倍获得168个双单倍体(DH)系。田间试验于2009年在山东农业大学试验农场种于3个生长环境。环境I为正常管理(于冬季、拔节期、开花期、灌浆期灌溉;拔节期、灌浆期追施氮肥两次,分别为225 kg/hm2和75 kg/hm2;小麦生长期间降雨量和灌溉量分别为122.0 mm和270.0 mm);环境II未追肥;环境Ⅲ为雨养。2010年在保定农科院,邢台农科院,沧州青县原种场种植,3个地点试验地肥力均匀,管理同一般大田管理。随机区组设计,3次重复,行长3 m,行距0.25 m。收获籽粒后脱粒,测定籽粒PPO活性。
1.1.2小麦分子标记连锁图谱DH群体的分子遗传图谱由山东农业大学小麦品质育种研究室构建[15]。遗传图谱包括小麦21条染色体的324个位点(284个SSR、37个EST-SSR、1个ISSR和2个HMW标记)。图谱全长2485.7 cM,2个标记间的平均遗传距离为7.67 cM,形成24个连锁群,分布于小麦的21条染色体上。
1.2籽粒PPO活性的测定
参照Anderson等[12]方法,采用D,L-DOPA、MOPS试剂和分光光度计测定籽粒的PPO活性。
1.3数据统计及QTL定位
利用SPSS17.0软件进行表型数据的统计分析。根据上述遗传图谱,利用基于混合线性模型的Icimapping 2.2软件,用完备区间作图方法(Inclusive composite interval mapping,ICIM)[16]对6种环境下小麦籽粒多酚氧化酶活性分别进行QTL分析[17-20],LOD阈值为2.5,Step值为1 cM。QTL命名参照等的方法。
2 结果与分析
2.1亲本及DH群体的PPO活性
两个亲本的PPO活性差异明显,花培3号的PPO活性明显低于豫麦57(表1);DH群体的PPO活性值呈连续性变异,变幅较大,符合正态分布,并存在明显的双向超亲分离现象(图1),表明小麦PPO活性为多基因控制的数量性状,适合进行QTL定位分析。

表1 不同环境下小麦DH群体的PPO活性Table 1 PPO activity values of wheat DH population lines in different environment

图1 DH群体PPO变异分布Fig.1 Distribution of PPO activity in DH population
2.2小麦籽粒PPO的QTL定位及效应估计
共检测到位于染色体1B、2A、2B、2D、3A、5B和6B的15个QTL,可解释7.99%~65.84%的表型变异(见表2)。在6个环境中都检测到2D染色体上的主效QTL,但位置略有不同。另外一些效应较小的QTL,在各个环境中没有重复出现。在山东3个环境和邯郸点检测到了相同的主效QTL,位于2D染色体上,标记区间为Xcfd168-Xbarc349.2(两者的遗传距离为1.6 cM),加性效应值为-0.42和-1.66,可解释表型变异的11.65%~65.84%,增效基因来自于PPO活性高的父本豫麦57。保定点和沧州点的主效QTL标记区间分别为Xbarc349.2-Xbarc349.1和Xbarc349.1-Xcfd161,距离Xbarc349.1标记0.7 cM和5.3 cM,可解释表型变异的11.34%和11.98%,加性效应值分别为-0.60和-0.51,增效基因来自于PPO活性高的豫麦57。山东环境Ⅰ和环境Ⅲ中分别检测到2D染色体上的2个QTL,标记区间为Xwmc18-Xwmc17O.2,分别距离Xwmc17O.2标记0.4和3.4 cM,加性效应值分别为0.85和1.15,分别可解释表型变异的17.24%和11.12%,增效基因来自于母本花培3号。

表2 小麦籽粒PPO活性的QTLTable 2 QTLof grain polyphenol oxidase(PPO)activity
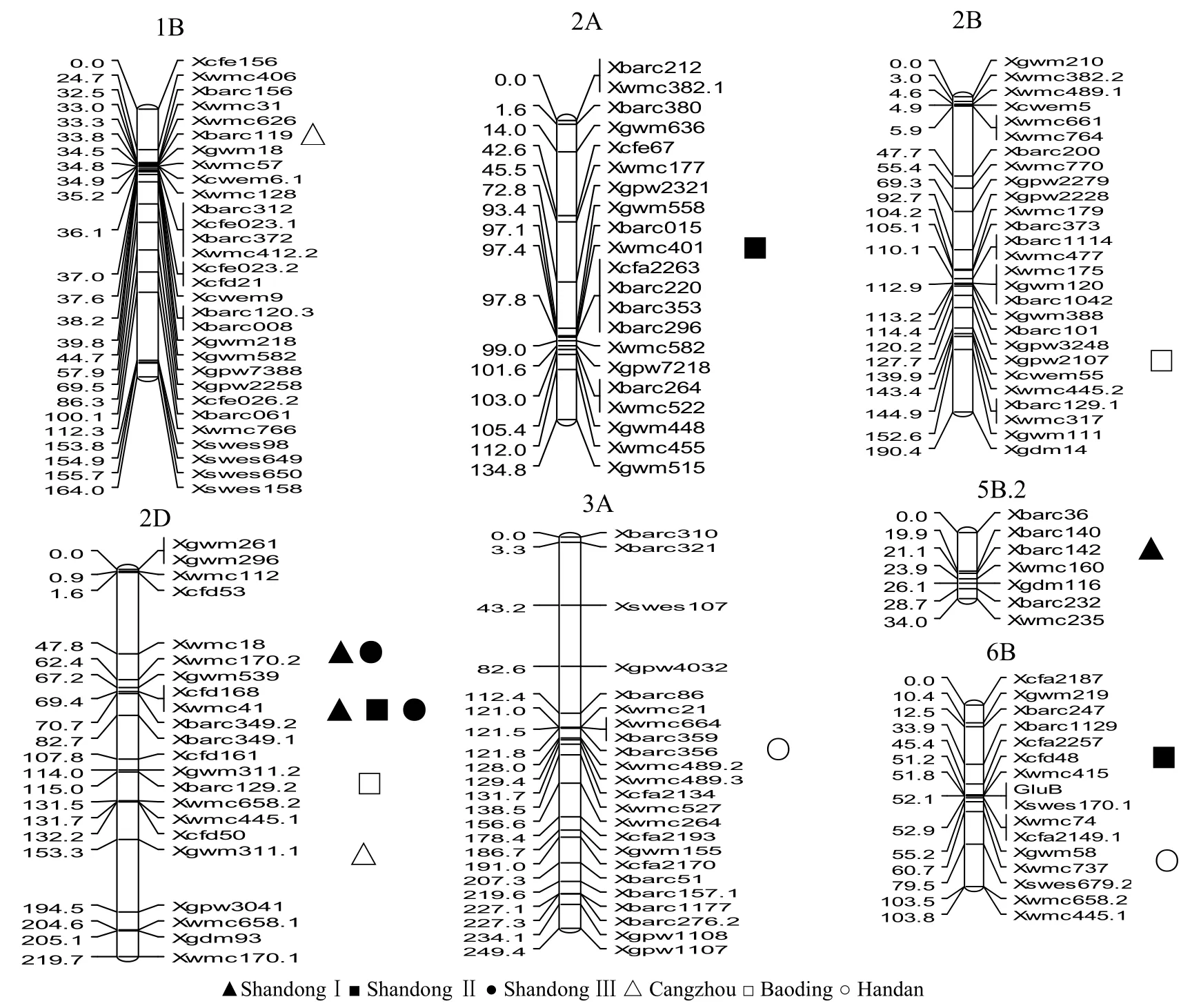
图2 小麦PPO活性QTL位点在SSR图谱上的位置Fig.2 QTLfor PPO in SSR linkage map
3 讨论
3.1环境和遗传背景对QTL检测的影响
数量性状一般受环境的影响较大,如温度、湿度、日照长短、土壤状况等均可成为基因表达调控的成分,对QTL能否稳定遗传和表达有一定的争论。控制数量性状的许多QTL与环境条件存在明显的互作效应,不同的环境条件下,基因的表达与否以及表达量的多少会存在一定的差异,因此环境条件影响QTL的检测。本研究检测到位于染色体1B、2A、2B、2D、3A、5B和6B的15个QTL,表明控制小麦籽粒PPO活性的QTL分布比较广泛。在6个环境下均能检测到2D染色体上相同或相近QTL位点,且贡献率都较大。这些QTL是比较稳定的,认为其是可靠的。对于那些只在单一地点检测到的QTL,如5B染色体上的qPPO-5B,即使其具有较大的效应值,其定位结果只能作为参考。
3.2小麦籽粒PPO活性QTL定位结果的多样性
本研究中,4个环境中都检测出2D染色体同一主效QTL(标记Xcfd168-Xbarc349.2),贡献率分别为65.84%、11.65%、22.73%、14.05%。该位点与Mares等[11](标记P41/M32-1)和张立平等[13](标记WMC41-P41/M32)所得的结果比较可以看出,主效QTL的染色体定位基本一致,但在染色体上的位点是不同的。究其原因,可能是构建群体的小麦亲本材料不同,控制PPO活性的基因不同,研究方法不同或田间试验准确性差异所致。前人研究有的所用DH群体较小,有的所用多态性引物较少,有的只在1年或1种环境下种植,有的可能田间试验误差较大,有的所用的分析软件不同。本研究是在2年6种小麦生长环境下进行的,试验地肥力均匀,田间管理细致,DH群体(168个系)较大,重组基因型丰富,群体内PPO活性变异广泛,所用的多态性引物较多,构建的连锁图位点密集,所有这些都保证了本研究所定位位点的准确性。
4 结论
利用2个小麦品种花培3号和豫麦57杂交获得的DH群体及其构建的小麦遗传图谱,检测到控制小麦籽粒PPO活性的15个加性效应位点。其中,2D上主效QTL(标记Xcfd168-Xbarc349.2)在4个环境下都能被检测到,贡献率分别为11.65%~65.84%,增效等位基因均来源于花培3号。因此, Xcfd168可用于小麦多酚氧化酶活性的分子标记辅助育种。
[1]Baik B K,Czuchajowska Z,Pomeranz Y.Discoloration of dough for oriental noodles[J].Cereal Chem,1995, 72(2):198-205
[2]Bhattacharya M,Luo Q,Corke H.Time-dependent changes in dough color in hexaploid wheat landraces differing in polyphenol oxidase activity[J].J.Agric.Food Chem,1999,47:3579-3585
[3]Miskelly D M.Flour components affecting paste and noodle color[J].J Sci FoodAgric,1984,35:463-471
[4]Kruger J E.Effects of flour refinement on raw Cantonese noodle color and texture[J].Cereal Chem,1994,71:177-182
[5]Morris C F,Jeffers H C,Engle D E.Effect of processing,formula and measurement variables on alkaline noodle color-toward an optimized laboratory system[J].Cereal Chem,2000,77:77-85
[6]葛秀秀,何忠虎,杨金,等.我国冬小麦品种多酚氧化酶活性的遗传变异及其与品质性状的相关分析[J].作物学报,2003,29(4):112-116
[7]Jimenez M,Dubcovsky J.Chromosome location of genes affecting polyphenol oxidase activity in seeds of common and durum wheat[J].Plant breeding,1999,118:395-398
[8]葛秀秀,张立平,何中虎,等.冬小麦PPO活性的主基因+多基因混合遗传分析[J].作物学报,2004,30(1):18-20
[9]Udall J.Important alleles for noodle quality in winter wheat as identified by molecular markers:[M].Moscow: University of Idaho.1997
[10]Demeke T,Morris C F.Wheat polyphenol oxidase:distribution and Genetic mapping in three inbred line populations[J]. Crop Sci.,2001,41:1750-1753
[11]Mares D J,Campbell A W.Mapping components of flour and noodle colour in Australian wheat[J].Australian Journal ofAgricultural Research,2001,52:1297-1309
[12]Anderson J V,Morris C F.An improved whole-seed assay for screening wheat germplasm for polyphenol oxidase activity[J].CropSci,2001,41:1697-1705
[13]张立平,葛秀秀,何中虎,等.普通小麦PPO活性QTL分析[J].作物学报,2005,31(1):7-10
[14]常成.小麦及近缘种属籽粒硬度PPO性状及分子机理研究[D].北京:中国农业大学,2005:52-57
[15]Zhang K P,Tian J C,Zhao L,et al.Detection of quantitative trait loci for heading date based on the doubled haploid progeny of two elite Chinese wheat cultivars[J].Genetics,2009,135:257–265
[16]王建康.数量性状基因的完备区间作图方法[J].作物学报,2009,35(2):239–245
[17]Li H H,Ye G H,Wang J K.A modified algorithm for the improvement of composite interval mapping[J].Genetics, 2007,106:361–374
[18]Li H H,Ribaut J M,Li Z L,et al.Inclusive composite interval mapping(ICIM)for digenic epistasis of quantitative traits in biparental populations[J].Theor Appl Genet,2008,116:243–260
[19]Zhang L Y,Li H H,Li Z L,et al.Interactions between markers can be caused by dominance effect of QTL[J].Genetics, 2008,108:1177–1190
[20]McIntosh R A,Devos K M,Dubcovsky J,et al.Catalogue of gene symbols for wheat[J/OL].[2009-06-30]. http://wheat.pw.usda.gov/ggpages/wgc/2005upd.html
[21]McCouch S R,Cho Y G,Yano M,et al.Report on QTL nomenclature[J].Rice Gentetics Newsletter,1997,14:11-13
[22]Steffens J C,Hunt M D.Polyphenol oxidase.Genetic Engineering of Plant Secondary Metabolism[M].Newyork: Plenum Press,1994:275-312
[23]王凤宝,付金峰,董立峰.多酚氧化酶活性与小麦抗穗发芽的关系及抗穗发芽新品种秦麦3号的选育[J].麦类作物学报,2006,26(5):97-100
[24]吴玉良,杨煜峰,丁守仁.无原花色素大麦突变体穗发芽的研究[J].浙江农业大学学报,1996,22(6):647-650
QTL Analysis on Polyphenol Oxidase Activity in Wheat Kernel
ZHAO Yong1,WANG Jie1,YANG Xue-fang1,LI Xiao-yun1,ZHANG Shu-hua2, TIAN Ji-chun3,YANG Xue-ju2*
1.CollegeofAgronomy,AgriculturalUniversityofHebei/CropGermplasmLaboratoryofHebeiProvince,Baoding071000,China
2.College of Life Sciences,Agricultural University of Hebei,Baoding 071000,China
3.College of Agronomy,Shandong Agricultural University,Tai’an 271018,China
Polyphenol oxidase(PPO)activity is a key factor causing the undesirable darkening of wheat(Triticum aestivum L.)products.A population of 168 doubled haploid derived from two elite Chinese wheat cultivars Huapei 3 and Yumai 57, grown in six different environments in two continuous cropping seasons.The Quantitative Trait Loci(QTL)for PPO activity was analyzed based on the constructed molecular linkage map of this population,including 324 markers covering the whole wheat genome.A total of 15 additive QTL were detected,the major QTL(Xcfd168-Xbarc349.2)was identified on chromosome 2D,accounting for 11.65%~65.84%of the phenotypic variance across four environments,they could be used in marker-assisted selection(MAS).
Wheat;polyphenol oxidase;Quantitative trait loci(QTL)
Q554+.1
A
1000-2324(2015)02-0189-05
2013-12-02
2013-12-21
河北省应用基础研究计划重点基础(13966302d)
赵勇(1984-),男,河北沧州人,博士研究生.研究方向:小麦育种.E-mail:zhaoyong_0423@163.com
Author for correspondence.E-mail:shmyxj@126.com

