Ni/Fe物质的量的比对Ni-Fe催化剂表面性质和二硝基甲苯加氢活性的影响
郝志强 于智慧 李忠*,
(1太原理工大学,煤科学与技术教育部与山西省重点实验室,太原030024)
(2赛鼎工程有限公司,太原030024)
Ni/Fe物质的量的比对Ni-Fe催化剂表面性质和二硝基甲苯加氢活性的影响
郝志强1于智慧2李忠*,1
(1太原理工大学,煤科学与技术教育部与山西省重点实验室,太原030024)
(2赛鼎工程有限公司,太原030024)
采用Fe粉置换氯化镍溶液中的Ni2+制备了Ni-Fe催化剂,并应用于催化二硝基甲苯加氢合成甲苯二胺的反应中。运用XRD、低温氮吸附-脱附、H2-TPD、XPS和TEM等技术手段对不同Ni/Fe物质的量的比(nNi/nFe)下催化剂进行了表征。结果表明,nNi/ nFe对Ni-Fe催化剂表面性质影响显著。当nNi/nFe为1∶4时,Fe抑制Ni氧化的作用达到最大,Ni-Fe催化剂化学氢吸附量和活性物种Ni的分散度分别达到了0.16 mmol·g-1和23%,催化剂性能得到较大的提升。在优化的催化剂制备条件下,DNT(二硝基甲苯)的转化率和TDA(甲苯二胺)的选择性分别达到了~100%和99%。另外,对Ni-Zn漆原镍(Urushibara Ni)催化剂和Ni-Fe催化剂催化DNT加氢反应进程进行了研究,发现它们有相同的加氢中间产物,但反应不同阶段的催化速率存在差异。
Ni-Fe催化剂;二硝基甲苯;甲苯二胺;催化加氢
二硝基甲苯(Dinitrotoluene,DNT)加氢合成甲苯二胺(Toluene Diamine,TDA)是二异氰酸酯(Toluene Diisocyanate,TDI)工业生产中的核心技术。目前采用的催化剂主要有Pd/C等贵金属催化剂和Ni基催化剂。其中,由于价格和分离等原因,Ni基催化剂的研究和开发越来越受到重视[1-2]。
大量文献报道,Ni与Fe相互作用能够形成Ni-Fe双金属合金[3-4],改变Ni与Fe周围的化学环境,二者间的协同作用有利于催化剂催化活性的提高。Lei等[5]在镍基催化剂中引入Fe组分,通过调变Ni/ Fe物质的量比(nNi/nFe)有效地提高了甲酚加氢制备甲苯的选择性,且双金属Ni-Fe催化剂表现出了优于单质Ni金属催化剂的稳定性。Yan等[6]发现,Fe助剂能促进Ni物种的分散,提高催化剂的稳定性,且贫电子的金属Fe与富电子的金属Ni之间存在电子转移,这种相互作用有利于加氢反应的进行。Fang等[7]在研究喹啉加氢和二苯并噻吩加氢反应催化剂时发现,在镍基催化剂中添加Fe能显著提升催化剂的催化活性,这是由于Fe和Ni间存在电子转移,使Ni的结合能减小而铁的结合能增大,二者产生了协同作用。在双金属Ni-Fe体系中,Fe能起到电子供体的作用,Ni能起到收集H2并产生活性氢原子的作用,在镍铁间存在的连续电子传递能促使镍周围的电子密度增高,反应活性增强[8-10]。另有研究报道[11],将Fe组分引入镍基催化剂中,Fe容易与FeNi/ C和FeCoNi/C催化剂中的Ni形成Ni-Fe合金物相,而文献[12]也报道,Fe的引入能调控Ni在催化剂表面和体相间的迁移,当nNi/nFe为3∶1时,双金属Ni-Fe催化剂在CO2催化加氢反应中表现出了优良的催化性能。
我们前期研究[13]中,通过等体积浸渍的方法,将Fe掺杂到Ni/SiO2催化剂中,发现Fe与Ni形成的双金属Ni-Fe合金,能够提高DNT的转化率和TDA的选择性。近期研究表明[14],采用铁粉代替锌粉置换镍盐溶液中的Ni2+,然后用醋酸溶液活化制备的Ni-Fe催化剂,能在DNT液相加氢反应中表现出较好的催化活性。为了进一步研究确定Fe在Ni-Fe双金属催化剂体系中的作用,本工作重点考察了nNi/nFe对催化剂的微观结构及其催化DNT加氢性能的影响。
1实验部分
1.1 催化剂的制备
在氮气保护条件下,于250 mL三口烧瓶中依次加入5.6 g Fe粉(125~149 μm,AR级,天津化学试剂三厂)和10 mL去离子水(GB50172-92,自制),并将其置于70℃的水浴中。在搅拌条件下,加入2 mol·L-1氯化镍溶液(NiCl2·6H2O,AR级,天津化学试剂三厂),置换反应7 h,之后用100 mL 3 mol·L-1的醋酸溶液(冰乙酸,AR级,天津科密欧化学试剂有限公司)活化。活化反应结束后,将所得黑色物质用去离子水反复洗涤至pH≈7,然后用甲醇(AR级,天津市光复精细化工研究所)洗涤3次即得到不同制备条件下的Ni-Fe催化剂,并将其保存在甲醇中备用。
1.2 催化剂的表征
催化剂的X射线衍射(XRD)在采用日本Rigaku D/max 2500型X射线衍射仪上进行,Cu Kα射线(经Kα2剥离处理,λ=0.154 056 nm),扫描速度8°·min-1,石墨单色器,靶电压和电流分别为40 kV和100 mA,步长0.01°,扫描范围5°~85°,闪烁计数器记录强度。
BET比表面积在贝士德3H-2000 PS2型静态容量法比表面积孔径分析仪上进行,测定前样品在250℃和104kPa的条件下处理4 h,然后在-196℃下对样品进行氮气吸附-脱附过程,在相对压力0.05~0.20之间,通过BET方程式计算出比表面积。
催化剂H2程序升温脱附技术(H2-TPD)实验在美国Micromeritics公司Autochem П 2920型全自动程序升温化学吸附仪上进行。将20 mg催化剂,置于U型石英反应管中。先用30 mL·min-1的N2吹扫,以10℃·min-1升至200℃对样品进行预处理。然后以90℃·min-1降至40℃,用10%H2和90%Ar(V/V)的混合气以30 mL·min-1的速度吸附20 min,然后切换为纯Ar,待基线稳定后,以10℃·min-1升温至600℃后脱附,用TCD检测器检测H2信号。
催化剂的XPS表征在英国VG Scientific公司ESCAL-ab 220i-XL型X射线光电子能谱仪进行分析,激发源采用Al Kα(1 486.6 eV),功率约为300 W,由污染碳C1s峰(284.6 eV)作为内标校正,Ar+束流电压为0.5 kV,真空室的真空度1.33×10-10Pa,分辨率0.2 eV。
催化剂样品中的Fe和Ni元素的含量采用VARIAN公司的AA240FS型号原子吸收分光光度仪进行测定。称取0.05 g催化剂样品并用浓硝酸溶解,然后稀释至一定浓度,用原子吸收分光光度仪进行分析。
催化剂的TEM表征在日本电子JEM-2100F场发射透射电镜上进行,加速电压200 kV。将催化剂样品分散在乙醇溶液中,并通过超声波分散10 min,将悬浮液滴在铜网格中的碳支撑膜上制样,然后进行分析。
1.3 催化剂的评价
将5.00 g DNT和100 mL甲醇加入250 mL烧杯中,于60℃水浴溶解30 min后,将其倒入反应釜中,同时快速加入0.50 g催化剂,并密封。在室温条件下,先用N2(99.99%,北京氦普北分气体工业有限公司)置换反应釜3次,然后用H2(99.99%,北京氦普北分气体工业有限公司)置换反应釜3次,并以H2冲压至2.0 MPa。以10℃·min-1升温至110℃,并在500 r·min-1搅拌条件下开始反应,反应过程中通入H2以使压力维持在2.0 MPa,反应时间为2 h。液相产物由GC9160型气相色谱分析仪分析其组成。使用SE-30毛细管色谱柱(0.32 mm×0.33 μm×30 m),氢火焰离子化检测器(FID)检测。载气N2流量30 mL·min-1,H2流量20 mL·min-1,空气流量200 mL· min-1,柱温100℃,进样器温度230℃,检测器温度200℃,进样量1.0 μL,进样分流比为60∶1。采用面积校正归一法计算产物含量,校正因子采用外标物测定。
2结果与讨论
2.1 nNi/nFe对Ni-Fe催化剂及其催化性能的影响
2.1.1 Ni-Fe催化剂的物相组成
图1为不同nNi/nFe制备的Ni-Fe催化剂的XRD图。对照Ni(PDF No.65-2865)、Fe(PDF No.65-4899)的XRD标准图发现,图中出现了2θ=44.5°,51.8°,76.4°的金属Ni或Ni-Fe合金的特征衍射峰,而2θ= 44.7°,65.0°,82.3°的单质金属Fe的特征衍射峰没有出现。在Fe置换Ni2+过程中,金属Fe容易取代Ni晶格中的Ni原子,形成Ni-Fe合金,其特征衍射峰与Ni基本重合[15-16],但由于Fe的原子半径较大,使生成的Ni-Fe合金的特征衍射峰较单质金属Ni的衍射峰向小角度发生了偏移[17-18],详见表1。

图1 不同nNi/nFe的Ni-Fe催化剂的XRD图Fig.1 XRD patterns of Ni-Fe catalysts with differentnNi/nFe

表1 不同nNi/nFe的Ni-Fe催化剂的XRD图分析Table1 XRD analysis of Ni-Fe catalysts with different nNi/nFeratios
通过Jade软件对各催化剂XRD图中2θ=44°的单质金属Ni和Ni-Fe合金衍射峰拟合后的半峰宽进行数据采集,并通过Scherrer公式计算了催化剂的晶粒尺寸,见表1。从表中可以看出,当nNi/nFe为1∶1和1∶2时,Ni-Fe催化剂晶粒尺寸分别达到最大和最小,二者相差4.4 nm;而nNi/nFe为1∶3~1∶5时,Ni-Fe催化剂晶粒尺寸相近,表明不同的nNi/nFe对Ni-Fe催化剂晶粒尺寸存在影响,但调控的粒径范围较小。
2.1.2 Ni-Fe催化剂的比表面
不同nNi/nFe制备的Ni-Fe催化剂的BET比表面积结果见表2。从表中可以看出,所制备的Ni-Fe催化剂的比表面积均较小。nNi/nFe为1∶1时,Ni-Fe催化剂的比表面积仅为2 m2·g-1;而当nNi/nFe为1∶4时,Ni-Fe催化剂的比表面积达到8 m2·g-1;继续减小nNi/nFe,催化剂比表面积明显下降,为4 m2·g-1。可见,Ni-Fe催化剂制备过程中,nNi/nFe对催化剂表面结构存在较大影响。在醋酸溶液活化过程中,未反应及被氧化的Fe物种被脱除以暴漏出更多镍铁合金和金属镍的活性位点[19-20],随着nNi/nFe的减小及醋酸的活化作用,这部分Fe以离子形式脱除,而以Ni-Fe合金形式存在的Fe较难脱除[14],使得Ni-Fe催化剂比表面积较小且差别较大。
2.1.3 Ni-Fe催化剂的表面分散度
由催化剂的H2-TPD图(图2)可以看出,不同nNi/ nFe下制备的Ni-Fe催化剂均出现了多个氢脱附峰,可见催化剂存在多种氢吸附中心,其中70℃左右出现的脱附峰(Peak 1)对应于物理吸附氢的脱附峰,200~400℃范围内的脱附峰归属于化学吸附氢的脱附峰。低温化学脱附峰(Peak 2)归属于催化剂中单质镍活性中心吸附氢的脱附峰,高温化学脱附峰(Peak 3)归属于Ni-Fe合金活性中心吸附氢的脱附峰[21]。

表2 不同nNi/nFe的Ni-Fe催化剂的BET比表面积Table2 BET surface area of Ni-Fe catalysts with different nNi/nFe
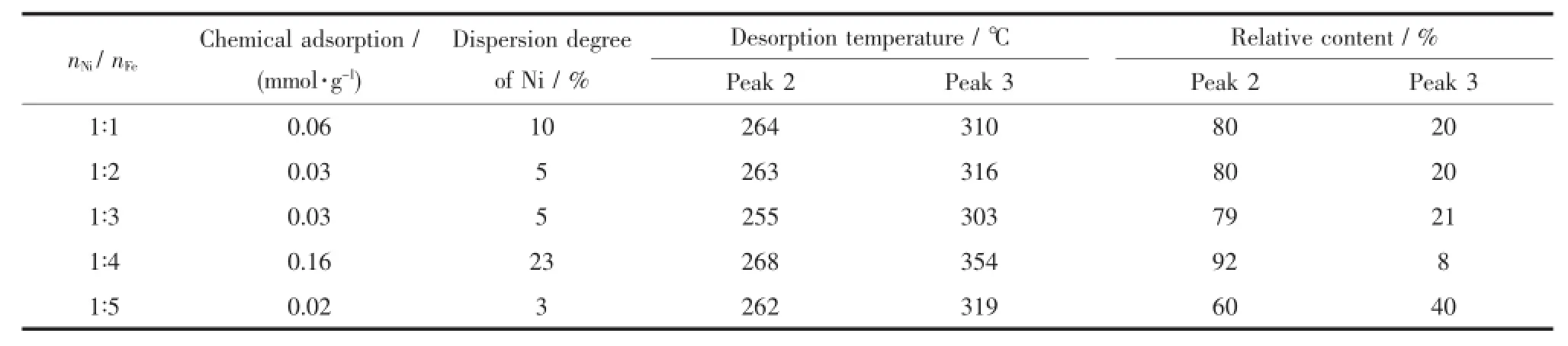
表3 不同nNi/nFe的催化剂的H2-TPD分析结果Table3 H2-TPD analysis of Ni-Fe catalysts with different nNi/nFeratios

图2 不同nNi/nFe的Ni-Fe催化剂的H2-TPD图Fig.2 H2-TPD profiles of Ni-Fe catalysts with differentnNi/nFe
由于Ni-Fe催化剂的化学氢脱附峰均存在不同程度的重叠,故通过高斯拟合对催化剂的化学氢脱附峰进行了分峰处理,并通过化学氢吸附量计算了各催化剂活性物种Ni的分散度,其数据结果见表3。可以看出,随nNi/nFe的减小,制备得到的Ni-Fe催化剂化学氢吸附量并非呈线性变化:nNi/nFe从1∶1变为1∶2时,化学吸附氢量减小,而从1∶2到1∶5的变化过程中,催化剂化学吸附氢量先增加后减少。nNi/ nFe为1∶4制备的催化剂化学吸附氢量达到最大值(0.16 mmol·g-1),且活性物种Ni的分散度达到了23%,表明催化剂中含有较多的Ni活性中心数和较大的Ni活性物种分散度。从表中脱附峰温可以看出,nNi/nFe为1∶4制备的Ni-Fe催化剂氢脱附温度高于其他nNi/nFe下制备的催化剂,特别是其高温化学吸附氢的脱附峰温度,表明此时Ni-Fe合金活性中心对氢的吸附作用更强,催化剂中Fe对Ni产生的相互作用更大。另外,nNi/nFe为1∶4制备的Ni-Fe催化剂含有相对较多的低温脱附氢,表明催化剂中在较低温度下的活性位点相对较多,有利于催化剂催化活性的提高。同时,相对于高温脱附氢而言,低温脱附氢更加活泼,更易在催化剂表面流动并参与反应[22-24],是DNT加氢制备TDA过程中硝基加氢转化为氨基的主要活性氢来源。
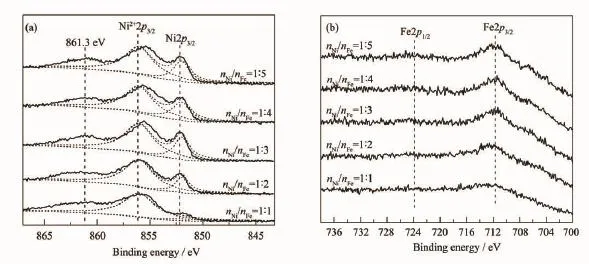
图3 不同nNi/nFe的Ni-Fe催化剂的XPS谱图Fig.3 XPS spectra of Ni-Fe catalysts with different nNi/nFe
2.1.4 Ni-Fe催化剂的表面组成
图3为在空气中放置10 h后不同nNi/nFe的Ni-Fe催化剂的XPS谱图。从图(a)可以看出,经空气中氧化后Ni-Fe催化剂表面存在大量的Ni2+,其他则以Ni0形式存在。其中,结合能为861.3 eV的峰归属于Ni2+的特征峰伴峰[15,25]。通过对结合能为856.1和852.0 eV的Ni2+2p3/2和Ni2p3/2的特征峰分峰拟合,计算了不同nNi/nFe下Ni-Fe催化剂的氧化程度,见表4。从表4可以看出,随着nNi/nFe由1∶1到1∶4减小,Ni的氧化程度减弱,在nNi/nFe为1∶4时氧化程度最小,为70%。继续减小nNi/nFe,Ni0的氧化程度略有增高,为73%。可见,Fe的存在能减缓Ni的氧化[26],且在nNi/nFe为1∶4时,这种效果最显著。图(b)中各催化剂的Fe2p XPS谱图基本相似,结合能在700~720 eV和719~725 eV分别归属于Fe2p3/2和Fe2p1/2的特征峰[7,9]。经XPS及AAS表征,我们对Ni-Fe催化剂表面和整体实际的nNi/nFe进行了分析,见表4。从表中可以看出,各Ni-Fe催化剂整体的nNi/nFe(分布在9~16)明显高于表面的nNi/nFe值(分布在3~6),说明Ni-Fe催化剂中合金相主要分布在催化剂的表面,且催化剂表面的nNi/nFe值与文献[12]报道的能够形成Ni-Fe合金的nNi/nFe值相近。而随着制备过程中nNi/nFe的减小,Ni-Fe催化剂表面的nNi/nFe呈下降趋势。当nNi/nFe为1∶4时,制得的Ni-Fe催化剂表面nNi/ nFe达到最小(3.6),说明此时催化剂表面以合金态存在的Fe相对较多。

图4 经Ar+刻蚀2 min后nNi/nFe为1∶4的Ni-Fe催化剂的XPS谱图Fig.4 XPS spectra of Ni-Fe catalysts with nNi/nFeof 1∶4 sputtered by Ar+for 2 min
图4为经Ar+刻蚀2 min后的nNi/nFe为1∶4的催化剂的XPS谱图。由图(c)可以看出,Ni2p1/2(869.6 eV)和Ni2p3/2(852.6 eV)的结合能比文献报道的标准结合能(分别为870.0 eV和853.0 eV)[24]减少了0.4 eV,说明Ni-Fe催化剂中Ni元素和Fe元素间存在电子转移,且Ni呈富电子状态,这有利于活性氢原子的生成及催化剂反应活性的提高[9]。之后,通过对Fe2p XPS谱图分峰拟合,对Fe元素的化学状态进行了分析,见图(d)。在图(d)中,结合能为704.2 eV和712.0 eV分别归属为Fe0和Fe2+的特征峰[9],结合能为713.8 eV归属为Fe3+的特征峰[7],可见Fe元素在Ni-Fe催化剂中以多种化学状态存在的。
2.1.Ni-Fe催化剂的形貌
为了较直观的观察Ni-Fe催化剂的形貌结构及粒子的大小,我们对Ni-Fe催化剂进行了TEM表征。图5为nNi/nFe为1∶4制备的Ni-Fe催化剂的TEM图。从图中可以看出,制备得到的Ni-Fe催化剂呈链条形状,与文献[9,25,28]报道的Ni-Fe催化剂形态类似;且Ni-Fe催化剂发生了较为严重的团聚,这是因为催化剂中含有的Ni与Fe具有一定的磁性,颗粒间的磁力作用以及电子相互作用[8-9]使得制得的Ni-Fe催化剂产生了团聚现象。通过选区用统计的方法估算了催化剂粒子尺寸,由粒径分布图可以看出,Ni-Fe催化剂中粒径较小的粒子(S)主要分布在15~24 nm,平均粒径为19 nm,而较大的粒子(L)粒径分布在25~50 nm,平均粒径37 nm,所制备的Ni-Fe催化剂具有纳米结构。

表4 不同nNi/nFe的催化剂的XPS数据分析Table4 XPS analysis for Ni-Fe catalysts with different nNi/nFe

图5 nNi/nFe为1∶4的催化剂的TEM图Fig.5 TEM images of Ni-Fe catalyst with nNi/nFeof 1∶4
2.1.6 Ni-Fe催化剂的催化性能
图6为不同nNi/nFe下Ni-Fe催化剂催化DNT加氢性能评价结果图。从图中可以看出,随着nNi/nFe的减小,DNT转化率和TDA选择性均呈现先升高后降低的趋势。当nNi/nFe由1∶1减小到1∶4时,DNT转化率和TDA选择性分别由原来的28%和13%提高到98%和86%,达到最大。当nNi/nFe继续减小到1∶5时,DNT的转化率和TDA的选择性分别下降为76%和57%。结合H2-TPD和XPS结果可知,Fe与Ni之间存在电子转移,并且Fe能促使更多催化活性中心的形成,在nNi/nFe为1∶4时,催化剂稳定性提高,且活性中心数特别是低温Ni活性中心数增多,Ni-Fe催化剂催化活性得到了较大提升。
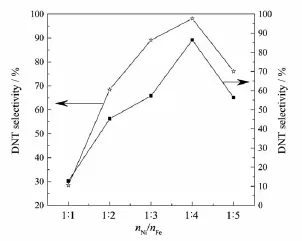
图6 不同nNi/nFe的Ni-Fe催化剂的活性评价Fig.6 Catalytic performance of Ni-Fe catalyst with different nNi/nFe
2.2 Ni-Fe催化剂制备条件的优化
2.2.1 反应温度和反应时间的优化
不同反应温度及反应时间的Ni-Fe催化剂催化DNT加氢性能见图7中(a)和(b)。从图(a)可以看出,在整个反应区间,DNT的转化率和TDA的选择性都呈现先升高后降低的趋势。当置换反应温度为50℃时,所制备催化剂催化DNT的转化率为29%,TDA的选择性为12%。随着反应温度(50~70℃)的提高,DNT的转化率和TDA的选择性均有较大程度的提升,催化剂的催化性能增强。当反应温度为70℃时,DNT的转化率达到了98%,TDA的选择性达到了99%,达到最大。当反应温度(70~90℃)继续升高时,DNT的转化率略有降低,TDA的选择性则出现较大的降幅。从图(b)可以看出,当置换反应时间为5 h时,DNT的转化率就达到了~100%,而TDA的选择性仅为32%;延长反应时间,TDA的选择性有了较大的提高,当反应时间为7 h时,TDA的选择性达到了~100%;继续增加反应时间(7~9 h),DNT的转化率趋于稳定,而TDA的选择性呈现下降的趋势。

图7 反应温度和反应时间对Ni-Fe催化剂催化性能的影响Fig.7 Influence of reaction temperature(a)and reaction time(b)on catalytic performance of Ni-Fe catalysts

图8 醋酸浓度对Ni-Fe催化剂催化性能的影响Fig.8 Influence of HAc concentration on catalytic Performance of Ni-Fe catalysts
2.2.2 醋酸活化浓度的优化
图8为不同醋酸浓度制备的Ni-Fe催化剂催化性能的评价结果。
从图8中可以看出,随着醋酸浓度的增大,DNT的转化率和TDA的选择性都呈现先升高后降低的趋势。醋酸浓度为1 mol·L-1时,制备的Ni-Fe催化剂催化DNT的转化率为18%,TDA的选择性为14%。当醋酸浓度为3 mol·L-1时,DNT的转化率和TDA的选择性分别达到了~100%和99%,继续升高醋酸浓度,DNT的转化率和TDA的选择性都呈现下降趋势。
2.3 Ni-Fe催化剂的稳定性
图9为新鲜及反应1次、3次和5次后的Ni-Fe催化剂的XRD图。由图中可以看出,循环反应5次后,Ni-Fe催化剂的物相组成并没有发生变化。通过Jade软件采集各催化剂2θ=44°附近的半峰宽,并用Scherrer公式计算了催化剂的晶粒尺寸,见表5。由表5可以看出,随着反应次数的增加,Ni-Fe催化剂晶粒尺寸有增大的趋势,这可能是由于反应过程中催化剂发生团聚引起的。其中,循环反应5次后,Ni-Fe催化剂晶粒尺寸由最初的15.7 nm增大为17.5 nm。
Ni-Fe催化剂稳定性实验结果见表6。从表中可以看出,Ni-Fe催化剂在不补加的情况下循环使用5次,其DNT转化率均在99%以上,TDA的选择性均在98%以上,表明了制备的Ni-Fe催化剂具有良好的催化活性和稳定性。

图9 新鲜及反应不同次数的Ni-Fe催化剂的XRD图Fig.9 XRD patterns of Ni-Fe catalysts with different recycle times
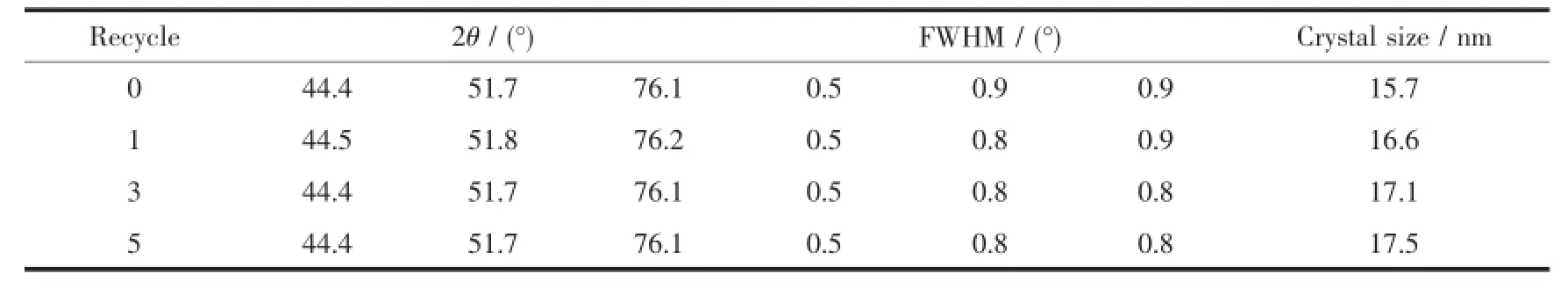
表5 新鲜及反应不同次数的Ni-Fe催化剂的XRD图分析Table5 XRD analysis of Ni-Fe catalysts with different recycle times

表6 Ni-Fe催化剂的加氢稳定性Table6 Stability of Ni-Fe catalyst for catalytic hydrogenation
2.4 Ni-Fe催化剂与Ni-Zn漆原镍催化剂加氢反应过程
图10为以锌粉作为还原剂制备的Ni-Zn漆原镍催化剂[29]和本工作以铁粉作为还原剂制备的Ni-Fe催化剂催化DNT加氢中间产物随加氢反应时间的变化关系。从图中可以看出,Ni-Zn漆原镍和Ni-Fe催化剂催化加氢过程中均有相同的中间物相生成。由图10(a)可以看出,Ni-Zn漆原镍催化剂催化DNT加氢的0~40 min内,2,4-DNT含量由80%下降为13%,2,6-DNT含量由20%下降为5%,加氢40 min时中间物的含量达到最大。加氢时间80~120 min内,产品TDA的含量变化较小,反应120 min时TDA含量为94%。
从图10(b)可以看出,Ni-Fe催化剂催化DNT加氢60 min时中间物的含量才达到最大,此时2,4-DNT含量由80%下降为15%,2,6-DNT含量由20%下降为6%,产品TDA含量仅为20%。随着加氢时间的延长,中间物转化为产品TDA的速率逐渐增大,产品TDA含量呈现线性增长。加氢时间为120 min时,产品TDA的含量达到了~100%。可见,Ni-Zn漆原镍催化剂能够较快的催化DNT转化为中间物,但中间物转化为产品TDA的速率较慢,而Ni-Fe催化剂催化DNT转化为中间物的速率较慢,由中间物转化为产品TDA的速率较快。

图10 Ni-Zn漆原镍催化剂和Ni-Fe催化剂的加氢反应进程Fig.1 0DNT hydrogenation process diagram over Ni-Zn Urushibara nickel catalysts(a)and Ni-Fe catalysts(b)
3结论
Ni-Fe双金属催化剂中Fe的存在能改变Ni的还原性,促进低温Ni活性中心的形成;能促进活性组分Ni的稳定性,对Ni的氧化起到一定的抑制作用;与Ni之间存在电子转移,促使Ni呈富电子状态,增强催化剂催化活性。在nNi/nFe为1∶4时,制备得到的Ni-Fe催化剂表现出了良好的催化活性和稳定性。另外,与Ni-Zn漆原镍催化剂催化DNT加氢过程相比,Ni-Fe催化剂催化DNT加氢反应途径相同,且在催化DNT中间产物转化为产品TDA的过程中催化效率更高。
[1]YAN Shao-Wei(闫少伟),FAN Hui(范辉),LIANG Chuan (梁川),et al.Chem.J.Chinese Universities(高等学校化学学报),2012,33(9):2067-2073
[2]YAN Shao-Wei(闫少伟),FAN Hui(范辉),LIANG Chuan (梁川),et al.Chinese J.Catal.(催化学报),2012,33(8):1374 -1382
[3]Surapas S,Wei A,Daniel E R.J.Catal.,2011,284:90-101
[4]Wang L,Li D L,Koike M,et al.Appl.Catal.A:Gen., 2011,392:248-255
[5]Lei N,Priscilla M de Souza,Fabio B N,et al.J.Mol.Catal. A:Chem.,2014,388-389:47-55
[6]Yan X H,Sun J Q,Wang Y W,et al.J.Mol.Catal.A: Chem.,2006,252(1/2):17-22
[7]Fang M X,Tang W,Yu C J,et al.Fuel Process.Technol., 2015,129:236-244
[8]Lin C H,Shih Y H,MacFarlane J.Chem.Eng.J.,2015,262: 59-67
[9]Alokd B,Rajeevc C,Chandrashekharv V R,et al.Environ. Sci.Technol.,2007,41:7437-7443
[10]Han Y,Li W,Zhang M H,et al.Chemosphere,2008,72: 53-58
[11]Oliveira V L,Morais C,Servat K,et al.Electrochim.Acta, 2014,117:255-262
[12]Tian D Y,Liu Z H,Li D D,et al.Fuel,2013,104:224-229
[13]YU Zhi-Hui(于智慧),YAN Ze(闫泽),FAN Hui(范辉),et al. Chinese J.Inorg.Chem.(无机化学学报),2014,30(6):1317 -1324
[14]YU Zhi-Hui(于智慧),YAN Ze(闫泽),FAN Hui(范辉), et al.Chem.J.Chinese Universities(高等学校化学学报), 2014,35(10):2227-2233
[15]Fang Z Q,Qiu X H,Chen J H,et al.J.Hazard.Mater., 2011,185:958-969
[16]Kustov A L,Frey A M,Larsen K E,et al.Appl.Catal.A: Gen.,2007,320:98-104
[17]Adabavazeh Z,Karimzadeh F,Enayati M H.Adv.Powder Technol.,2012,23(3):284-289
[18]Pandey D,Deo G.J.Mol.Catal.A:Chem.,2014,382:23-30
[19]Zhang Z,Cissoko N,Wo J J,et al.J.Hazard.Mater., 2009,165(13):78-86
[20]Jacob I,Fisher M,Hadari Z,Herskowitz M,et al.J.Catal., 1986,101(1):28-34
[21]Benrabaa R,Lfberg A,Rubbens A,et al.Catal.Today, 2013,203:188-195
[22]Zhang W H,Quan X,Wang J X,et al.Chemosphere, 2006,65:58-64
[23]SHI Qiu-Jie(石秋杰),LEI Jing-Xin(雷经新),ZHANG Ning (张宁).Acta Phys.-Chim.Sin.(物理化学学报),2007,23:98 -102
[24]Wu Z J,Zhang M H,Zhao Z F,et al.J.Catal.,2008,256: 323-330
[25]Han Y L,Yan W L.Water Res.,2014,66:149-159
[26]Schrick B,Blough J L,Jones A D,et al.Chem.Mater., 2002,14(12):5140-5147
[27]WANG Wei-Yan(王威燕),YANG Yun-Quan(杨运泉),LUO He-An(罗和安),et al.Chinese J.Catal.(催化学报),2011,32 (10):1645-1650
[28]Wei J J,Qian Y J,Liu W J,et al.J.Environ.Sci.,2014,26: 1162-1170
[29]LIU Hao(刘皓),LI Ruo-Yu(李若愚),ZHANG Meng(张濛), et al.Chinese J.Catal.(催化学报),2009,30(7):606-612
Influence of Ni/Fe Molar Ratio on Surface Properties of Ni-Fe Catalysts and Hydrogenation Performance of Dinitrotoluene
HAO Zhi-Qiang1YU Zhi-Hui2LI Zhong*,1
(1Key Laboratory of Coal Science and Technology of Ministry of Education and Shanxi Province,Taiyuan University of Technology,Taiyuan 030024,China)
(2Sedin Engineering Company Limited,Taiyuan 030024,China)
Ni-Fe catalysts were prepared via the replacement reaction of NiCl2by Fe and used for the selective hydrogenation of dinitrotoluene(DNT)in liquid phase.The influences of Ni/Fe molar ratio(nNi/nFe)on the surface properties and catalytic performance of Ni-Fe catalysts were investigated.The characterization results from XRD,Low temperature nitrogen adsorption-desorption,H2-TPD,XPS and TEM show that nNi/nFehas a significant effect on the surface properties of Ni-Fe catalysts.When nNi/nFeis 1∶4,the effect of Fe inhibition on the oxidation of nickel is more apparent,the chemical adsorption of hydrogen is 0.16 mmol·g-1and the dispersion of active species Ni achieves 23%.The performance of Ni-Fe catalysts is greatly improved.Under the optimized catalysts preparation conditions, the conversion of DNT(dinitrotoluene)and the selectivity of TDA(toluenediamine)could reach~100%and 99%,respectively.In addition,Ni-Zn Urushibara nickel catalysts and Ni-Fe catalysts have~the same catalytic hydrogenation~pathway but different catalytic reaction rate in a different reaction stages.
Ni-Fe catalyst;dinitrotoluene;toluenediamine;catalytic hydrogenation
O643.3;O614.81
A
1001-4861(2015)08-1571-10
10.11862/CJIC.2015.186
2015-04-12。收修改稿日期:2015-05-21。
国家“973”计划(No.2012CB723105)资助项目。
*通讯联系人。E-mail:lizhong@tyut.edu.cn;会员登记号:S06N4167M1005。

