二次纳米自组装大孔氧化铝贯穿孔道的NSA形成机理
王爽 丁巍*,,3 王鼎聪 赵德智
(1辽宁石油化工大学化学化工与环境学部,抚顺113001)
(2中国石化抚顺石油化工研究院,抚顺113001)
(3中国石油大学(北京)重质油国家重点实验室,北京102249)
二次纳米自组装大孔氧化铝贯穿孔道的NSA形成机理
王爽1丁巍*,1,3王鼎聪2赵德智1
(1辽宁石油化工大学化学化工与环境学部,抚顺113001)
(2中国石化抚顺石油化工研究院,抚顺113001)
(3中国石油大学(北京)重质油国家重点实验室,北京102249)
采用纳米自组装法合成的大孔氧化铝催化材料FA-06,具有1.39 mL·g-1的孔容、297 m2·g-1的比表面积、32.4 nm的最可几孔径和81.85%的孔隙率,孔道集中分布于10~30 nm和30~60 nm的比例分别占35.61%和40.88%。GPC结果表明,对于形成反相超增溶胶束的高聚物RHP,可通过改变聚异丁烯马来酸酐(PIBSA)的量来控制其分散度和相对分子量,进而控制大孔氧化铝的孔道结构。TEM及SEM结果表明,纳米自组装氢氧化铝棒长600~800 nm,直径为250~300 nm,经550.0℃焙烧后,形成直径为150~300 nm,长度为400~600 nm的纳米氧化铝棒。从焙烧后的纳米自组装氢氧化铝的XRD结果证明了3种γ-Al2O3的前躯体完全转化为γ-Al2O3。结合TG的结果,表明在605.0℃时,拟薄水铝石完全转化为γ-Al2O3,总失重可达61.88%。基于以上实验结果,模拟了反向超增溶胶束、氢氧化铝及大孔氧化铝的分子自组装和纳米自组装的形成过程,并提出了纳米自组装大孔氧化铝贯穿孔道的NSA(Nano Self-Assembly)形成机理。
高分子;模板剂;贯穿孔道;扩散;渣油
0引言
纳米材料作为纳米科学和纳米技术的基础,受到国内外相关行业的广泛关注。对于纳米材料的研究,已经从最初的单相金属发展到合金、化合物、化合物-无机载体等复合材料。制备纳米材料的主要方法有气体蒸发法[1]、化学气相沉淀法[2]、水解法[3]、微乳液法[4]、溶胶-凝胶法[5]及共沉淀法[6]等。自组装法[7-9]作为新型纳米材料的制备方法,是利用分子间的非共价键作用自发形成稳定分子聚集体的过程,并且在合成纳米管[10-11]、多层膜[12-13]、多孔材料[14-15]及纳米聚集体[16-17]等纳米材料方面均有广泛的应用。与胶态晶体自组装法[18]相比,采用模板剂自组装法[19]合成的纳米材料具有结构广泛、分散性良好、结构性能可控等优点[20-21]。
随着石油资源重质化、劣质化的日益严重,对石油产品需求量的不断扩大以及环保法规的不断严格使得重质油轻质化受到炼油行业的广泛关注。加氢工艺是实现重质油轻质化的唯一途径。其中,催化剂作为加氢工艺最重要的组成部分,一直是相关行业的研究热点。氧化铝及其改性产品作为常用的渣油加氢催化剂载体,具有酸性过低、孔容较小、孔道分布不均等特点。王鼎聪[22-23]在多年研究乳化炸药的基础上提出了反相纳米自组装超增溶胶束的概念,将95wt%的熔盐与5wt%的油相混合物合成的超增溶胶团用于催化剂载体的制备中,得到了堆积密度较低的大孔氧化铝载体。
基于前期实验研究[22-26],实验通过GPC、TEM、XRD、SEM和TG等表征手段,对RHP的分子量、氢氧化铝从分子自组装到纳米自组装的形成过程和微观形貌、晶向结构及失重情况进行分析,有望提出一种纳米自组装法合成大孔氧化铝贯穿孔道的NSA形成机理。利用压汞法将自组装大孔氧化铝载体与其他氧化铝载体的孔性质进行比较。从而提出一种适合大分子物质扩散的新型渣油加氢催化剂载体的合成方法。
1实验部分
1.1 试剂
九水硝酸铝,分析纯;尿素,分析纯;冰醋酸,分析纯;炭黑,分析纯;润滑油基础油150HVI,工业品;氧化铝粉体,工业品;聚异丁烯马来酸三乙醇胺酯(RHP),自制;去离子水,自制。
1.2 分析仪器及样品的表征
PL-GPC50凝胶色谱仪,用于测量表面活性剂RHP的分子量;荷兰生产TECNAI20型透射电子显微镜,最高放大倍数100万倍,用于观察自组装体颗粒形貌和分散状况以及粒径大小及分布状况;日本理学生产的D/2500型X光射线衍射仪,用于分析自组装产物焙烧前后的晶型结构和结晶状况,光源波长0.154 nm,(铜靶)X射线,管工作电压和电流分别为40 kV和80 mV,扫描范围10°~70°;日本生产JSM-6301F型扫描电子显微镜,加速电压20 kV,用于观察自组装体的外貌及粒子的大小;德国NETZSCH公司生产的DSC204HP高压差热分析仪,用于一定压力下物质与参比物之间能量差随温度的变化及固体和液体样品在恒温和升温过程中的物相转变和热焓变化测量;美国麦克公司生产AUTOPORE II 9220压汞仪,用压汞法来分析样品的孔容、比表面积、孔径等性质;
1.3 样品的制备方法
称取表面活性剂RHP 50 g和润滑油基础油150HVI 140 g,将其混合加热至70℃,制成有机模板剂。称取九水硝酸铝800 g和尿素250 g,将其混合加热至70℃。在高速搅拌条件下,将无机熔融盐缓慢加入有机模板剂中,制成超增溶胶团。将超增溶胶团置于体积为2 L的反应釜,进行10 h的原位合成反应。其中,控制反应温度和压力分别为100℃和6.0 MPa。将产物进行水洗脱氨、干燥、粉碎,得到纳米自组装氢氧化铝粉体。取200 g粉体,与8 g醋酸和120 g去离子水进行捏合,挤条成型后,120℃烘干3 h,550℃焙烧10 h,得纳米自组装氧化铝载体。
2结果与讨论
2.1 RHP的凝胶色谱分析(GPC)
凝胶色谱法主要用于高聚物的相对分子质量分级分析以及相对分子质量的分布测试。该方法主要基于体积排阻的分离机理,通过考察高聚物中具有不同相对分子质量的物质在具有分子筛性质的固定相中的流出时间,进而分析未知高聚物的相对分子质量。当聚异丁烯马来酸酐(PIBSA)和三乙醇胺(TEA)分别以质量比为4∶1和12∶1形成聚合物RHP时,采用凝胶色谱法考察RHP的相对分子质量及分子分散程度,结果见图1。

图1 不同RHP的相对分子质量Fig.1 Relative molecular mass of different RHP
由图1可知,当PIBSA和TEA质量比分别为4∶1和12∶1时,聚合物RHP的重均分子量Mw分别为6 288和14 384,数均分子量Mn分别为2 566和2 545。随着PIBSA比例的增加,RHP的重均分子量明显增加,数均分子量无明显变化。说明PIBSA的用量对Mw影响较大,而对Mn影响较小。Mw的数值主要受大分子量分子数目的影响,这就说明当PIBSA和TEA质量比为12∶1时,RHP已形成大分子高聚物[27]。此外,从RHP的分散度(PD)来看,随着PIBSA含量的增加,分散度由2.45增加到5.65。说明相对分子质量的分布较宽,进一步证明高聚物RHP的形成。因此,通过改变PIBSA的含量可以控制RHP的相对分子质量,进而控制氧化铝载体的孔径分布。
2.2 RHP在油相中反相胶束形成过程
以一个结构单元(图2a)为例,模拟高聚物RHP反相胶束的自组装形成过程,结果见图2。
由图2a可知,RHP的一个结构单元是通过分子个数比为3∶2的PIBSA和TEA发生酯化反应形成的,PIBSA和TEA的分子量分别为1 199和149。其中,-R的结构为-[CH2-C(CH3)2]n-,n=20、分子量为1 120的聚异丁烯基,得到RHP一个结构单元的相对分子量为3 895。由3D空间构型(图2b)可知,PIBSA与TEA在酯化条件下形成RHP的结构单元,随后,多个结构单元通过分子间弱的相互作用力,自组装成具有六边形结构,且体系稳定的高分子聚合物RHP的反相胶束。当RHP达到一定浓度后,多个RHP的疏水基相互缔合,形成球状、片状、棒状等不同形状的胶束。

图2 RHP的结构单元及形成过程Fig.2 Structure unit and the formation process of RHP
2.3 氢氧化铝分子自组装过程
将熔盐超增溶于有机模板剂中,得到超增溶胶团。将超增溶胶团进行原位反应,并对其产物进行脱氨处理,即得到氢氧化铝分子自组装体,其微观形貌见图3。
如图3a所示,超增溶胶团是大量无规则的纳米粒子通过分子自组装作用形成的超分子胶团[24]。由图3b可以看出,经脱氨处理后的薄片状分子自组装氢氧化铝中粒子大量分散。这是由于分子自组装氢氧化铝通过弱相互作用力结合了大量的水,使其没有形成纳米粒子结构。同时,在图3a中,A、B、C 3处球状纳米粒子的直径分别为4、10和25 nm。
从前期工作[22-23]可以看出,通过有机模板剂和无机熔融盐所形成的粒子是处于纳米范畴的、具有丁达尔效应的多边形胶团。将多边形胶团近似为球状胶团,以直径为10 nm的球状胶团为例,由球状体积公式:计算可知,球状胶团的体积为268.08 nm3,而其密度则与宏观的超增溶胶团密度一致。称取15 mL超增溶胶团,其重量为21.97 g,通过密度公式可知,超增溶胶团的密度为1.46 g·mL-1,即直径为10 nm的球状胶团密度为1.46 g·mL-1。通过如下公式,计算该球状胶团中各物质的分子个数,结果见表1。
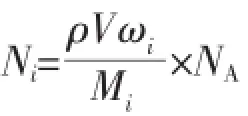
其中,Ni表示分子个数、ωi表示质量百分数、Mi表示相对分子质量,i=1,代表九水硝酸铝;i=2,代表尿素;i=3,代表150HVI;i=4,代表RHP。ρ和V分别表示球状胶团的密度和体积。
由表1可知,直径为10 nm的超增溶胶团中含有九水硝酸铝、尿素、150HVI及RHP分子的个数分别为378~437、778~917、35~101及2~5,进一步表明超增溶胶团是大量分子化合物通过分子间自组装作用形成。随后,超增溶胶团经过原位合成反应[28]生成拟薄水铝石。方程式如(1)所示:

由方程式(1)可知,九水硝酸铝全部转化为拟薄水铝石,并生成了硝酸铵及二氧化碳。随着反应的进行,生成物拟薄水铝石在沉淀剂的作用下会被增溶到RHP与150HVI的有机模板剂中,它们以弱相互作用力结合成氢氧化铝分子自组装体。以RHP一个结构单元为例,考察拟薄水铝石、150HVI与RHP的分子结合方式,模拟氢氧化铝分子自组装体的形成过程,见图4。

图3 分子自组装氢氧化铝的TEM照片Fig.3 TEM images of molecular self-assembly aluminum hydroxide

表1 胶团中各物质的参数Table1 Parameters of each substance in the micelle

图4 分子自组装氢氧化铝的结构单元及形成过程Fig.4 Structure unit and the formation process of supersolubilizing molecular self-assembly
由图4可知,表面活性剂RHP同时具有亲水和亲油两亲基团,与内、外相具有互溶性。大量的氢氧化铝分子可通过静电作用与RHP内壁的亲水基进行分子自组装,而150HVI则通过范德华力与RHP的疏水基形成致密的连续疏水膜[24],形成内相为盐相、外相为油相的反向胶束[29]。这些大量的胶束以无序的布朗运动方式进行分子自组装,形成不同体积大小、不同形状的胶团,为大孔氧化铝载体无规则孔道的形成提供条件。
2.4 氢氧化铝纳米自组装过程
对水洗脱氨后的分子自组装氢氧化铝进行干燥、成型,得到纳米自组装氢氧化铝。将其在550℃时焙烧,得到纳米自组装氧化铝。利用XRD考察水洗脱氨后纳米自组装氢氧化铝和焙烧后纳米自组装氧化铝的晶型变化,并表征纳米自组装氧化铝在焙烧前后的SEM图,结果见图5、图6。
由图5可知,曲线A、B分别表示水洗脱氨后纳米氢氧化铝和焙烧后纳米氧化铝的晶向变化趋势。从曲线A可看出,脱氨后的纳米自组装氢氧化铝中存在3种γ-Al2O3的前躯体,他们分别为AlO(OH)、AlOOH和(NH4)Al6(CO3)3(OH)14·xH2O。其中,2θ=28.2°, 45.8°,49.2°,55.2°和65.0°时,出现了AlO(OH)的(120)、(131)、(200)、(151)和(002)的5个晶面的特征衍射峰。当2θ=26.3°,27.0°,30.9°,38.3°和53.0°时,产生了AlOOH的特征衍射峰。在2θ=15.3°,21.8°,35.1°和44.4°处是(NH4)Al6(CO3)3(OH)14·xH2O的特征衍射峰。其中,2θ=15.3°的峰型尖锐,说明其络合物具有良好的晶型结构,且络合物稳定,因此,普通的水洗法是无法将氨全部脱除的。当焙烧后,曲线B表明,2θ= 37.5°、45.7°和66.6°时,明显产生γ-Al2O3的(311)、(400)和(440)的3个晶面的特征衍射峰,且在37.5°处峰较宽泛,表明自组装氧化铝以纳米粒子的形式存在。

图5 纳米自组装氢氧化铝焙烧前后的XRD图Fig.5 XRD patterns of nano self-assembly aluminum hydroxide before and after burned

图6 纳米自组装氢氧化铝焙烧前后的SEM照片Fig.6 SEM images of nano self-assembly aluminum hydroxide before and after burned

图7 纳米自组装氢氧化铝的TEM照片Fig.7 TEM images of nano self-assembly aluminum hydroxide
图6a中纳米自组装氢氧化铝具有直径为250~300 nm、长度为600~800 nm的棒状结构。经焙烧脱除有机模板剂后,如图6b所示,纳米棒状氧化铝的直径减小到150~300 nm,长度变化到400~600 nm,并以松散、无序的堆积方式搭建出不同大小的贯穿性孔道,有利于大分子物质的动力学扩散[30]。利用TEM考察纳米自组装氢氧化铝焙烧前的微观形貌,结果见图7。
由图7a可知,由于水的脱除,相互分散的反向胶束通过分子间的弱相互作用紧密的聚集在一起,形成如A、B、C 3处所示的直径为50~65 nm、长度约为520 nm左右且相互堆积的纳米棒状体,得到了与SEM一致的结果。这是由于在干燥过程中,纳米粒子在表面张力的作用下完成单分子层的自组装,并开始第二层的自组装,直至完全干燥,从而形成层层自组装的棒状纳米氢氧化铝[31]。因此,缓慢的干燥过程是氢氧化铝由分子自组装向纳米自组装过渡的关键[32]。将纳米棒状体B进行放大,如图7b。考察其内部结构,发现D、E、F 3处是反向胶束间通过相互吸附、卷曲形成的直径为18~30 nm的囊泡,进一步证实了有机模板剂的存在[33]。以一个氢氧化铝自组装体的结构单元为例,模拟纳米自组装氧化铝的形成过程,见图8。

图8 纳米自组装氢氧化铝的形成过程及堆积方式Fig.8 Formation process and of nano-self assembly aluminum hydroxide
如图8所见,通过分子自组装形成的自组装体经过再次自组装过程,形成纳米自组装氢氧化铝棒。焙烧脱除有机模板剂后,纳米氢氧化铝棒转化成纳米氧化铝棒,纳米氧化铝棒相互堆积产生贯穿的孔道,从而形成纳米自组装大孔氧化铝载体。
2.5 纳米自组装氢氧化铝的DSC分析
对纳米自组装氢氧化铝的失重进行分析,结果见图9。

图9 纳米自组装氢氧化铝的热重分析Fig.9 TG analysis of nano self-assembly aluminum hydroxide
从图9的TG曲线可以看出,纳米自组装氢氧化铝的分解经历了240、303和522℃3个过程,总失重为61.88%。240℃时,失重32.25%,速率达到最大。这是由结晶水的挥发,拟薄水铝石转化为氧化铝及少量模板剂的脱除引起的。当温度达到303℃时,失重为46.23%,速率略有降低,脱除了部分有机模板剂。当焙烧到522℃时,纳米自组装氢氧化铝失重为59.76%。继续升温至1291℃,失重不明显,表明结晶水及有机模板剂基本脱除。结合DSC曲线可以看出,当温度达到605.0℃时,γ-Al2O3完全形成,并因有机模板剂的脱除和氢氧化铝体积的急剧收缩产生较大的孔道。这也是SEM中产生贯穿性孔道的原因。
2.6 不同改性氧化铝载体孔性质的对比
分别将普通氧化铝粉体和纳米自组装氧化铝粉体成型,得到普通氧化铝载体FC-33和纳米自组装氧化铝载体FA-06。在FC-33中添加适量的炭黑进行扩孔处理,得到炭黑改性的氧化铝载体TH-05。将FC-33高温焙烧,得到物理改性的氧化铝载体HG-13。利用压汞法考察四种氧化铝载体的孔性质,结果见表2、图10。
如表2、图10所示,FC-33具有0.90 mL·g-1的孔容,338 m2·g-1的比表面积,9.1 nm的最可几孔径和73.33%的孔隙率。58.68%的孔道集中于10 nm以下,27.35%的孔道集中于10~20 nm。由此可知,普通氧化铝载体具有较小的孔容、孔径,不利于渣油的加氢反应。
与FC-33相比,TH-05具有较大的孔容1.19 mL·g-1和较小的最可几孔径6.0 nm,孔隙率略有增加,为76.01%。65.09%的孔道集中于30 nm以下,27.76%的孔道集中于100 nm以上。因此存在孔道连续性较差、分布不均的问题,缺少适宜大分子扩散的30~50 nm的孔道。
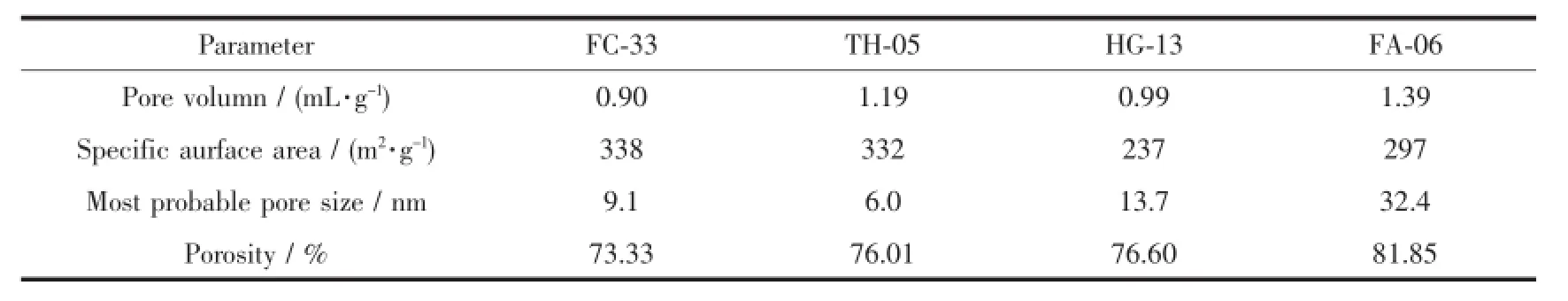
表2 不同氧化铝载体的孔性质Table2 Pore properties of different alumina support
HG-13具有较小的比表面积237 m2·g-1和较大的最可几孔径13.7 nm,孔隙率为76.60%。73.83%的孔道集中于10~20 nm。高温焙烧虽然可扩大孔道,但易发生小孔坍塌、孔壁烧结的现象,并导致氧化铝的酸性受到破坏,因此不利于催化反应的进行。
与上述3种载体相比,纳米自组装载体FA-06具有较大的孔容1.39 mL·g-1,较小的比表面积297 m2·g-1,较大的最可几孔径32.4 nm及较高的孔隙率81.85%。35.61%的孔道集中分布在10~30 nm,40.88%的孔道集中分布在30~60 nm。这是由于纳米自组装氢氧化铝在焙烧过程中脱除了大量的有机模板剂,从而大量产生30~60 nm贯穿性的孔道。因此,通过纳米自组装法制备的氧化铝载体孔结构得到有效的改善,适合于大分子物质的扩散[34]。
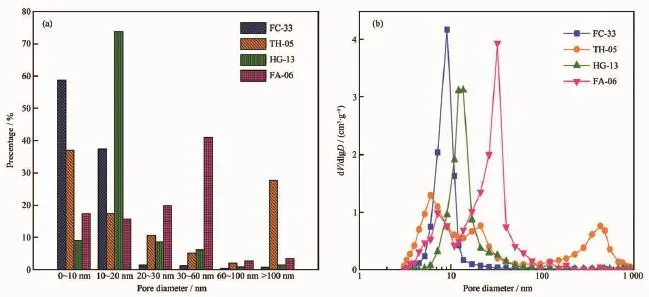
图10 四种氧化铝载体的孔分布和最可几孔径Fig.1 0Pore distribution and most probable pore size of four kinds of alumina supports
3结论
纳米自组装法合成的具有贯穿孔道的大孔氧化铝载体具有较大的孔容1.39 mL·g-1、孔径32.4 nm和比表面积297 m2·g-1。81.85%的孔隙率使得贯穿性的孔道高度集中在10~30 nm和30~60 nm两个区域,所占比例分别为35.61%和40.88%。高分子模板剂的脱除和氢氧化铝体积的急剧收缩是形成这种孔道结构的主要原因,PIBSA用量的改变可控制RHP的相对分子量和分散度,进而控制大孔氧化铝载体的孔道大小。纳米氢氧化铝棒在焙烧形成纳米氧化铝棒的过程中,总失重高达61.88%,直径由250~300 nm减小到150~300 nm,长度由600~800 nm减小到400~600 nm。基于实验结果,模拟了反向超增溶胶束、氢氧化铝及大孔氧化铝分子自组装和纳米自组装的形成过程,并提出纳米自组装氧化铝贯穿孔道的NSA形成机理。
[1]Gleiter H,Schimmel T H,Hahn H.Nano Today,2014,9(1): 17-68
[2]Minsu K,Eunseuk P,Hyounduk J,et al.Powder Technol., 2014,267:153-160
[3]Zhang J H,Xiao X,Nan J M.J.Hazard.Mater.,2010,176(1/ 2/3):617-622
[4]Zahra Z,Ahmad T,Saber T,et al.J.Energ.Chem.,2014,23 (1):57-65
[5]Chandra B B,Buddhudu S.Physics Procedia,2013,49:128-136
[6]Amiri S,Shokrollashi H.J.Magn.Magn.Mater.,2013,345: 18-23
[7]Guo Y B,Ren Z,Xiao W,et al.Nano Energy,2013,2(5):873 -881
[8]WANG Cheng(王程),SHI Hui-Sheng(施惠生),LI Yan(李艳), et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27(11): 2239-2244
[9]Huang B Y,Calvin H,Bartholomew B F,et al.Microporous Mesoporous Mater.,2014,183:37-47
[10]Shi Y F,Fu Y Y,Lü H L,et al.Mater.Lett.,2014,125(15): 198-201
[11]Wu W L,Pan D,Li Y F,et al.Electrochim.Acta,2015,152 (10):126-134
[12]Zhang X M,Li Z Y,Yuan X B,et al.Appl.Surf.Sci.,2013, 284(1):732-737
[13]Cai H Y,Tang Q W,He B L,et al.Electrochim.Acta,2014,121(1):136-142
[14]Meng K,Guo H J,Wang Z X,et al.Powder Technol.,2014, 254:403-406
[15]Zhang J,Yang D G,Li W J,et al.Electrochim.Acta,2014, 130(1):699-706
[16]Liu Q Y,Zhou H Y,Zhu J Q,et al.Mater.Sci.Eng.,C,2013, 33(8):4944-4951
[17]Xiong J Q,Tao J,Xu S J,et al.Mater.Lett.,2015,139(15): 173-176
[18]Wu Y T,Wang X F.Mater.Lett.,2015,142:109
[19]Zhang Y X,Hao X D,Diao Z P.Chin.Chem.Lett.,2014,25 (6):874-878
[20]YANG Xiao-Hong(杨小红),LIU Chang(刘畅),LIU Jin-Ku (刘金库),et al.Acta Phys.-Chim.Sin.(物理化学学报), 2011,27(12):2939-2945
[21]WANG Shi-Min(王世敏),XU Zu-Xun(许祖勋),FU Jing(傅晶).Preparation Technology of Nano Materials(纳米材料制备技术).Beijing:Chemical Industry Press,2002:244-281
[22]Wang D C.Sci.China Ser.B:Chem,2007,50(1):105-113
[23]Wang D C.Sci.China Ser.B:Chem,2009,52(12):2106-2113
[24]WANG Ding-Cong(王鼎聪).Sci.China Ser.B-Chem(中国科学B辑:化学),2006,36(4):338-346
[25]WANG Ding-Cong(王鼎聪),LIU Ji-Rui(刘纪瑞).Petroleum Processing And Petrochemicals(石油炼制与化工),2010,41 (1):31-35
[26]ZHANG Kai(张凯),WANG Ding-Cong(王鼎聪).Scientia Sinica Chimica(中国科学:化学),2013,43(11):1548-1556
[27]Zhang J X,Ma P X.Nano Today,2010,5(4):337-350
[28]Qiu F Y,Li L,Liu G,et al.Int.J.Hydrogen Energy,2013, 38(8):3241-3249
[29]Holgado P H,Holgado M J,Maria S,et al.Mater.Chem. Phys.,2015,151(1):140-148
[30]Mallaiah M,Sunil K T,Venkat R G.Chem.Eng.Sci.,2013, 104(18):565-573
[31]Zhang Y L,Xia J,Feng X,et al.Sens.Actuators,B,2012, 161(1):587-593
[32]ZHANG Jin-Zhong(张金中),WANG Zhong-Lin(王中林), LIU Jun(刘俊),et al.Self-Assembled Nanostructures(自组装纳米结构).Beijing:Chemical Industry Press,2005:81-91
[33]HE You-Zhou(贺有周),LIU Yun(刘云),LIU Peng(刘鹏), et al.Acta Phys.-Chim.Sin.(物理化学学报),2014,30(8): 1501-1508
[34]DING Wei(丁巍),WANG Ding-Cong(王鼎聪),ZHAO De-Zhi(赵德智),et al.Chinese J.Inorg.Chem.(无机化学学报), 2014,30(6):1345-1351
Formation Mechanism of NSA of Secondly Nano Self-Assembly Macropore Alumina Penetrable Pore
WANG Shuang1DING Wei*,1,3WANG Ding-Cong2ZHAO De-Zhi1
(1College of Chemical Engineering and Environmental Engineering, Liaoning Shihua University,Fushun,Liaoning 113001,China)
(2Fushun Research Institute of Petroleum and Petrochemicals,Fushun,Liaoning 113001,China) (3State Key Laboratory of Heavy Oil Processing,China University of Petroleum,Beijng 102249,China)
The macropore alumina catalysis material FA-06 was prepared by nano self-assembly technique which has a pore volume of 1.39 cm3·g-1,a specific surface area of 297 m2·g-1,most probable pore size of 32.4 nm and a porosity of 81.85%.High concentration pore size distribution of 10~30 nm and 30~60 nm which percentages are 35.61%and 40.88%,respectively.GPC showed that the dispersion and relative molecular weight of RHP are controlled by the amount of PIBSA,which is the formation material of RHP,in order to control the pore sizes. From TEM and SEM,the results showed that the diameters of nano aluminum hydroxide rods are 250~300 nm, and the lengths are 600~800 nm.After calcinating at 550.0℃,the nano alumina rods had the diameter of 150~300 nm,the length of 400~600 nm.XRD results of burned nano self-assembly aluminum hydroxide showed that γ-Al2O3be formed completely from three types of precursor of nano self-assembly aluminum hydroxide by burning process.Combining with data of TG,the γ-Al2O3is formed completely due to the decomposition ofpseudoboehmite at temperature of 605.0℃,and the total weight loss reaches 61.88%.Based on the above experimental results,the molecular self-assembly and nano self-assembly formation process of reverse supersoluble micelle,aluminum hydroxide and macropore alumina were simulated.Moreover,the formation mechanism of NSA of nano self-assembly macropore alumina with penetrable pores was presented.
macromolecule;template;penetrate pore;diffusion;residue
O614.3+1
A
1001-4861(2015)08-1539-09
10.11862/CJIC.2015.214
2015-02-14。收修改稿日期:2015-05-20。
中国石油化工集团(总合-JQ1416)资助项目;中国海洋石油总公司资助项目(No.20140331)。
*通讯联系人。E-mail:cicy1125@163.com

