多聚泛素UBI4低表达对新生隐球菌生长与毒力的功能影响
孟云芳1 周兆婧1 杨雅骊1 赵静宇1,2 张超1 法振宗1 桑军军1 方伟1 廖万清1
(1.上海长征医院皮肤病与真菌病研究所全军真菌病重点实验室第二军医大学附属长征医院皮肤科,上海200003;2.上海市皮肤病医院,上海200050)
多聚泛素UBI4低表达对新生隐球菌生长与毒力的功能影响
孟云芳1 周兆婧1 杨雅骊1 赵静宇1,2 张超1 法振宗1 桑军军1 方伟1 廖万清1
(1.上海长征医院皮肤病与真菌病研究所全军真菌病重点实验室第二军医大学附属长征医院皮肤科,上海200003;2.上海市皮肤病医院,上海200050)
目的 构建新生隐球菌的多聚泛素UBI4低表达菌株,检测UBI4低表达对新生隐球菌生长和毒力的功能影响。方法 采用融合PCR方法,扩增含有UBI4基因的片段,将其与含有组蛋白启动子的质粒融合。通过基因枪将重组质粒片段转化入新生隐球菌,应用PCR筛选、DNA序列测序以及实时定量PCR方法对基因重建株进行鉴定与验证。检测多聚泛素UBI4低表达菌株对多种应激耐受力、生长曲线以及对蜡蛾感染的毒力影响。结果 成功构建了新生隐球菌多聚泛素UBI4低表达。表型检测结果提示:较之标准株,UBI4低表达株生长速率下降,对高温、H2O2和NO应激以及多种抗真菌药物敏感性显著增强;同时,UBI4下调表达后隐球菌对蜡蛾的毒力显著下调。结论 我们的研究初步证实多聚泛素蛋白UBI4对新生隐球菌的生长增殖、应激应答以及感染能力具有重要的调控作用,为后续深入探讨新生隐球菌泛素系统的功能机制奠定基础。
新生隐球菌;多聚泛素;致病机制;应激应答。
[Chin J Mycol,2015,10(1):16⁃21]
新生隐球菌 (Cryptococcus neoformans)是临床上最重要的机会感染性病原菌之一,可感染免疫功能受损患者的中枢神经系统,常引发具有致命威胁的隐球菌性脑膜脑炎。近年来随着器官移植、抗肿瘤药物、糖皮质激素等免疫抑制剂的广泛应用以及HIV感染率的逐年增加,免疫功能受损人群日渐增多,新生隐球菌发病率也呈现出一定的上升趋势。
泛素是真核生物中普遍存在的一种高度保守蛋白,可通过标记靶蛋白介导蛋白质降解活动,这个过程称为“泛素化”,参与调控真核细胞的应激应答、有性繁殖、信号转导等多种重要的生物学过程[1]。新生隐球菌有两个泛素编码基因:UBI1和UBI4,其中UBI4编码含5个泛素单体的多聚泛素蛋白[2],其功能机制尚不明确。本课题组在前期研究中发现,〛去泛素化酶Ubp5对新生隐球菌的生长和毒力具有多效调控作用[3],我们推测其功能机制可能在于维系细胞内泛素水平的稳态。在此基础上,我们曾试图敲除多聚泛素基因UBI4但始终未能获得基因缺陷株。本研究中,我们拟构建隐球菌多聚泛素UBI4高表达菌株,意外得到低表达菌株,通过检测该菌株的生长与毒力表型改变,初步探索了该基因在新生隐球菌生长与感染过程中的功能机制。

表1 引物列表Tab.1 Primer list
1 材料与方法
1.1 实验材料
菌株与质粒 本研究中以本实验室保藏的新生隐球菌(C.neoformans var.grubbii,VNI)H99为背主要仪器和设备 Eppendorf移液器、摇床、水浴锅、BioRad PCR仪、真空泵冻干机、BiaRad基因枪、BioRad超速离心机等。
1.2 实验方法
多聚泛素基因UBI4高表达质粒的构建 应用PCR方法用引物 UBI4⁃F/R(其中5‘端均含有景菌株;应用的质粒为含有NAT抗性基因的质粒pCH20,为美国杜克大学John Perfect教授赠送。
培养基与主要试剂 基础培养基为 YPD、YNB、LB[3]。
以YPD固体培养基为基础,加入1 mol/L山梨醇(细胞膜保护剂)用于基因枪转化后菌株的修复生长,加入抗生素100 mg/L诺尔斯菌素用于筛选基因重建菌株阳性克隆子;分别加入0.02%SDS、0.1%咖啡因、0.5%刚果红、1.5 mol/L NaCl、1.5 mol/L KCL用于检测各菌株对各种应激的敏感性;YNB培养基中分别加入2 μmol/L H2O2、0.75 μmol/L NaNO2用以检测基因重建菌株及野生菌株对氧化应激和NO应激的敏感性;LB液体培养基中加入100 mg/L氨苄青霉素或卡那霉素用以培养含有基因UBI4高表达质粒的大肠杆菌。
实验中用到的山梨醇、SDS、咖啡因、刚果红、NaCl、KCl等试剂均购买自上海生工生物工程股份有限公司,诺尔斯菌霉素购买自Sigma⁃aldrich公司,Primestar DNA聚合酶等PCR相关试剂购买自Takara公司,酵母基因组抽提等试剂盒购自北京全式金生物技术有限公司,所有引物序列均由上海生工生物工程股份有限公司合成(见表1)。BamH I酶切位点)从隐球菌基因组上PCR扩增目的基因片段(含开放读码框架区和终止子区),预期DNA片段为2 470 bp(见图1a),将获得的UBI4 DNA片段和质粒pCH20经核酸内切酶BamH I处理后,用In⁃Fusion PCR Cloning试剂盒融合构建新的质粒载体pH3(p)::UBI4并用引物UBI4nb⁃f和Nat Probe F验证,目的片段应为1 750 bp。
基因枪转化 挑取标准株H99单克隆接入液体YPD培养基,在30℃摇床中以220 r/min转速培养过夜。将上述方法得到的感受态细胞经无菌水清洗三遍后定量,取500 μL涂布在1 mol/L山梨醇+YPD培养基上,常温晾干备用。把准备好的质粒与10 mL金珠、10 mL CaC12(2.5 mol/L)和2.5 mL亚精胺(1 mol/L)用涡轮振荡器混匀,混匀物静置10 min后用100 mL 100%乙醇重悬离心,得到的沉淀用12 mL 100%乙醇重悬并均匀涂布于载粒膜上风干。用基因枪通过高压将载粒膜上的DNA转入感受态细胞。30℃培养箱孵育4 h后转移至YPD+诺尔斯菌素培养基上孵育3~7 d。
阳性克隆的筛选与验证 从上述抗性培养基上挑取单克隆抽取DNA,用引物UBI4nb⁃f和Nat Probe F验证阳性克隆(见图1b),将阳性PCR产物送公司测序,测序正确的菌株进一步应用实时定量PCR检测。将待测菌株在液体YPD培养基中培养过夜,离心收菌后冻干,用试剂盒抽提RNA后保存在⁃80℃冰箱备用;用 SuperScript III First⁃Strand Synthesis Kit for RT⁃PCR试剂盒合成cDNA(具体操作详见说明书);以GPD1基因作为内参,将获得的cDNA模板应用引物UBI4⁃a/b做实时定量PCR检测,每个反应重复三次,取平均值。通过上述方法检测正确的菌株进一步用于后续的表型和毒力检测。
生长曲线检测 将待测菌株取单克隆菌落接入YPD液体培养基,摇床过夜培养;经血色球计数板计数定量,取106CFU入30 mL新鲜YPD培养基中,30℃和37℃摇床中培养(250 r/min);每4 h以分光光度计检测其OD600值,5~7 d后绘成生长曲线。
体外应激应答反应检测 将待测菌株在30℃摇床孵育过夜,离心收菌并以无菌水清洗两遍,调整至相同浓度,然后用PBS连续稀释 (1~106)后分别取3 mL菌悬液接种于各种应激培养基上,晾干后放在30℃孵箱孵育3~7 d后拍照。
抗真菌药敏实验 根据NCCLS protocol M⁃27A操作[4]。待测菌株提前在YPD固定培养基上孵育2~3 d,按照指南要求将抗真菌药物稀释:两性霉素B浓度为160~0.313 g/mL,卡泊芬净、氟康唑、氟胞嘧啶浓度均为640~1.25 g/mL。待测菌株用无菌水清洗后稀释到(1~5)×106细胞/mL,然后用生理盐水稀释100倍,再用RPMI 1640培养基稀释20倍后到(0.5~2.5)×103细胞/mL。把菌悬液加到配好的抗菌药物中,30℃孵育48 h后检测最小抑菌浓度(见表2)。
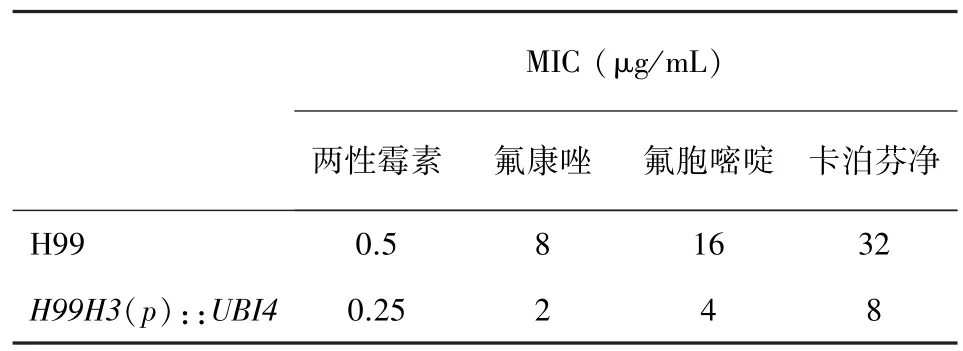
表2 多种抗真菌药物的最小抑菌浓度Tab.2 In vitro susceptibility of strains to four antifungal agents
蜡蛾实验 待测菌株定量至浓度为5×107细胞/L,挑选体重为(330±25)mg的蜡蛾随机分到H99组、H99His⁃UBI4组和PBS组。酒精棉球擦拭蜡蛾腹部,用10 mL Hamilton注射器在蜡蛾最后一只左前足注入血腔5 mL菌悬液,完毕后放置蜡蛾于黑暗处,每日查看每组蜡蛾死亡数。统计学上以Ka⁃plan⁃Meier生存曲线表示,并以Log rank test(SPSS 18.0)完成统计学分析,以P<0.05作为衡量是否具有统计学差异的标准。
2 结 果
2.1 多聚泛素UBI4基因重建株的构建与验证
由于前期研究中,我们一直无法获得多聚泛素UBI4的基因缺陷株,本研究拟通过构建强启动子(Histone启动子)驱动的UBI4表达质粒,继而转化隐球菌获得其高表达菌株。首先我们通过PCR获得多聚泛素基因中剔除启动子的DNA片段,PCR产物电泳如图1a,条带大小符合预期,经测序(结果未展示)提示片段完全正确。在此基础,我们成功将该片段应用Infusion⁃PCR试剂盒插入pCH20质粒,该重建质粒经煮菌PCR(见图1b)和PCR产物测序(结果未展示)检验后完全正确。将该质粒以基因枪转入新生隐球菌,经抗性培养基初步获得若干阳性克隆子,经PCR和DNA测序初步验证,提示质粒转化成功(见图1c)。
我们进一步应用RT⁃PCR方法来检测对比基因UBI4在标准株H99和H99His⁃UBI4的表达水平,结果意外地发现UBI4基因在H99His⁃UBI4的表达水平不仅没有上升反而显著下降(见图1d),提示我们新生隐球菌中多聚泛素基因存在复杂的转录调控机制,过度表达可能导致隐球菌无法正常地生长或存活,其机制尚有待于进一步探索。
2.2 多聚泛素UBI4参与隐球菌应激应答反应
我们进一步检测了多聚泛素UBI4低表达菌株对多种环境应激的耐受性。
通过比较UBI4低表达菌株与标准株H99在30℃、37℃和39℃的生长情况,发现前者在30℃培养时即表现出轻度的生长缺陷,37℃时生长缺陷加重,39℃时则几乎被生长抑制。在氧化应激 (2 mmol/L H2O2)和NO应激(0.75 mmol/L NaNO2)检测实验中,H99His⁃UBI4敏感性显著增强;同时,对高盐离子(1.5 mol/L NaCl、1.5 mol/L KCl)和高渗透压(1.5 mol/L山梨醇)敏感性也较标准株明显增强,对细胞壁 (0.02%SDS、0.1%咖啡因)、细胞膜(0.5%刚果红)应激反应也表现出更高的敏感性(见图2)。因此,多聚泛素UBI4可能参与了隐球菌对多种应激反应的调控。
由于近年来隐球菌出现了越来越多的耐药性,我们依据国际通用的标准抗真菌药敏实验操作指南 Cinical and Laboratory Standards Institute broth microdilution reference method(NCCLS)检测了UBI4下调表达对新生隐球菌对抗真菌药物耐力的影响[5]。考虑到 H99His⁃UBI4对高温敏感,所有菌株在30℃下孵育。与标准株H99相比,H99His⁃UBI4对各种药物敏感性显著增强,对两性霉素B最小抑菌浓度下降50%,对氟胞嘧啶、氟康唑和卡泊芬净均有下降75%(见表2)。质控菌株Candida parapsi⁃Losis(ATCC22019)对抗菌药物的最小抑菌浓度符合操作指南要求。
综上所述,多聚泛素UBI4对新生隐球菌的应激应答具有重要的调控作用,多聚泛素UBI4低表达导致隐球菌对高温、氧化和NO应激、高渗环境、胞膜/胞壁应激以及多种抗真菌药物的增强,这提示多聚泛素UBI4对隐球菌适应人体等宿主环境具有非常重要的正向调控作用。
2.3 多聚泛素UBI4调控新生隐球菌细胞增殖
由于H99His⁃UBI4即使在30℃和YPD培养基上也有明显生长缺陷,我们进一步评估其对隐球菌细胞增殖的影响。结果显示:标准株H99在30℃经过4 h生长停滞期后迅入指数生长期,约40 h后到达平台期。而 H99His⁃UBI420 h后才进入指数生长期,约 60 h后进入平台期。在 37℃环境下,H99His⁃UBI4经过约80 h后才进入指数生长期,120 h后到达平台期。另外,此前实验结果显示H99His⁃UBI4即使在30℃生长时单克隆也较标准株小,可能与较低的细胞增殖速率有关。因此,多聚泛素UBI4参与新生隐球菌细胞增殖的调控(见图3a,3b)。
2.4 多聚泛素UBI4低表达对新生隐球菌毒力的影响
蜡蛾是一种简易的动物模型,为了检测多聚泛素UBI4在新生隐球菌致病感染过程中的功能机制,我们构建了蜡蛾感染模型。实验结果显示,截止感染后20 d,H99感染组约93.3%的蜡蛾死亡,而H99His⁃UBI4感染组仅26.7%的蜡蛾死亡,其存活率显著高于标准株组(P<0.000 1)表现死亡率明显下降(见图3c);而与PBS组相比时,两组无显著的统计学差异 (P=0.145)。重复实验结果一致,提示多聚泛素UBI4对新生隐球菌毒力具有重要的调控作用。
3 讨 论
泛素系统是真核生物体中重要的蛋白修饰和蛋白降解系统,参与调控细胞内多种多样的生物学过程,如细胞周期、信号转导、转录调控、DNA修复以及应激反应等。在过去的几十年里,关于模式酵母和病原真菌泛素系统的功能与调控机制方面的研究依然取得了重要的进展。在酿酒酵母中存在四个泛素编码基因UBI1⁃UBI4,其中UBI1⁃UBI3在细胞指数生长期表达,UBI4编码多聚泛素蛋白,参与调控酿酒的营养代谢、应激应答、有性繁殖等多种重要的生物学过程[6⁃7]。在病原酵母白念珠菌的泛素功能研究中发现,多聚泛素Ubi4p对其细胞形态、生长周期、应激应答、营养代谢等多种重要的生物学过程,对白念株菌毒力发挥重要的调控作用[8]。
在新生隐球菌中,泛素系统的结构和功能尚无系统的研究报道。有学者比较了隐球菌在高渗条件、氧化应激以及抗真菌药物咯菌腈等环境中基因表达模式的变化,发现大量的泛素系统相关基因(其中含有多聚泛素UBI4)可能参与了细胞对环境应激的应答反应调控[9]。本课题组在前期研究中证实,去泛素化酶Ubp5p不仅调控新生隐球菌高温耐受、黑色素酶与荚膜等多种毒力因子的产生,而且参与隐球菌的应激应答反应、细胞周期、有性繁殖等多种重要的生物学过程。去泛素化酶的主要功能在于维持细胞内泛素水平的稳态,我们推测去泛素化酶Ubp5p可能与泛素前体蛋白 (尤其是多聚泛素Ubi4p)作用于同一通路以共同调节胞内的泛素水平的动态平衡。
由于前期工作多次尝试敲除新生隐球菌的多聚泛素编码基因UBI4,均未获得成功;本研究中意外获得其下调表达菌株,我们推测可能Histone启动子驱动的UBI4高表达或蛋白过度泛素化会造成隐球菌细胞出现未知的细胞损伤,为了避免这种损伤可能由某些信号分子反馈性抑制基因UBI4的转录表达,这种调控机制尚有待于进一步探索。与此同时,多聚泛素的表达下调使得隐球菌细胞对多种应激原(高温、H2O2和NO应激、胞壁损伤等)和抗真菌药物耐受力显著下降、生长速度下降,对蜡蛾感染毒力显著下降,这提示我们:多聚泛素直接参与对隐球菌细胞增殖、应激应答等生物学过程,并对其毒力发挥重要的调控作用。UBI4是新生隐球菌应激条件下的主要泛素编码基因,可通过有效生产多聚泛素前体蛋白以不断补充应激条件下的泛素消耗,而其功能机制与去泛素化酶的辅助功能密不可分,其内在的相关作用关系与分子机制尚有待于进一步探索。
大量的研究证明多种信号转导通路如丝裂原活化蛋白激酶途径 (MAPK)、高渗透压甘油途径(HOG)、钙离子/钙调磷酸酶 (Calcineurin)途径协同调节新生隐球菌的应激应答、有性繁殖以及毒力因子分泌[10⁃11]。而泛素系统已证实对这些信号转导通路具有重要的调节作用[12⁃13]。例如,泛素系统通过选择性降解酿酒酵母中高渗透压甘油途径上游的调控蛋白元件Ssk1的降解而下降HOG通路。深入研究泛素系统与多种通路之间复杂的相互作用关系及其对隐球菌毒力的功能影响,对于我们进一步解析隐球菌致病感染的分子生物学机制十分重要。

图1 a.扩增UBI 4基因片段;b.用引物UBI4⁃f和Nat Probe F做煮菌PCR验证pH3(p)::UBI 4⁃1/2;c.用引物UBI4nb⁃f和Nat Probe F验证H99H3(p)::UBI4,图示b和c均为阳性电泳条带(引物序列见表1);c.多聚泛素基因UBI 4在基因重建株中表达下调 图2 H99H3(p)::UBI4对各种应激应答反应敏感性增高。H99和H99H3(p)::UBI4菌株在30℃下液体YPD培养基中培养至饱和,连续稀释后取3 μL菌悬液滴在各种应激培养基上,晾干后放置30℃培养箱孵育3~5 d后拍照 图3 生长曲线与蜡蛾感染模型A&B。H99和H99H3(p)::UBI4菌株分别在30℃液体培养基中过夜培养后细胞计数定量,将定量后的菌悬液转到30 mL新鲜YPD液体培养基,每4 h测量一次OD值。30℃(a)and 37℃ (b)。H99H3(p)::UBI4在30℃即表现出生长缓慢,高温37℃加重了生长缺陷;c.蜡蛾模型体外毒力实验。H99H3(p)::UBI4感染的蜡蛾死亡率显著下降Fig.1 a.UBI 4 gene DNA fragment was amplified B&C Confirmation of positive transformants by diagnostic PCR;d.Expression of UBI 4 was down reg⁃ulated in H99H3(p)::UBI4 Fig.2 H99H3(p)::UBI4 is involved in various stress responses of C.neoformans Fig.3 Growth rate measurementsin the ubp5 mutant and in vivo virulence assay in G.mellonella
隐球菌对现有抗真菌药物的耐药性是当前困扰临床治疗的一个棘手问题。两性霉素B疗效确切,然而其极大的药物毒副作用对很多基础情况不佳的患者是个重大的考验;氟康唑可以透过血脑屏障进入中枢神经系统,是临床为数不多可用于隐球菌感染治疗的可选药物,然而其临床耐药株已然出现;而新型棘白球素类抗真菌药物却缺乏抗隐球菌感染的疗效。临床耐药性进一步增进了研发新的安全高效抗真菌药物的迫切需要。值得重视的是,泛素系统蛋白元件是当前抗肿瘤治疗的一个热点研究方向[14]。泛素系统对新生隐球菌生长繁殖、应激应答、致病感染具有多重调控作用,也为我们探索新的药物干预靶点提供了新的研究方向。
[1] Liu F,Walters KJ.Multitasking with ubiquitin through multiva⁃lent interactions[J].Trends Biochem Sci,2010,35(6):352⁃360.
[2] Spitzer ED,Spitzer SG.Structure of the ubiquitin⁃encoding genes of Cryptococcus neoformans[J].Gene,1995,161(1):113⁃117.
[3] Fang W,Price MS,Toffaletti DL,et al.Pleiotropic effects of deu⁃biquitinating cnzyme Ubp5 on growth and pathogenesis of Cryp⁃tococcus neoformans[J].PLoS One,2012,7(6):e38326.
[4] Petzold EW,Himmelreich U,Mylonakis E,et al.Characterization and regulation of the trehalose synthesis pathway and its impor⁃tance in the pathogenicity of Cryptococcus neoformans[J].Infect Immun,2006,74(10):5877⁃5887.
[5] Alexander BD,Byrne TC,Smith KL,et al.Comparative evaluation of Etest and sensititre yeastone panels against the Clinical and Laboratory Standards Institute M27⁃A2 reference broth microdi⁃lution method for testingCandidasusceptibility to seven antifun⁃gal agents[J].J Clin Microbiol,2007,45(3):698⁃706.
[6] Finley D,Ozkaynak E,Varshavsky A.The yeast polyubiquitin gene is essential for resistance to high temperatures,starvation,and other stresses[J].Cell,1987,48(6):1035⁃1046.
[7] Cheng L,Watt R,Piper PW.Polyubiquitin gene expression con⁃tributes to oxidative stress resistance in respiratory yeast(Sac⁃charomyces cerevisiae)[J].Mol Gen Genet,1994,243(3):358⁃362.
[8] Leach MD,Stead DA,Argo E,et al.Molecular and proteomic an⁃alyses highlight the importance of ubiquitination for the stress re⁃sistance,metabolic adaptation,morphogenetic regulation and vir⁃ulence of Candida albicans[J].Mol Microbiol,2011,79(6):1574⁃1593.
[9] Ko YJ,Yu YM,Kim GB,et al.Remodeling of global transcription patterns of Cryptococcus neoformans genes mediated by the stress⁃activated HOG signaling pathways[J].Eukaryot Cell,2009,8(8):1197⁃1217.
[10] Kozubowski L,Lee SC,Heitman J.Signalling pathways in the pathogenesis of Cryptococcus[J].Cell Microbiol,2009,11(3):370⁃380.
[11] Bahn YS.Master and commander in fungal pathogens:the two⁃component system and the HOG signaling pathway[J].Eukaryot Cell,2008,7(12):2017⁃2036.
[12] Kishi T,Ikeda A,Nagao R,et al.The SCFCdc4 ubiquitin ligase regulates calcineurin signaling through degradation of phospho⁃rylated Rcn1,an inhibitor of calcineurin[J].Proc Natl Acad Sci U S A,2007,104(44):17418⁃17423.
[13] Cappell SD,Baker R,Skowyra D,et al.Systematic analysis of es⁃sential genes reveals important regulators of G protein signaling[J].Mol Cell,2010,38(5):746⁃757.
[14] Nicholson B,Marblestone JG,Butt TR,et al.Deubiquitinating enzymes as novel anticancer targets[J].Future Oncol,2007,3(2):191⁃199.
Effects of polyubiquitin UBI4 downregulation on growth and pathogenesis of Cryptococcus neoformans
MENG Yun⁃fang1,ZHOU Zhao⁃jing1,YANG Ya⁃li1,ZHAO Jing⁃yu1,2,ZHANG Chao1,FA Zhen⁃zong1,SANG Jun⁃jun1,FANG Wei1,LIAO Wan⁃qing1
(1.Shanghai Key Laboratory of Molecular Medical Mycology and PLA Key Laboratory of Fungal Diseases,Department of Dermatology,Changzheng Hospital,Second Military Medical University,Shanghai 200003,China;2.Shanghai Dermatology Hospital,Shanghai 200003,China)
Objective To construct Cryptococcus neoformans strain with downregulated UBI4 expression and examine the effects of UBI4 downregulation on growth and pathogenesis of C.neoformans.Methods UBI4 DNA fragment was amplified and infused into linear plasmid pCH20 containing histone promoter.The fused plasmid was then transformed intoC.neoformansthrough gene gun.The positive transformants were screened by diagnostic PCR and DNA sequencing.Various phenotype of C.neoformans reconstituted strain H99His⁃UBI4were examined.Results Cryptococcus neoformans strain with low expression of UBI4 were constructed and phenotypic as⁃says demonstrated that down⁃regulated UBI4 lead to slower growth rate and enhanced susceptibility to various stresses such as H2O2,NO and antifungal agents in C.neoformans.Moreover,C.neoformans with down⁃regulated UBI4 was also attenuated dramatically in wax moth infection model.Conclusion Our study suggested that polyubiquitin UBI4 played a critical role in cell proliferation,stress re⁃sponse and pathogenesis in C.neoformans.Our work laid a foundation for following studies about functions and mechanisms of ubiquit⁃in system.
Cryptococcus neoformans;polyubiquitin;pathogenesis;stress response
R 379.5
A
1673⁃3827(2015)10⁃0016⁃06
2015⁃01⁃04
[本文编辑] 卫凤莲
国家973项目 (2013CB531601);上海市自然科学基金(12ZR1454400,12JC1411000);上海市医学真菌分子生物学实验室基金(14DZ2272900)
孟云芳,女(汉族),博士研究生在读.E⁃mail:mengyun⁃fang6.12@163.com;周兆婧,女(汉族),硕士研究生在读.E⁃mail:zhouzhaojing320@163.com
廖万清,E⁃mail:Liaowanqing@sohu.com;方伟,E⁃mail:we⁃ifang081782@163.com

