创新药物临床试验不良事件赔付机制调查研究
■ 孙 磊林 晶尹 鹏李月明
创新药物临床试验不良事件赔付机制调查研究
■ 孙 磊①林 晶②尹 鹏①李月明①
药物临床试验 伤害赔付
目前我国创新药物临床试验中针对出现的不良事件没有可以遵循的相关法律法规,尚未形成统一的赔付标准。本研究选取国家科技重大专项“创新药物临床评价技术平台”课题中标单位为调研对象,探讨建立创新药物临床不良事件赔付机制和实现赔付机制的途径、方式和方法。
Author’s address:Center for Project Supervisor and Management, National Health and Family Planning Commission, No.1, Xizhimenwai South Road, Xicheng District, Beijing, 100044, PRC
本研究通过分析目前临床试验不良事件赔付方式,找出目前临床试验中不良事件赔付资金来源,赔付方式存在的缺陷和问题,提出建设性意见,为进一步规范创新药物临床试验的相关措施和政策提供参考,并为国家出台相关法律法规提供科学依据。
1 研究方法
本研究选取国家科技重大专项“创新药物临床评价技术平台”课题中标单位为样本,通过德尔菲法、问卷调查法、座谈、访谈等方式获取各中标单位临床试验药物基地近3年临床试验相关数据,结合文献研究及现场调查的结果,确定目前临床试验不良事件赔付现状和存在的问题,探讨创新药物临床试验不良事件的赔付方法和标准。
2 临床试验及不良事件发生概况
2.1 被调查机构临床试验内容和经费来源
从被调查的12家机构情况看,试验机构主要研究的药物种类集中分布在循环系统、呼吸系统、消化系统、抗肿瘤药及中枢神经系统类用药。
从试验药物项目经费来源看,我国药物研发的经费基本来源于药品企业,中央和地方财政投入极少,尚未有其它方面的资金投入。一方面说明我国药物研发主要还是企业行为,从相关的资料了解到我国的药物研发主要是仿制药,表明我国的研发水平相对较低;另一方面说明我国政府在创新药物的引导、投入方面的力度不够;药物研发资金筹集渠道单一,抗风险能力较差,不利于整个创新药物研发水平的提高。
2.2 创新药物临床试验不良事件发生
按照创新药物临床试验不良事件的程度,将创新药物临床试验不良事件分为严重不良事件和不良事件。从被调查的12家试验机构所承担的试验项目来看,不良事件和严重不良事件均有所发生,且发生不良和严重不良事件例数均超出被访专家认为的合理范围。
3 临床试验及不良事件赔付调查
3.1 创新药物不良事件赔付资金来源、渠道以及筹集方式
在对12家药物临床试验机构发生不良事件赔付责任现状调查中,目前所有机构出现的不良事件都由申办方承担;有8家(其中有3家机构在调查中引入了商业保险)机构负责人认为应引入商业保险,见图1。
3.2 创新药物不良事件赔付资金来源、渠道以及筹集方式
为了降低申办方开发创新药物的风险,各专家认为应采取多渠道筹集赔付资金。从统计的结果看,几乎所有机构被调查者认为建立药物临床试验责任险可行且必要;其次,建立药物临床试验风险基金占7人;另外,有小部分认为可以从项目提取一部分坏账准备金或由政府设立药物临床试验救济补偿金,见图2。
3.3 创新药物不良事件赔付方式、赔付标准
3.3.1 赔付方式选择。由于药物临床试验不良事件具有不可预见性,为了降
低药物研发的风险,采取多种措施保证药物临床试验顺利进行,12家药物临床试验机构负责人中有11人认为应建立不良事件应急反应机制;有10人认为应设立药物临床试验责任险;有9人认为应制定不良事件赔付标准;各有8人认为应成立不良事件鉴定机构和制定不良事件损害分级标准;还有3人认为应建立国家药物临床试验不良事件补偿救济制度。
3.3.2 药物临床试验不良事件赔付标准从调研中发现,被调查者认为应补偿因生命、身体及健康导致财产损失、精神伤害,因此其范围应包括医药费、残障生活补助、抚养金、丧葬费等多个方面。但具体补偿项目应根据不同药物临床试验特点,结合国家有关法规制度,明确赔付的标准和赔付的内容,做到有法可依。
3.3.3 创新药物不良事件赔付资金的使用管理和监督。与12家机构负责人的访谈中,针对药物临床试验赔付资金的使用管理和监督。各位专家一致认为应成立专门的组织加强对资金的分配和管理。一方面,制定赔付资金的使用和拨付程序,严格按照操作程序根据制定的赔付标准实施划拨。另一方面,加强对资金的管理和监督,保障资金使用的安全性和有效性,保证创新药物临床试验顺利进行。
4 讨论与建议
4.1 完善相关法律法规,积极引导建立药物临床试验责任险
我国目前创新药物研发引入保险的项目比较少,一方面是国家缺少相关的法律法规;另一方面是申办企业自身没有投保意识,这是因为投保将增加企业的额外投入;且由于开设这个险种的保险公司极少,保险公司基于自身的利益不会主动设立此险种。因此,政府应充分调研,从法律制度方面引入切实的机制促进药物临床试验责任险的发展;申办企业也应该从维护受试者的权益出发积极投保;保险公司可根据相关数据设立药物临床试验责任险。经过一段时间,逐渐将药物临床试验责任险作为创新药物研发应对不良事件赔付的重要手段。鉴于目前我国药物研发的现状,本研究建议建立以基金救济和保险相结合的制度作为药物临床试验不良事件的赔付制度。在前期药物临床试验责任险还没有完全形成时以基金救济为主,作为主要的赔付手段,同时鼓励并以法律的形式要求企业在进行药物研发时要对药品进行投保;并逐渐形成以药物临床试验责任险为主的商业保险模式,同时以基金救济为辅的赔付模式。
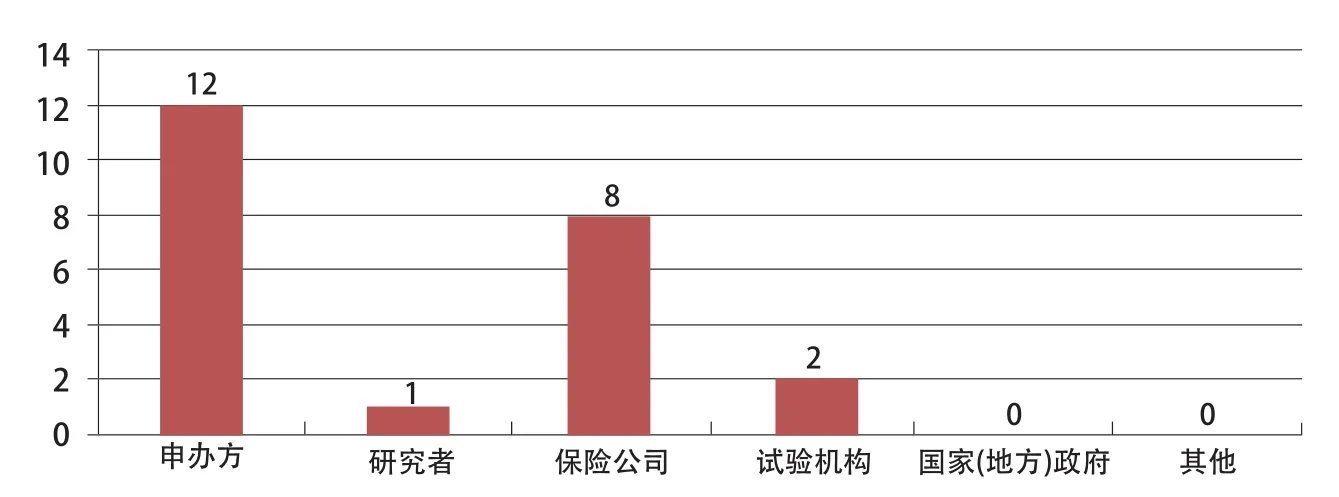
图1 创新药物临床试验不良事件承担责任分析
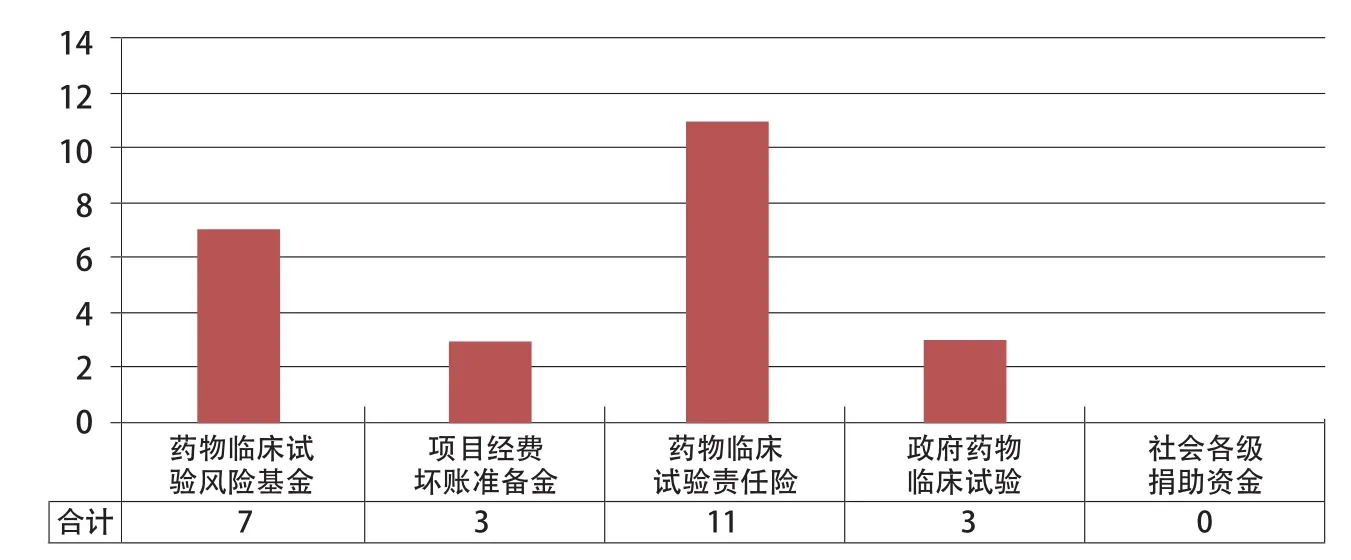
图2 创新药物临床试验不良事件赔付渠道分析
4.2 完善临床试验不良事件认定程序和赔付标准,做到有法可依
目前出现了药物不良事件后没有相关的法律权威机构进行伤残的鉴定,造成受试者得不到及时的救助,严重影响了受试者的身心健康,不利于药物的研发的情况。因此,应组成鉴定专家库,对出现的不良事件进行审定裁决,将其结果作为双方认定赔付的依据。同时,由于我国还没有一个关于药物临床试验不良事件赔付的标准,这是受试者受到伤害后没有得到一个合理补偿的重要原因。本研究建议根据受试者受到侵害的伤残情况制定不同的赔付标准,主要从医疗、经济、伤残等级进行赔付,见表1。
4.3 赔付资金由政府、企业和社会共同筹集和承担
根据我国整体药物研发实力较弱的现状,应多渠道筹集资金建立药物临床试验风险基金。由于企业是药品研发、生产、销售、获利的主体,应以企业为主建立药物临床试验不良事件风险基金,基金来源于企业前一年度销售金额按比例提取的资金。同时从创新药物临床试验项目预算中提取一定比例作为药物临床试验不良事件坏账准备金。
从政府角度应加大投入,设立财政专项资金作为发生药物临床试验时应对发生的不良事件的救助资金。
从社会角度,创新药物研发的顺利实施对整个社会具有极大的社会效益,但目前我国除了企业,其它群体对于创新药物研发的主动性不是很强,因此本研究建议政府应积极宣传,促进社会积极参与创新药物的研发,通过社会集资捐助,募集药物临床试验不良事件救助资金。

表1 药物临床试验不良事件赔付标准
[1] 盛红彬,黄登笑,陆逸雁,等.建立我国ADR补偿救济制度的探讨与思考[J].医学与哲学(人文社会医学版),2009,30(8):50-51.
[2] 梁伟雄.药物临床试验中受试者损害补偿问题探讨[J].中国临床药理学与治疗学,2006,10(10):1198-1200.
[3] 李见明,孙振球,高荣,等.我国药物临床试验的现状与发展方向[J].中国临床药理学杂志, 2013,29(6):473.
[4] June P,Altman DG,Egger M.Systematic reviews in health care: Assessing the quality of controlled clinical trials[J]. Bio Med J,2001,323 (7303):42.
[5] Prady SL, Richmond SJ, Morton VM, et al. A systematic evaluation of the impact of STRICTA and CONSORT recommendations on quality of reporting for acupuncture trials[J].Aplos One,2008,3(2):1577.
Investigation and analysis on the innovation drug adverse event relief system /
SUN Lei, LIN Jing, YIN Peng,LI Yueming// Chinese Hospitals. -2015,19(6):13-15
drug clinical trail, damage and compensation
Because lack of the law and unified compensation standards about compensation of innovation drug adverse event in China, the sufferers cannot get any compensation from the correlative responsibility party. By choosing the ‘Significant Innovation Drugs Creation’ bid units , this research carry out survey to find out and discuss the optimization approach to establish innovation drug adverse event compensation system.
李月明:国家卫生计生委项目资金监管服务中心处长、高级经济师
2015-04-10](责任编辑 郝秀兰)
国家科技重大专项创新药物临床评价技术平台(2008ZX09312-008)
①国家卫生计生委项目资金监管服务中心 100044 北京市西城区西直门外南路1号
②首都医科大学附属北京天坛医院,100050 北京市东城区天坛西里6号
E-mail:li2939@163.com

