诺氟沙星和四环素对铜绿微囊藻的毒性研究
官奕宏,李红卫,吕 谋
(青岛理工大学环境与市政工程学院,山东青岛 266033)
近几年,抗生素的用量越来越大,全世界每年抗生素的使用量在10万吨~20万吨,大部分抗生素具有水溶性,人类和动物服用的抗生素有40%~90% 将随尿液排出体外[1]。抗生素滥用所造成的环境污染问题在国内外已经引起高度重视,尤其是在欧美一些发达国家。目前很多国家在污水、地表水甚至地下水中检测到磺胺、喹诺酮和大环内酯类等抗生素的存在[2~4]。诺氟沙星和四环素分别作为喹诺酮类和四环素类抗生素的代表,在水中的检出的频率都很高[5,6]。
藻类是水生态系统的初级生产者,可以作为监测评价水环境质量和污染物生态毒性的重要指示生物[7],外源污染物对藻类的毒性作用将直接影响水生食物链的能量传递,进而对高营养级生物和整个水生态系统产生影响。铜绿微囊藻是水华蓝藻的常见藻类,是藻类爆发时的优势种群[8],可以作为水生态系统初级生产者的代表,因此研究抗生素对铜绿微囊藻的毒性,可以反应两种抗生素对于水生态系统的影响,对于评价抗生素在水环境中的生态风险具有重要意义。
本文利用叶绿素荧光技术 (PAM),通过检测铜绿微囊藻的生物量、叶绿素-a含量、光合作用参数、活性氧 (ROS)和丙二醛 (MDA)等指标的变化,研究了两种抗生素对铜绿微囊藻的毒性,揭示了两种抗生素对铜绿微囊藻的作用机制,为准确评估不同抗生素的水环境生态风险提供了理论依据。
1 材料与方法
1.1 试验材料
铜绿微囊藻藻种 (FACHB)购于武汉水生生物研究所,采用BG-11培养基进行培养,培养基中的化学组分均为分析纯。试验中使用的诺氟沙星和四环素均购于美国Aladdin公司。
1.2 试验方法
铜绿微囊藻的培养方法如下:批量式培养在光照培养箱 (上海精科,250 L)中,培养箱温度设置为25℃ ±1℃,光照强度为3000~4000 Lux,采用12h∶12h的光照/黑夜循环模式。试验时,取对数期的藻细胞置于250 mL锥形瓶中,用BG-11培养基稀释至所需藻密度,在预实验的基础上每种抗生素设置5个浓度梯度,诺氟沙星和四环素的浓度梯度分别为 0.2mg/L,0.5mg/L,1.0mg/L,2.0mg/L,5.0mg/L 和 0.2mg/L,1.0mg/L,5.0mg/L,10.0mg/L,15.0 mg/L,同时设置空白对照组,将铜绿微囊藻置于原培养条件下暴露培养,每隔24 h检测不同浓度抗生素作用下铜绿微囊藻细胞的OD680,叶绿素光,光合量子产率,ROS和MDA,检测至96 h,48 h时检测不同样品的SEM照片。
抗生素储备液配制:由于诺氟沙星水溶性较差,在酸性或碱性时易溶,所以诺氟沙星配制过程中加入少量的NaOH,最后再用1.0 mol/L HCl调节pH至7.0;四环素的盐酸盐能溶于水,实验中利用无水乙醇可以加快溶解速度,放置在摇床震荡1~2 h,4℃下储存备用。
1.3 检测指标
藻细胞生物量:本试验采用吸光度法和流式细胞仪法结合的方法定量铜绿微囊藻细胞数。流式细胞仪可以很准确的确定细胞个数,本文建立了一条OD680和细胞数的相关曲线 Y=0.055X-0.005,如图1所示,二者的相关性很好,R2达到0.999,后续试验都可以根据该曲线来表征细胞个数。
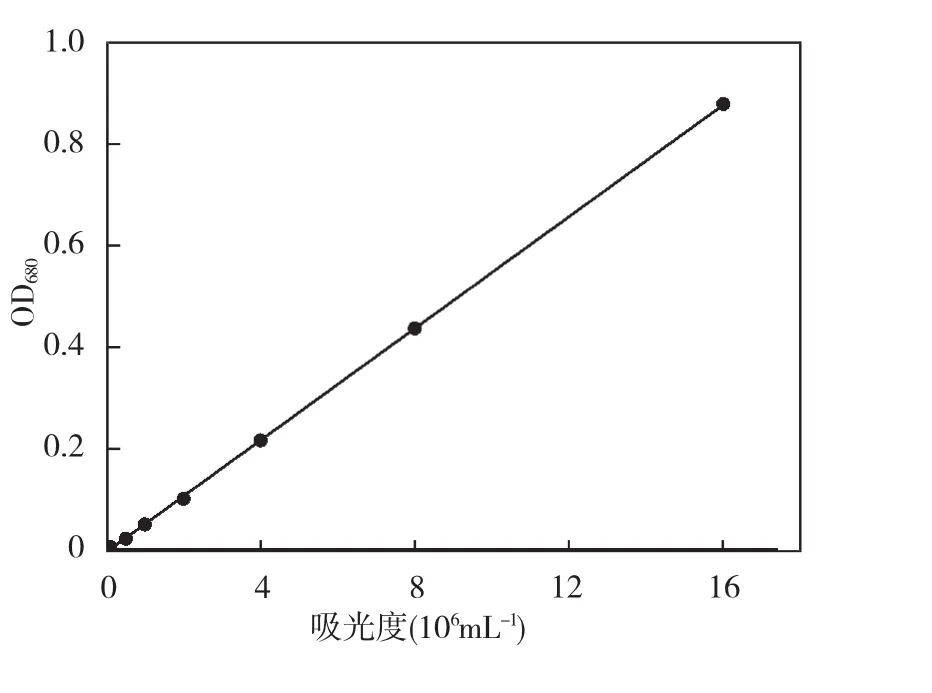
图1 吸光度与细胞密度的相关曲线Fig.1 Relation curve between absorbance in 680 nm and cell density
叶绿素和光合作用参数:
藻的叶绿素和光合活性参数采用Phyto-PAM(Walz,德国)测定,取不同剂量抗生素作用的样品4 mL,置于PAM用的检测管中。
光合量子产率Y值通过式 (1)计算得到:
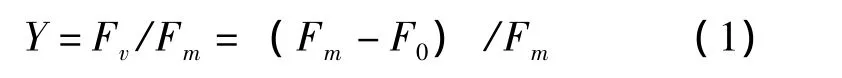
式中:
Fm——在暗适应状态下,PSII系统在打开饱和脉冲后产生的最大荧光值;
F0——在暗适应状态下,PSII系统在打开饱和脉冲前产生的荧光值。
快速光响应曲线 (PLC)的测定条件设定为:步长 20 s,最大光照强度 1564 μmol/(m2·s)。通过快速光响应曲线的测定可得到相应光能利用率α的值,藻细胞内的叶绿素-a含量也可以通过荧光性能检测,Phyto-PAM可以直接得到藻细胞叶绿素-a 的含量[9]。
活性氧 (ROS)的检测:将培养48h后的藻细胞样品收集,取1 mL藻液在2000 r/min条件下离心,将细胞收集,用磷酸缓冲溶液洗两遍,黑暗条件下,在10 μM的荧光探针H2DCF-DA中培养30 min,离心后用磷酸缓冲液冲洗2遍,用酶标仪(SynergyTM4)检测细胞内部DCF的荧光强度,即可表示细胞内部ROS含量[10],ROS相对含量计算公式如下:

丙二醛 (MDA)的检测:取在不同条件下培养48 h的藻液50mL,在4000 r/min的条件下离心,去掉上清液,将分离的藻细胞加入石英砂充分研磨,之后加入磷酸缓冲液充分搅拌,离心得到上清液即为酶液。取0.6克TBA(硫代巴比妥酸),先用少量1M NaOH溶解,用10%TCA(三氯乙酸)定容至100 mL。1 mL酶液 +2 mL0.6%的TBA,封口沸水浴15 min,迅速冷却后再离心,取上清液,在600、532、450 nm三个波长下测定吸光度[11],计算公式如下:

1.4 数据处理与统计
每种试验处理都设置3组平行样品,结果以均值加标准偏差表示。每种处理后的样品都与空白组进行对照,数据置信度在P<0.05,用 origin数据处理软件作图处理。
2 结果与讨论
2.1 两种抗生素对铜绿微囊藻生长曲线的影响
诺氟沙星和四环素对铜绿微囊藻生长曲线影响如图2所示。从图2A中可以看出,诺氟沙星浓度低于0.5 mg/L时对铜绿微囊藻的生长抑制作用不强,在0.2 mg/L时促进了藻细胞的生长;诺氟沙星浓度达到1.0 mg/L时,对铜绿微囊藻生长有明显的抑制,超过2.0 mg/L时,培养1天后铜绿微囊藻停止生长。由图2B可知,随浓度增加,四环素对铜绿微囊藻的抑制作用越来越明显,当四环素浓度超过5.0 mg/L时,培养1天后藻细胞停止生长。诺氟沙星和四环素对铜绿藻的抑制作用都有明显的浓度-效应关系,二者对铜绿微囊藻96 h的EC50分别为0.85 mg/L 和 2.64 mg/L,这说明诺氟沙星对铜绿微囊藻的抑制作用比四环素更强。
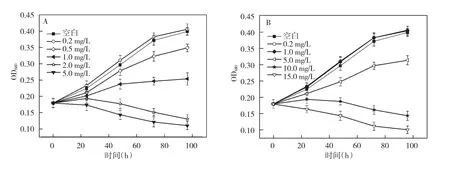
图2 不同剂量抗生素对铜绿微囊藻生长曲线影响(A为诺氟沙星处理组,B为四环素处理组)Fig.2 Effects of different dosage of antibiotic on the growth curve of Microcystis aeruginosa(A.Norfloxacin,B.Tetracycline)
2.2 两种抗生素作用前后铜绿微囊藻的扫描电子显微镜 (SEM)照片
图3所示为铜绿微囊藻在不同抗生素作用后的SEM照片。图3A为正常铜绿微囊藻细胞,细胞表面光滑,呈规则球状。图3B和图3C分别为诺氟沙星和四环素作用后的铜绿微囊藻细胞,藻细胞发生明显变形,表面凹陷,表面分泌物明显减少,这说明诺氟沙星和四环素能够破坏藻细胞的生理机能,改变细胞内外渗透压,导致藻细胞死亡。另外,诺氟沙星作用后的藻细胞变形要比四环素的明显,这说明诺氟沙星对铜绿微囊藻的毒性强过四环素。
2.3 两种抗生素对铜绿微囊藻叶绿素-a含量的影响
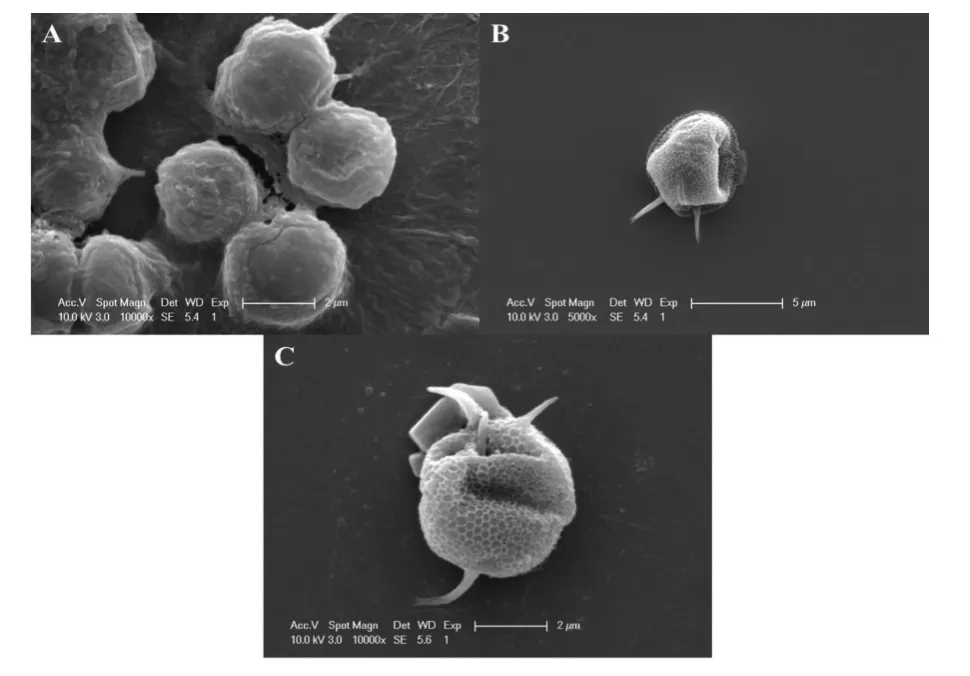
图3 铜绿微囊藻的SEM照片A为空白组,B为诺氟沙星处理组,C为四环素处理组Fig.3 The SEM images of Microcystis aeruginosa.A.black ontrol,B.treated by Norfloxacin,C.treated by Tetracycline.
叶绿素-a是植物进行光合作用的重要物质,在光能的吸收、传递和转换过程中起着关键作用。叶绿素-a含量可以间接反映细胞的活性和光合作用能力,图4为两种抗生素作用96 h后对铜绿微囊藻叶绿素-a含量的影响。从图中可知,低浓度时,两种抗生素都可以刺激铜绿微囊藻叶绿素-a的合成,随着两种抗生素浓度的升高叶绿素-a含量呈现下降的趋势,10 mg/L的诺氟沙星作用96 h后,藻液几乎变为透明,叶绿素下降的原因可能是叶绿体的流失或破坏[12]。在相同剂量时,诺氟沙星作用后的藻细胞叶绿素-a含量更低,说明诺氟沙星比四环素对铜绿微囊藻光合作用的影响更严重。
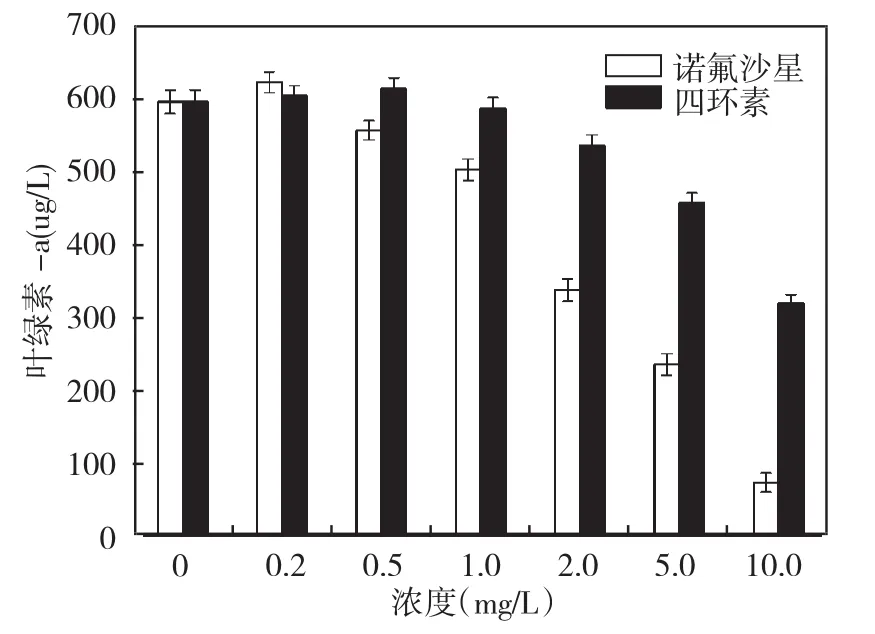
图4 铜绿微囊藻叶绿素-a含量变化ig.4 The changes of chlorophyll-a in Microcystis aeruginosa
2.4 两种抗生素对铜绿微囊藻光合作用的影响
光合量子产率Y值表示PSII原初光能转换效率,Y值变化能够直接显示光合作用强弱。α值为光能利用率,它的值为快速光响应曲线的初始斜率,能够表示藻细胞光合作用中光能的利用效率。图5为不同剂量抗生素作用96 h后铜绿微囊藻Y值得变化,从图中可以看出诺氟沙星低于0.5 mg/L时Y值变化很小,超过0.5 mg/L时,随着诺氟沙星浓度增大Y值逐渐降低,最后变为0。四环素对铜绿微囊藻Y值得影响规律与诺氟沙星类似,但同剂量条件下,诺氟沙星作用的藻细胞Y值更低,说明诺氟沙星对藻细胞光合作用过程破坏程度比四环素更大。
图6为两种抗生素对铜绿微囊藻α值的影响,由图可知,诺氟沙星低于0.5 mg/L时对α值没有明显影响,四环素在达到1.0 mg/L前对α值影响很小,随两种抗生素浓度增加,铜绿微囊藻的α值降低,二者都表现出显著的浓度-效应关系。这说明诺氟沙星和四环素都明显的阻碍了铜绿微囊藻对光能的利用,且诺氟沙星的阻碍作用更明显,由于光能的利用率降低导致藻细胞活性减弱。由Y值和α值得变化可知,破坏光合系统是诺氟沙星和四环素对铜绿微囊藻重要的致毒机理。
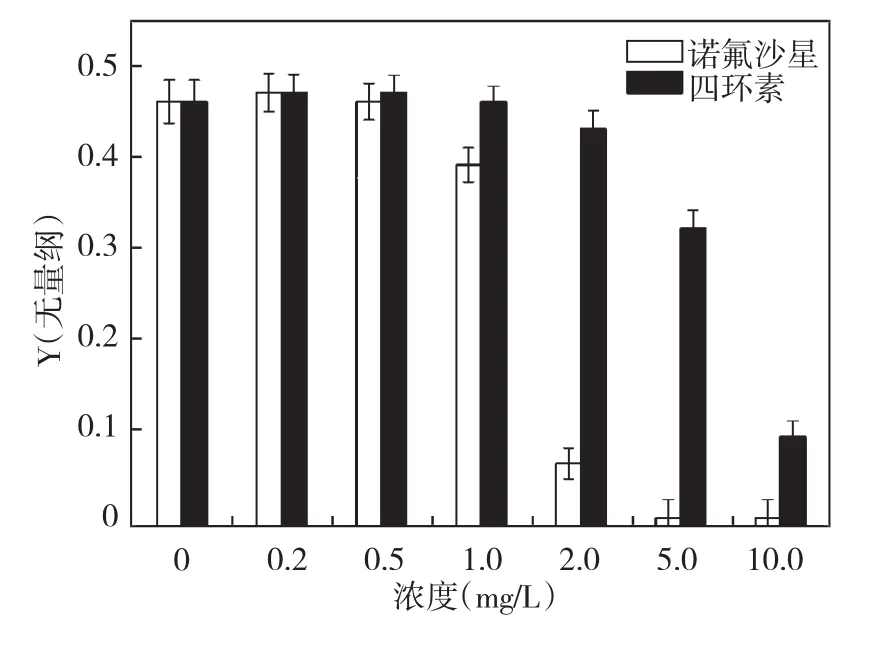
图5 铜绿微囊藻光合量子产率Y值得变化Fig.5 The changes of photosynthetic quantum yield in Microcystis aeruginosa
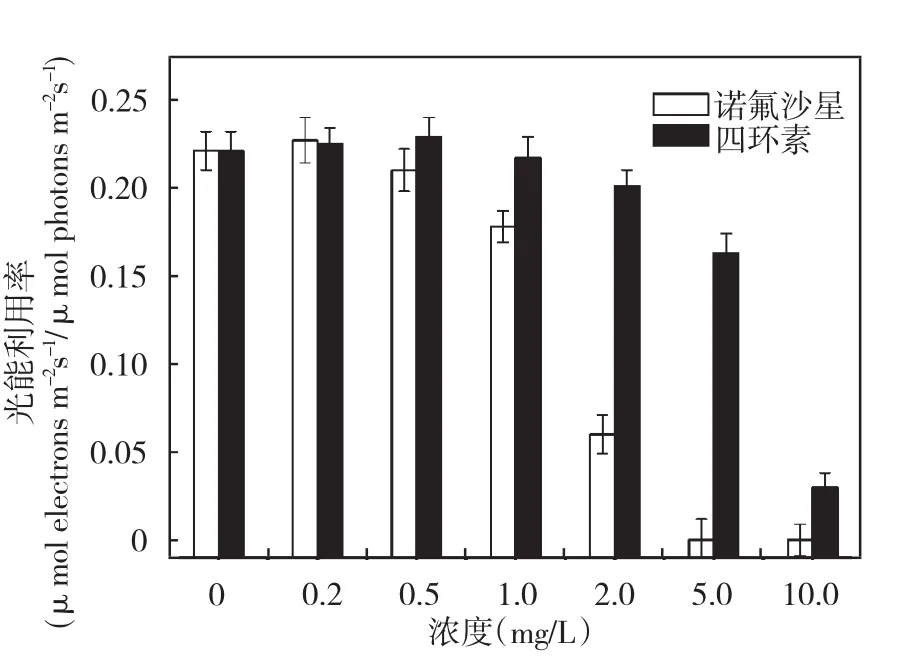
图6 铜绿微囊藻光能利用率α值的变化Fig.6 The changes of efficiency for solar energy utilization α in Microcystis aeruginosa
2.5 两种抗生素在铜绿微囊藻内部产生的氧化胁迫
活性氧 (ROS)是生物有氧代谢过程中的一种副产品,当细胞受到外部刺激时,ROS含量会急剧增多[13],过高的 ROS水平会使细胞及其基因结构受到严重的损坏。图7为两种抗生素作用48 h后铜绿微囊藻内部ROS含量变化,由图可知诺氟沙星在较低浓度就可引起ROS明显增加,且与投加剂量成正相关;诺氟沙星浓度超过5.0 mg/L,藻细胞内ROS含量出现降低,这是因为藻细胞大量死亡后内部的ROS会释放出来,因此出现下降[14]。四环素浓度低于 1.0 mg/L,藻细胞内部ROS并无明显增加,随四环素浓度继续升高,ROS含量出现快速上升,10mg/L的四环素作用后,ROS相对含量达到300%,但同剂量条件下,诺氟沙星对铜绿微囊藻产生的氧化胁迫明显强于四环素。
高浓度的诺氟沙星和四环素都能诱导藻细胞内ROS的大量产生,而逐渐增加的抗氧化酶活性并不足以清除细胞内的 ROS和阻止光致氧化作用,造成其过度积累,诱导对生物大分子 (如蛋白质,DNA,细胞膜脂)的氧化损伤,引起细胞代谢紊乱,使得藻细胞膜系统和功能异常或受到损伤,严重时导致细胞死亡[15]。因此,氧化胁迫是诺氟沙星和四环素致死铜绿微囊藻的重要机理。

图7 铜绿微囊藻ROS相对含量的变化Fig.7 The changes of ROS relative content in Microcystis aeruginosa
2.6 两种抗生素对铜绿微囊藻细胞膜的破坏
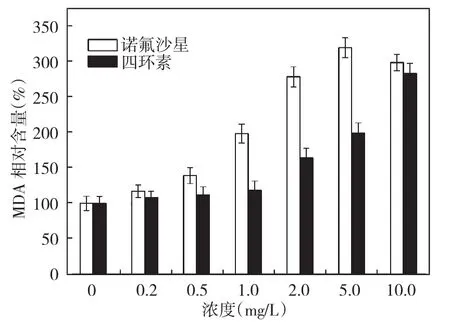
图8 铜绿微囊藻MDA相对含量的变化Fig.8 The changes of MDA relative content in Microcystis aeruginosa
丙二醛 (MDA)是细胞膜脂质过氧化的产物,其含量可以反映活性氧自由基对细胞膜结构的损伤程度[16],其含量的大量增加也说明藻细胞的抗氧化系统处于一个不平衡的状态。图8为两种抗生素作用48 h后藻细胞内部MDA含量的变化,两种抗生素在高浓度时都会引起铜绿微囊藻内部MDA的急剧升高,在同剂量时,诺氟沙星处理组的MDA含量明显高于四环素,说明诺氟沙星对铜绿微囊藻细胞膜的损伤明显强于四环素。试验结果从侧面证明,诺氟沙星和四环素都能在藻细胞内部诱导产生大量活性氧,从而使细胞膜结构受损,最终导致藻细胞死亡。
3 结论
3.1 诺氟沙星和四环素在低浓度时都可以促进铜绿微囊藻生长,高浓度时二者对铜绿微囊藻表现出明显的抑制作用,且诺氟沙星抑制能力明显强于四环素;诺氟沙星和四环素对铜绿微囊藻96 h EC50分别为0.85 mg/L 和2.64 mg/L。
3.2 诺氟沙星和四环素在高浓度时对铜绿微囊藻光合作用有显著的破坏,叶绿素-a浓度、Y值和α值变化都表现出明显的浓度-效应关系,光合系统的破坏是诺氟沙星和四环素致死铜绿微囊藻的重要机理之一。
3.3 诺氟沙星和四环素在高浓度时会在藻细胞内部诱导产生大量活性氧,氧化藻细胞膜,引起MDA浓度明显升高,且同剂量诺氟沙星产生的氧化胁迫明显强于四环素,因此氧化胁迫是两种抗生素破坏藻细胞的重要途径。
[1] Kemper N.Veterinary antibiotics in the aquatic and terrestrial environment[J].Ecological Indicators,2008,8(1):1-13.
[2] Hoa P T P,Managaki S,Nakada N,et al.Antibiotic contamination and occurrence of antibiotic-resistant bacteria in aquatic environments of northern Vietnam[J].The Science of the total environment,2011,409(15):2894-2901.
[3] Vione D,Feitosa-Felizzola J,Minero C,et al.Phototransformation of selected human-used macrolides in surface water:Kinetics,model predictions and degradation pathways[J].Water Research,2009,43(7):1959-1967.
[4] Xu W,Zhang G,Li X,et al.Occurrence and elimination of antibiotics at four sewage treatment plants in the Pearl River Delta(PRD),South China[J].Water Research,2007,41(19):4526-4534.
[5] 聂湘平,何秀婷,杨永涛,等.珠江三角洲养殖水体中喹诺酮类药物残留分析[J].环境科学,2009,30(1):266-270.
[6] 徐冬梅,王艳花,饶佳维.四环素类抗生素对淡水绿藻的毒性作用[J].环境科学,2013,34(9):3386-3390.
[7] Wen Y,Yuan Y,Chen H,et al.Effect of Chitosan on the Enan-tioselective Bioavailability of the Herbicide Dichlorprop to Chlorella pyrenoidosa[J].Environmental Science & Technology,2010,44(13):4981-4987.
[8] 杨弯弯,武氏秋贤,吴亦潇,等.恩诺沙星和硫氰酸红霉素对铜绿微囊藻的毒性研究[J].中国环境科学,2013,33(10):1829-1834.
[9] Ou H,Gao N Y,Deng Y,et al.Immediate and long-term impacts of UV-C irradiation on photosynthetic capacity,survival and microcystin-LR release risk of Microcystis aeruginosa [J].Water Research,2012,46(4):1241-1250.
[10] Lin D,Ji J,Long Z,et al.The influence of dissolved and surface-bound humic acid on the toxicity of TiO2nanoparticles to Chlorella sp[J].Water Research,2012,46(14):4477-4487.
[11] Kong Q,Zhu L,Shen X The toxicity of naphthalene to marine Chlorella vulgaris under different nutrient conditions[J].Journal of Hazardous Materials,2010,178(1-3):282-286.
[12] 高 建,孙明珠,王擎运.铜离子对湛江等鞭金藻生长的影响[J].海洋水产研究,2007,28(4):54-58.
[13] Long Z,Ji J,Yang K,et al.Systematic and Quantitative Investigation of the Mechanism of Carbon Nanotubes′Toxicity toward Algae[J].Environmental Science& Technology,2012,46(15):8458-8466.
[14] Tang Y,Li S,Qiao J,et al.Synergistic Effects of Nano-Sized Titanium Dioxide and Zinc on the Photosynthetic Capacity and Survival of Anabaena sp[J].International Journal of Molecular Sciences,2013,14(7):14395-14407.
[15] Wang Z,Li J,Zhao J,et al.Toxicity and Internalization of CuO Nanoparticles to Prokaryotic Alga Microcystis aeruginosa as Affected by Dissolved Organic Matter[J].Environmental Science& Technology,2011,45(14):6032-6040.
[16] Wen Y,Chen H,Shen C,et al.Enantioselectivity Tuning of Chiral Herbicide Dichlorprop by Copper:Roles of Reactive Oxygen Species[J].Environmental Science & Technology,2011,45(11):4778-4784.

