PTDM共聚物的合成及其接枝生丝纤维的抗菌性能研究
陈 军,左华江,李和平,李思学,杨福全
(1.桂林理工大学化学与生物工程学院,广西桂林 541004;2.广西科技大学化学与生物工程学院,广西柳州 545006)
随着消费者对健康卫生衣着的需求与日俱增,织物的抗菌应用成为织物市场发展最快的方向之一,如何进行织物的抗菌改性从而杀灭或抑制有害微生物在织物上生长的研究也日渐增加。蚕丝作为高级纺织材料,穿着柔软舒适,兼有养生健体功能,但其结构多孔疏松,在加工成织品的过程中,纤维经多重叠加后会形成无数空隙的多层体,易吸附菌类,且其天然蛋白质组成还利于有害微生物滋生繁殖。为了使生丝具备卫生自洁功能,抑制有害微生物在其表面滋生繁殖,本研究考虑使用偶联接枝法在脱胶生丝表面接入季胺盐类抗菌聚合物PTDM。季胺盐类抗菌聚合物被广泛认为具有良好且持久的抗菌性能,穿透微生物细胞膜能力强,稳定性好,对皮肤刺激小,残余毒性低等优点。抗菌聚合物PTDM由马来酸酐、甲基丙烯酸二甲基氨基乙酯、甲基丙烯酸叔丁基氨基乙酯通过自由基聚合物法合成而得,其中马来酸酐与脱胶生丝表面含氧官能团反应,将三元共聚物PTDM牢固接枝在脱胶生丝表面,制备出具有高效安全的抗菌生丝。该抗菌生丝对大肠杆菌有良好的抑菌杀菌能力,是高效低毒、对环境友好的抗菌材料。
1 实验药品及仪器
表1示出了实验药品及生产厂家。
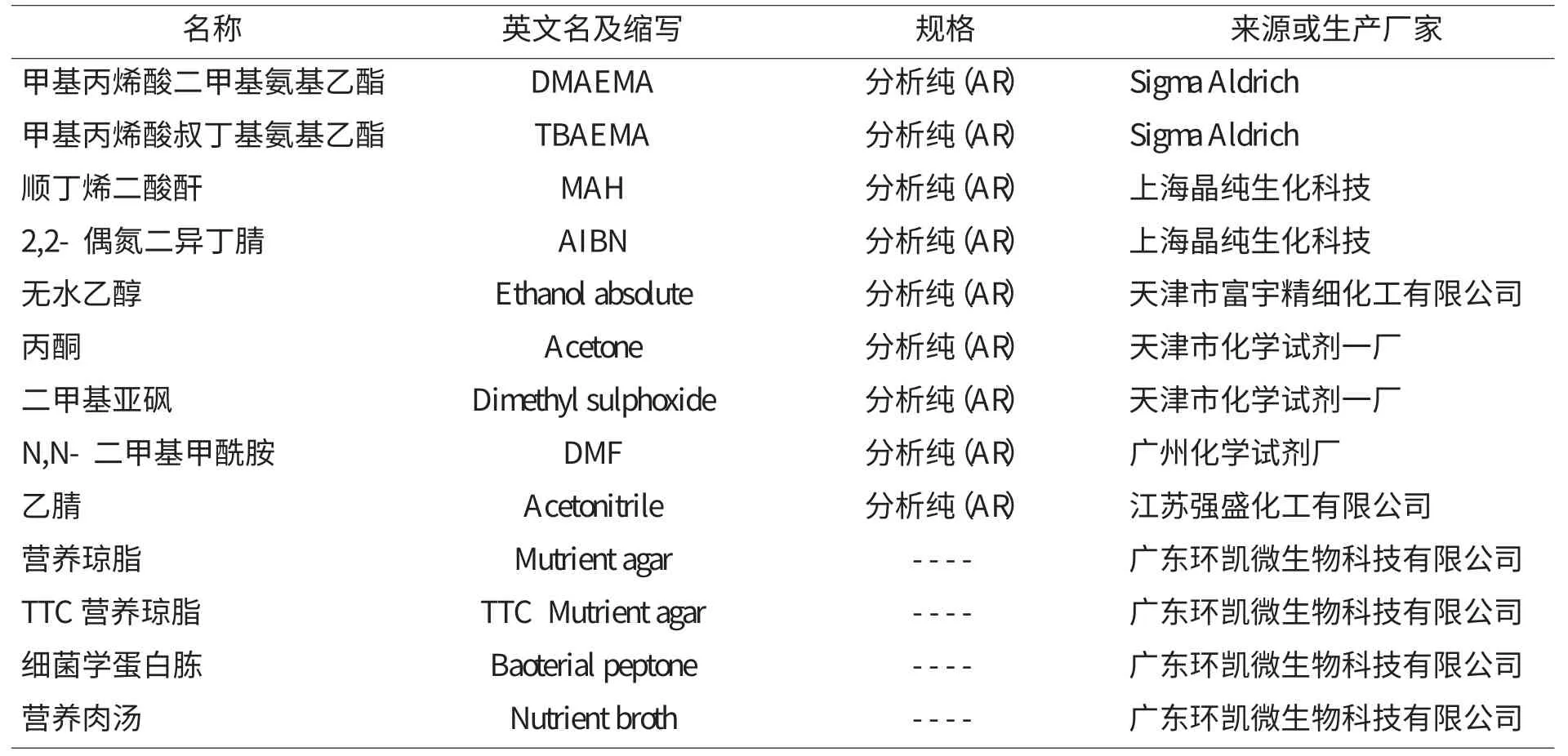
表1 实验药品及生产厂家
本实验所用水均为去离子水。
DMAEMA和TBAEMA由于其结构的特殊性易发生均聚,在存贮过程中添加了阻聚剂,实验时通过减压蒸馏的方法加以提纯。在减压蒸馏时需加入CaH2,马来酸酐提纯时加入AIBN。既可除去体系中的H2O,还可防止单体在提纯过程中自聚,并防止爆沸。收集馏分后密封冷藏保存待用。其他试剂均可直接使用。
表2示出了实验仪器及生产厂家。

表2 实验仪器及生产厂家
2 实验机理
从分子结构上看,甲基丙烯酸二甲氨基乙酯(DMAEMA)和甲基丙烯酸叔丁基氨基乙酯(TBAEMA)都是重要的丙烯酸酯单体,二者都含有高活性的叔氨基/仲氨基,酯基和聚合性的乙烯基等可反应性官能团,而顺丁烯二酸酐(即马来酸酐MAH)除了具备聚合性的双键外,还独有高活性的酸酐结构,本实验尝试将这3种单体进行共聚,制备目标产品抗菌聚合物PTDM。
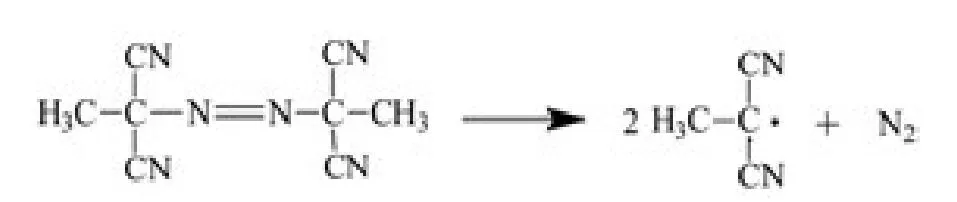
引发剂能使3个单体甲基丙烯酸二甲基氨基乙酯(DMAEMA)、甲基丙烯酸叔丁基氨基乙酯(TBAEMA)与马来酸酐(MAH)产生自由基,单体之间再发生共聚反应。下面反应式中,引发剂为2,2-偶氮二异丁腈(AIBN)。引发原理如下:
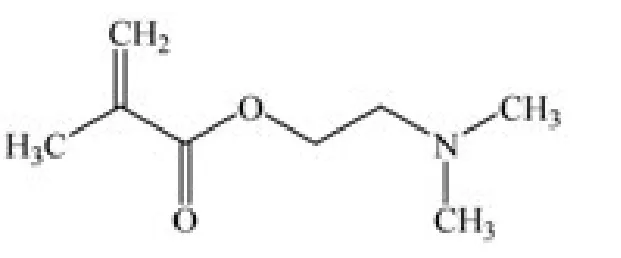
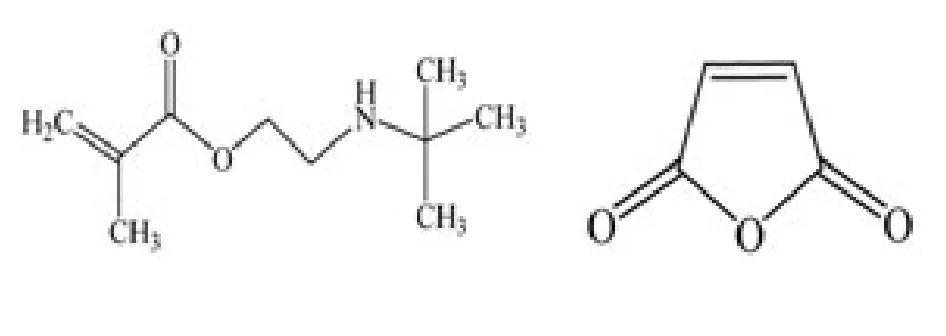
M1表示甲基丙烯酸二甲基氨基乙酯,M2表示甲基丙烯酸叔丁基氨基乙酯,M3表示马来酸酐,M1、M2、M3分子式分别为:
M1·表示M1被AIBN引发后产生的自由基。
M2·表示M2被AIBN引发后产生的自由基。
M3·表示M3被AIBN引发后产生的自由基。

其他反应过长过于复杂,在此不展开讨论。
3 实验过程
3.1 抗菌聚合物PTDM的合成
将双颈圆底烧瓶接上导气管和冷凝管后,分别加入三单体、有机溶剂(乙醇、丙酮等)和引发剂2,2-偶氮二异丁腈(AIBN),单体总浓度取0.5 mol/L,三单体DMAEMA∶TBAEMA∶MAH的摩尔比为3∶3∶2,引发剂AIBN和单体的摩尔比为0.3∶100。搅拌均匀后,通入保护气氮气30min排除体系中的氧气,升温至65℃,在N2气流中回流反应20h。冷却至室温后,旋转蒸发除去部分多余溶剂,将反应液缓缓倒入含少量阻聚剂的蒸馏水中,静置沉淀,过滤洗涤,先在60℃普通烘箱中初步干燥24 h,再在60℃真空烘箱中干燥24h,即得抗菌聚合物PTDM,称重,得透明略显黄色固体23.0755g。计算PTDM产率,将其放入干燥器中保存。
3.2 生丝脱胶
脱胶:取适量桑蚕丝与0.05 g/L的碳酸钠溶液混合煮沸,精炼0.5 h,再用去离子水洗涤2次,以除去残留离子及生丝表面脱去的丝胶蛋白,得到脱胶蚕丝。重复3次脱胶操作,生丝表面的丝胶蛋白基本除尽,只剩丝素。
3.3 生丝接枝
取适量聚合物PTDM放入20mL西林瓶中,倒入20mL有机溶剂将其完全溶解,再加入1g脱胶生丝纤维,浸泡20min后将西林瓶封口,恒温加热一段时间。取出生丝纤维,用丙酮浸泡洗涤3次,保持80~90℃烘干3min,再置于160~170℃下反应3 min。经过丙酮漂洗,二浸二轧(快速浸渍,快速挤轧)后,在70℃恒温烘干5h。计算接枝率。
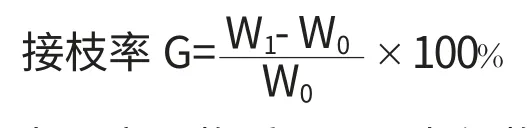
式中:W0为原高聚物质量;W1为织物抗菌整理后的质量。
3.4 实验菌株、菌悬液、培养基的准备
使用大肠杆菌(Escherichia coliATCC 25922)作为实验菌株。大肠杆菌无芽孢,常作为革兰氏阴性短杆菌的代表性菌种用于各类实验。
营养肉汤液体培养基:用适量营养肉汤粉末和去离子水配成浓度为18 g/L的营养肉汤。在120℃灭菌20min后,存放在4℃的冰箱中备用。
TTC营养琼脂:将已灭菌的营养琼脂溶化,冷却至60℃后,在无菌条件下将5%的TTC溶液加至营养琼脂中,使培养基中TTC浓度为0.05%,即得TTC营养琼脂。TTC琼脂上的菌落计数按GB4789.28/94中7.2规定,TTC琼脂组的菌落以呈红色或淡红色的点状、圆状或不规则形状的颗粒或无色但具有菌落特征的菌落为计数对象。
大肠杆菌菌株复苏活化后,挑一环菌体接种至已灭菌的营养肉汤中,置于转速为150 rpm、温度为37℃的气浴恒温振荡器中培养18~20h,此时大肠杆菌浓度约为109CFU(colony formingunits)/mL。将菌悬液置于4℃的冰箱中保存备用。
4 共聚物PTDM的红外谱图分析
我们用红外光谱仪表征了单体和共聚物的结构,结果分别列于图1 和图2。这些谱图中均检测到DMAEMA和TBAEMA的特征吸收峰,如图1有DMAEMA中—N(CH3)的—C—H伸缩振动峰(2 825cm-1)和TBAEMA中—C(CH3)3骨架的振动峰(1 230 cm-1);而图2中也有DMAEMA的—C—H伸缩振动峰(2 775 cm-1)和TBAEMA中—C(CH3)3骨架的振动峰(1 210 cm-1)。这些结果充分证明,DMAEMA和TBAEMA已成功共聚。
另外,由图2可知,聚合后,—C——O的伸缩振动峰由1 721 cm-1向高波数方向移动到1 736 cm-1,而—C—O—的对称及非对称伸缩振动峰则分别由1 300和1 166 cm-1向低波数方向移动到1 274和1 237 cm-1,这正与反应相符。当—C——C—聚合后,—C——C—与—C——O—的共轭效应消失,使得—C——O—处的电子云密度增大,吸收峰随之向高波数方向偏移;而—C—O—的电子云密度减小,吸收峰向低波数方向偏移。
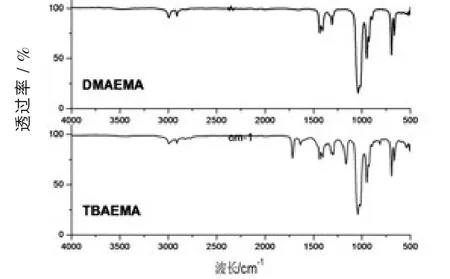
图1 单体D MAEMA 和TBAEMA 红外光谱图

图2 共聚物PT D M 的红外光谱图
5 抗菌性能表征
5.1 表征方法
取0.5 g需测定的样品与9mL浓度为4.6×106CFU/mL的菌悬液混合浸泡,在37℃、150 rmp下振荡培养1 h、3 h,分别检测1 h、3 h后菌落的生长情况,采用活菌计数法测定菌浓度,与初始菌浓度对比,计算抑菌率。
代入下述公式进行计算:
杀菌率η=(N0-N)/N0×100%
资源是图书馆提供信息服务的基石。在新媒体环境下,为了高质量地开展信息服务,满足读者多元化的信息需求,高校图书馆应在进行读者调研的基础上制定内容丰富、结构合理、载体形式多样的馆藏资源建设方案,实现馆藏结构、不同载体文献的和谐统一。而民族高校图书馆也担负着文化传承的使命,因此在资源建设方面除了常规资源建设意外,还应根据学校学科建设需求和民族特色文化,重点加强一批具有民族性、地域性的综合性特色数据库的建设,以便更好地服务于民族高校师生读者的科研需求。并在资源构建的基础上重点打造知识服务产品,基于资源进行知识内容的整合和有效的关联,以实现多层次、多方位、多形式的资源传播和信息服务。
其中:η 为杀菌率(%);N为抗菌处理后的菌浓度(CFU/mL);N0为初始菌浓度(CFU/mL)。
5.2 聚合物PTDM抗菌能力的表征
取合成产率分别为76%、48%、45%和50%的聚合物PTDM(编号为①~④),研究聚合物PTDM不同浓度时对大肠杆菌的抑菌能力差异,如表3和表4所示。
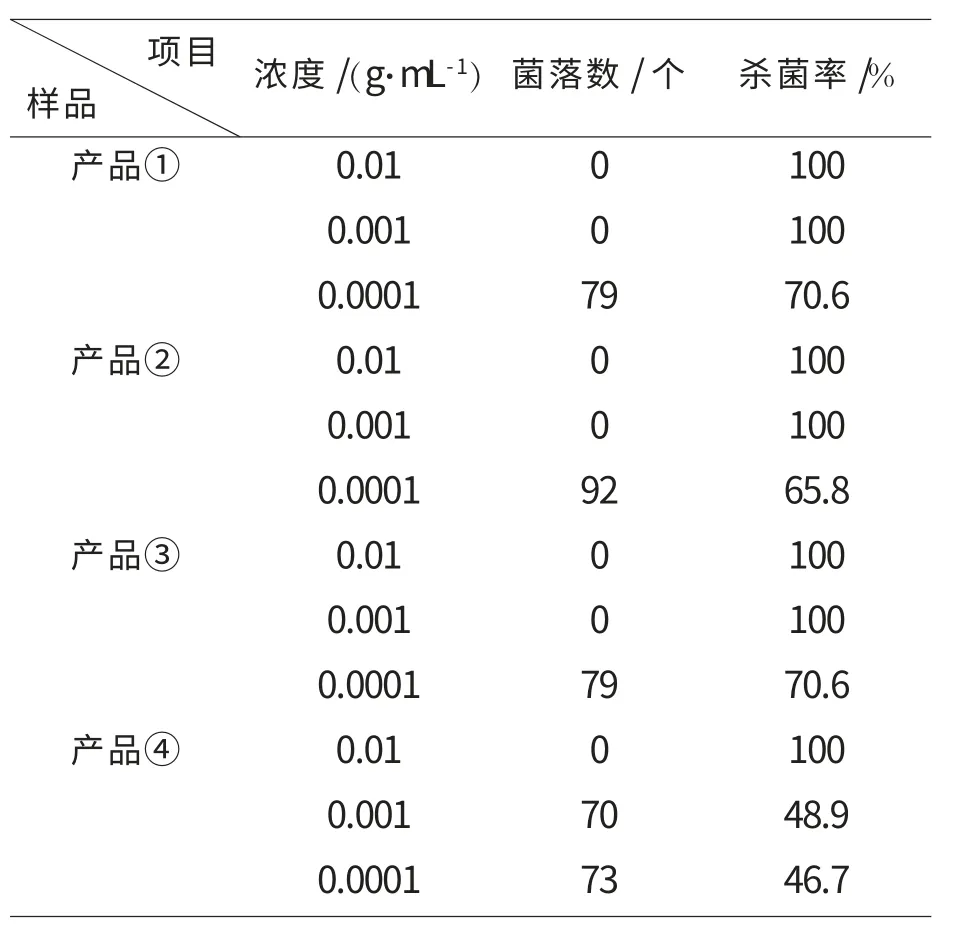
表3 产品①~④的抗菌测试数据对比

表4 产品①~④的抗菌测试图片对比
前3个产品①②③的浓度取0.01 g/mL和0.001 g/mL时,对应培养皿上肉眼观察不到菌落,抗菌率可达100%;第4个产品④的浓度取0.01 g/mL时,肉眼也观察不到菌落,和前3个产品取同浓度时的抗菌率相同,但当浓度稀释到0.001 g/mL时肉眼可见70个菌落,说明④的抗菌性低于①②③。
4个产品和空白试验进行对照,呈现出抗菌性能随浓度下降而减弱的趋势。
4个产品的浓度范围在0.01~0.001 g/mL时,对大肠杆菌显现出良好的杀菌性,甚至可高达100%的杀菌率。当浓度更低时(0.0001 g/mL),PTDM仍具有一定杀菌能力,体现出其低浓度杀菌性强的优越性。
5.3 接枝生丝抗菌能力的表征
5.3.1 不同接枝率的抗菌生丝1 h、3 h抗菌能力的差异
抽取接枝率分别为16.8%、11.1%、5.8%、4.2%和1.4%的抗菌生丝与按上述操作准备的大肠杆菌悬液浸泡(分别编号为①~⑤),经过1 h后将反应液稀释若干梯度,稀释梯度为10倍,用涂布棒均匀涂抹于按上述操作准备的营养琼脂平板上,恒温培养大肠杆菌过夜,观察菌落生长情况,如图3。

图3 ①~⑤号样品反应1 h 稀释培养过夜后菌落生长情况
菌落数量可直接反映对应接枝率的样品抗菌情况,肉眼所见菌落越多,表明抗菌效果越差,反之亦然。图3表明,①号、②号的平板菌落数较少,③号、④号次之,⑤号平板上长满菌落。初步判定①号和②号杀菌能力较强。
依然选取接枝率分别为16.8%、11.1%、5.8%、4.2%和1.4%的抗菌生丝与按上述操作准备的大肠杆菌悬液浸泡(分别编号为①~⑤),经过3 h后将反应液稀释若干梯度,用涂布棒均匀涂抹于按上述操作准备的营养琼脂平板上,恒温培养大肠杆菌过夜,观察菌落生长情况,如图4。

图4 ①~⑤号样品反应3 h 稀释培养过夜后菌落生长情况
从菌落数目来看,①、④号的平板菌落数最少,②、③号平板菌落数较少,⑤号的菌落数最多。表明:①、④号抑菌效果最强,⑤号抑菌效果最差。
比较图3和图4,发现④号样品浸泡3 h时比浸泡1 h时的抗菌表现有很大变化,前者菌落数远小于后者菌落数,表明浸泡时间增加后,灭菌能力得到更好发挥,抗菌能力增强,①号与④号表现相似,平板菌落数也随时间增加而减少。②、③号1 h和3 h的平板菌落数基本不变,表明浸泡时间增加并没有直接导致抗菌能力变化,生丝的抗菌效果有待观察。⑤号1 h和3 h的平板菌落数均非常多,无法肉眼计数。以①号与④号样品为代表,1 h和3 h的菌落数变化表明:接枝了聚合物PTDM的生丝接枝率与杀菌率有直接关系,当接枝率增大时,对大肠杆菌的杀菌率也随之上升。原因在于接枝率上升时,生丝上具有灭菌能力的N+密度也对应增大,抗菌基团与大肠杆菌接触几率增大,与菌体结合能力越强,季铵基团更易穿透细胞,对大肠杆菌的杀菌能力越强,杀菌率越高。
5.3.2 不同接枝率的抗菌生丝抑菌率的差异
使用移液枪吸取已配制好的大肠杆菌悬液1 mL与已灭菌的9mL蛋白胨混合,梯度稀释菌悬液,稀释倍数为10,选取适当浓度菌悬液0.1mL稀释液均匀涂布在无菌琼脂平板上,将无菌琼脂平板置于37℃的恒温恒湿箱中培养过夜,代入相应公式:
每毫升原菌液中活菌浓度/(cfu·mL-1)=同一稀释度菌落平均数×稀释倍数×10
计算得:
每毫升原菌液活菌数=45.5×104×10=4550000
仍取接枝率分别为16.8%、11.1%、5.8%、4.2%、1.4%和未接枝(接枝率为0%)的抗菌生丝与配制好的大肠杆菌悬液混合浸泡,编号为①~⑥号,置于恒温气浴振荡器中反应20 h,稀释若干倍数后,用移液枪吸取0.1mL反应液涂在已灭菌的营养琼脂平板上,置于37℃恒温生化培养箱中培养过夜,待长出菌落后,计数及计算抗菌率,得到表4数据。

表4 不同接枝率的抗菌生丝抑菌率的差异
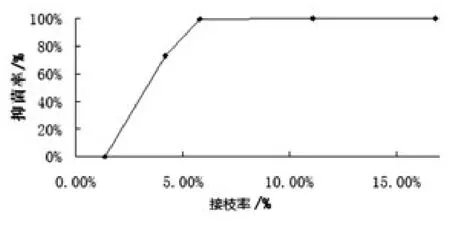
图5 接枝率与抑菌率关系图
由图5可知,抗菌生丝的接枝率与抑菌率呈正相关。接枝率越高,对应抗菌生丝对大肠杆菌的抑菌率越高。当接枝率大于5.8%时,对应抗菌生丝样品的抑菌率可高达90%,当接枝率在1.4%以下时,抑菌率为0。
5.3.3 接枝率不同的抗菌生丝与TTC琼脂混合抗菌试验
仍取接枝率分别为16.8%、11.1%、5.8%、4.2%、1.4%和未接枝(接枝率为0%)的抗菌生丝与配制好的大肠杆菌悬液混合浸泡后,一起倒入TTC琼脂中,编号为①~⑥号,置于37℃生化培养箱中过夜,待菌落产生后进行观察比较,如图6。

图6 ①~⑥号样品与TT C 琼脂混合培养过夜后菌落生长情况
数据表明:①、②号生丝抗菌能力最强,在琼脂上无菌落形成,抑菌率高达100%,表明经接枝改性后的抗菌生丝对大肠杆菌具有良好的杀菌能力。
③号生丝对应平板上存在少量菌落,抑菌率可达99.4%。
④号生丝对应平板上的菌落比③号略多,表明当接枝率仅为4.2%时,抑菌率也可达70%。
⑤号的接枝率很低,平板上菌落数比加入⑤号之前更多,表明大肠杆菌在蛋白胨培养基中繁殖,抑菌率为0%。
⑥号为空白试验,加入的是未接枝的生丝,大肠杆菌在蛋白胨培养基中繁殖,细菌浓度增大,无抑菌能力。
根据数据作出接枝率与抑菌率关系,如图5。
如图6所示:①~⑥号样品经处理后在琼脂上均显红色。
①、②号样品接枝率最大,对应生丝表面略显红色,生丝外的平板有少量菌落,表明①、②号样品抑菌率最好。
③号样品对应生丝表面呈红色,生丝外的平板上的菌落数目比①、②号样品多,抑菌率也低于①、②号样品。
④、⑤、⑥号样品对应生丝表面呈明显红色,表明对应抗菌生丝样品抑菌能力较差,大肠杆菌附着在生丝表面不断滋生。
6 结论
(1)由图5可知,抗菌生丝的接枝率与抑菌率呈正相关。接枝率越高,对应抗菌生丝对大肠杆菌的抑菌率越高。当接枝率大于5.8%时,对应抗菌生丝样品的抑菌率可高达90%,当接枝率在1.4%以下时,抑菌率为0。
(2)抗菌表征试验准备过程需在无菌环境下培养细菌,杜绝其他细菌污染,生化培养箱保持恒温37℃保存琼脂平板和培养细菌,菌悬液和营养肉汤需3℃以下保存。
(3)将抗菌剂接枝在生丝上,并进行抗洗性实验,证明此法接枝生丝可获得更为安全长效的抗菌效果,有助于减少现代医疗中对抗生素过于依赖的情况,其抗菌过程中结构不改变,使用一定时间后只需洗涤即可除去表面吸附的细菌残骸,恢复其抗菌性能,可循环利用,在成本上有良好优势。
[1]邢晓东,卢滇楠,周轩榕,等.抗菌纤维素纤维对金黄色葡萄球菌的抗菌过程[J].化工进展,2008,(27):289-293.
[2]刘耀斌,李彦锋,拜永孝,等.抗菌聚合物合成及其抑菌性能的研究进展[J].化学通报,2010,(2):118-123.
[3]杨明,朱凤博,汪明玥,等.抗菌剂与功能化EVA抑菌材料的研究进展[J].广州化工,2010,(38):18-21.
[4]董为民,左华江,吴丁财,等.季铵盐高分子抗菌剂的工艺优化与抗菌性能研究[J].离子交换与吸附,2011,(27):1-6.
[5]延秀银,王小晋,刘桂花,等.季铵盐、季鏻盐类高分子抗菌剂的研究进展[J].广州化工,2012,(37):56-60.
[6]李淳,孙蓉,曾秋苑,等.有机高分子抗菌剂的制备及抗菌机理[J].高分子通报,2011(3):79-85.
[7]王广莉,曹建新.纳米FE3O4颗粒修饰接枝高分子季铵盐抗菌剂及抗菌活性研究[J].贵州工业大学学报(自然科学版),2007,36.
[8]鹿桂乾,董为民,左华江.反应性高分子抗菌剂的合成及对棉织物的抗菌整理[J],离子交换与吸附,2010,(8):289-293.
[9]左华江,温婉华,吴丁财,等.高分子抗菌剂的研究现状[J].化工进展,2013,(32):604-607.

