MoF6在NaF颗粒上的吸附平衡及吸附动力学
程治强 李杨娟 张国欣 张焕琦 李洒洒 窦 强龙德武 吴国忠 李晴暖
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)2(中国科学院核辐射与核能技术重点实验室 上海 201800)3(上海大学 上海 201800)
MoF6在NaF颗粒上的吸附平衡及吸附动力学
程治强1,2李杨娟1,2张国欣1,2张焕琦1,2李洒洒3窦 强1,2龙德武1,2吴国忠1,2李晴暖1,2
1(中国科学院上海应用物理研究所 嘉定园区 上海 201800)2(中国科学院核辐射与核能技术重点实验室 上海 201800)3(上海大学 上海 201800)
为阐明六氟化钼(Molybdenum hexafluoride, MoF6)在氟化钠(Sodium fluoride, NaF)颗粒上的吸附机制,在静态吸附实验装置上研究了MoF6在NaF颗粒上的吸附平衡及吸附动力学行为,结果表明在50−100 ºC内,NaF颗粒对MoF6的吸附速率和平衡吸附量随着温度而升高,在100 ºC平衡吸附量达到115 mg MoF6·g−1NaF。当温度超过100 ºC时,NaF对MoF6的吸附作用减弱,吸附量减小。Langmuir模型能较好描述NaF颗粒对MoF6的吸附过程,并推测MoF6在NaF颗粒上的吸附为单分子层吸附。吸附动力学模型分析表明,NaF颗粒对MoF6的吸附符合准二级动力学方程,同时吸附过程受到颗粒内扩散控制,但其并不是唯一速率控制步骤。
氟化钠颗粒,气态氟化物,吸附等温线,吸附动力学,颗粒内扩散
氟化挥发法可用于乏燃料中铀的分离,是一种干法后处理技术,其利用铀与裂变产物的氟化物的挥发性不同来实现分离[1]。氟化挥发技术具有反应速度快、转化效率高、易连续化操作等优点,近年来被各国所广泛研究,其中尤其以日本、捷克和俄罗斯的研究成果最为突出[2−4]。在对乏燃料实施氟化挥发时,总有一部分挥发性裂变产物和结构材料的氟化物伴随UF6一起挥发进入气相,通常采用选择性吸附-脱附技术对氟化产物进行处理,以提高分离铀的纯度。该技术是基于挥发性氟化物在吸附剂上的吸附性能差异,通过吸附剂选择性去除UF6中的氟化物杂质,纯化后的UF6通过冷凝回收[5]。
MoF6是铀氟化产物中主要的挥发性杂质,其来自于核燃料裂变和结构材料,因沸点与UF6相近,挥发性和在某些吸附剂上吸附性能也相似,分离相对较为困难。选择合适的吸附剂和吸附温度是MoF6与UF6有效分离的关键。NaF是UF6净化工艺中使用最为普遍的吸附材料,相比于UF6而言,在一定温度范围内MoF6在NaF颗粒表面具有更高的蒸汽压,而蒸汽压高表明平衡时NaF对MoF6的吸附相对较少,由此吸附或脱附温度是MoF6与UF6分离的关键工艺参数之一[6]。NaF颗粒对UF6的吸附行为研究报道已屡见不鲜,包括NaF对UF6的吸附热力学[7]和不同形态NaF吸附剂对UF6的吸附动力学研究[8−9],而有关NaF颗粒对MoF6的吸附行为研究则尚未见具体报道。为实现UF6与MoF6的有效分离,确定相应最佳的吸附工艺,有必要了解和掌握MoF6在NaF颗粒上的吸附行为和机制。
我们以NaF粉末、羧甲基纤维素钠和水为原料,通过挤出切粒法成功制备了性能稳定的NaF吸附剂颗粒[10],在此基础上我们利用自行研制的吸附实验装置,采用静态吸附法研究了不同实验条件下NaF颗粒对MoF6的吸附行为,并结合理论模型对吸附平衡和动力学过程作详细分析,实验结果可为UF6吸附净化系统工艺设计提供借鉴和参考。
1 试剂与仪器
NaF颗粒:实验室自制,尺寸约ø4 mm×4 mm,颗粒强度50−80 N,比表面积约0.33 m2·g−1,孔隙率31%,经F2在300 ºC下氟化预处理(制备方法参见文献[10]);氮气:99.999%,上海娄氧气体罐装有限公司;氟氦混合气:5%F2/He,北京华科微能特种气体有限公司;MoF6:99.95%,阿法埃莎(天津)化学有限公司。
旋片真空泵:RV12,抽速4 L·s−1,英国Edward;绝压传感器:Setra 730,0−133 kPa,美国西特公司;机械压力表:−0.1−0.5 MPa,世伟洛克(上海)流体系统科技有限公司;伴热带:105 Watts,美国BriskHeat公司;电子天平:AL 204,精度0.1 mg,
瑞士梅特勒-托利多;气体净化器:7NP100,先普半导体技术(上海)有限公司;手套箱:H2O和O2含量均小于1 cm3/m3,上海米开罗那机电技术有限公司非标定制;氦检漏仪:HLT560,德国Pfeiffer Vacuum有限公司;电感耦合等离子体原子发射光谱仪(Inductively Coupled Plasma-Atomic Emission Spectrometry, ICP-AES):Optima 8000,美国Perkin Elmer公司。
2 实验方法
2.1 实验装置
吸附实验装置采用多支路设计(如图1所示),主要包括气体供应单元、吸附单元和尾气处理单元三部分,其中吸附单元由吸附柱和缓冲柱组成,两者均通过伴热带进行加热控温,吸附过程中MoF6的压力变化通过绝压传感器进行监测。气态氟化物所接触的管路及阀门材质均为不锈钢316L,绝压传感器气体接触材质为铬镍铁合金(Inconel alloy),在实验条件下均具有较好的耐腐蚀性能。
吸附实验开始前实验装置先经氦检漏仪进行气密性测试,装置各连接处泄漏率值均小于1×10−7mbar·L·s−1,24 h内真空度变化小于133 Pa。再用5%F2对装置钝化处理(除去装置内表面的微量水分,以减少管路内表面对MoF6的吸附)。每次实验结束后往吸附装置中充入约119 kPa的5%F2,以防止实验装置内部受到空气中水分影响。
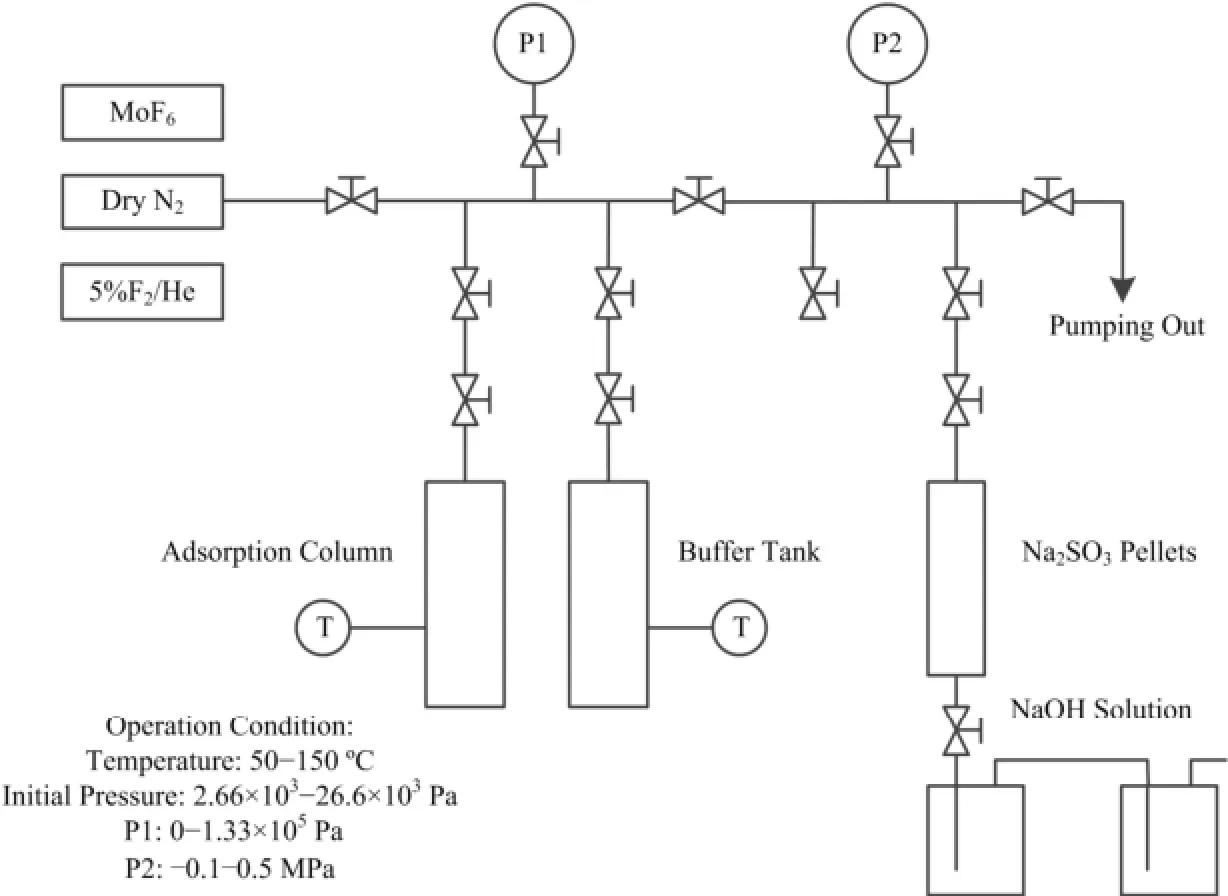
图1 静态吸附装置示意图Fig.1 Schematic diagram of static adsorption experiment.
2.2 吸附实验
实验过程操作具体步骤如下:(1) 在手套箱中准确称取1 g NaF颗粒,置于吸附柱内后,将吸附柱连接至吸附装置,经反复N2吹扫与抽真空处理去除吸附柱内以及吸附柱与实验装置连接处的空气;(2) 待吸附单元抽至真空稳定后充入约101 kPa的氟氦混合气,然后加热至100 ºC并保持30 min对吸附剂进行预处理;(3) 吸附单元进行N2反复吹扫去除残留氟气,然后抽至真空后关闭吸附柱的阀门;(4) 打开MoF6气瓶阀门,将MoF6引入缓冲柱,并调节压力至预设值,然后将缓冲柱加热至与吸附柱相同的温度;(5) 在吸附柱和缓冲柱温度稳定后开启吸附柱阀门,缓冲柱内的MoF6迅速进入吸附柱,吸附开始并记录吸附单元内不同时间下MoF6压力数值,直到压力稳定为止;(6) 实验结束后,对实验装置进行N2吹扫,将剩余MoF6载带进入尾气处理单元;(7) 将吸附柱拆卸并转移至手套箱,对吸附实验后的NaF颗粒进行称量,通过差重法计算所吸附的MoF6的量,并对样品进行ICP-AES分析。
吸附实验研究中,吸附开始瞬间的MoF6气体吸附分子浓度(起始浓度)是一个关键参数。本实验中吸附单元体积固定,MoF6气体浓度由气体压力和温度决定,为保证实验条件的一致性,MoF6气体的起始浓度用室温条件下初始压力Po表达。为更清楚描述本实验过程,在加温的吸附实验时,压力传感器显示的加热后MoF6压力为PT,吸附达到平衡时的MoF6压力为Pe,NaF颗粒不同时刻的吸附量为qt。
3 结果与讨论
3.1 吸附平衡时间
图2显示吸附温度为80 ºC、Po为7.98 kPa时,吸附单元内压力PT以及NaF吸附量(qt)随时间的变化曲线,从图2中可看出,压力随吸附时间延长迅速下降,即初始吸附速率较快。50 min后压力下降趋缓,300 min达到平衡,该体系的平衡吸附量为54 mg MoF6·g−1NaF。在后面吸附实验中单次实验吸附时间为360 min。
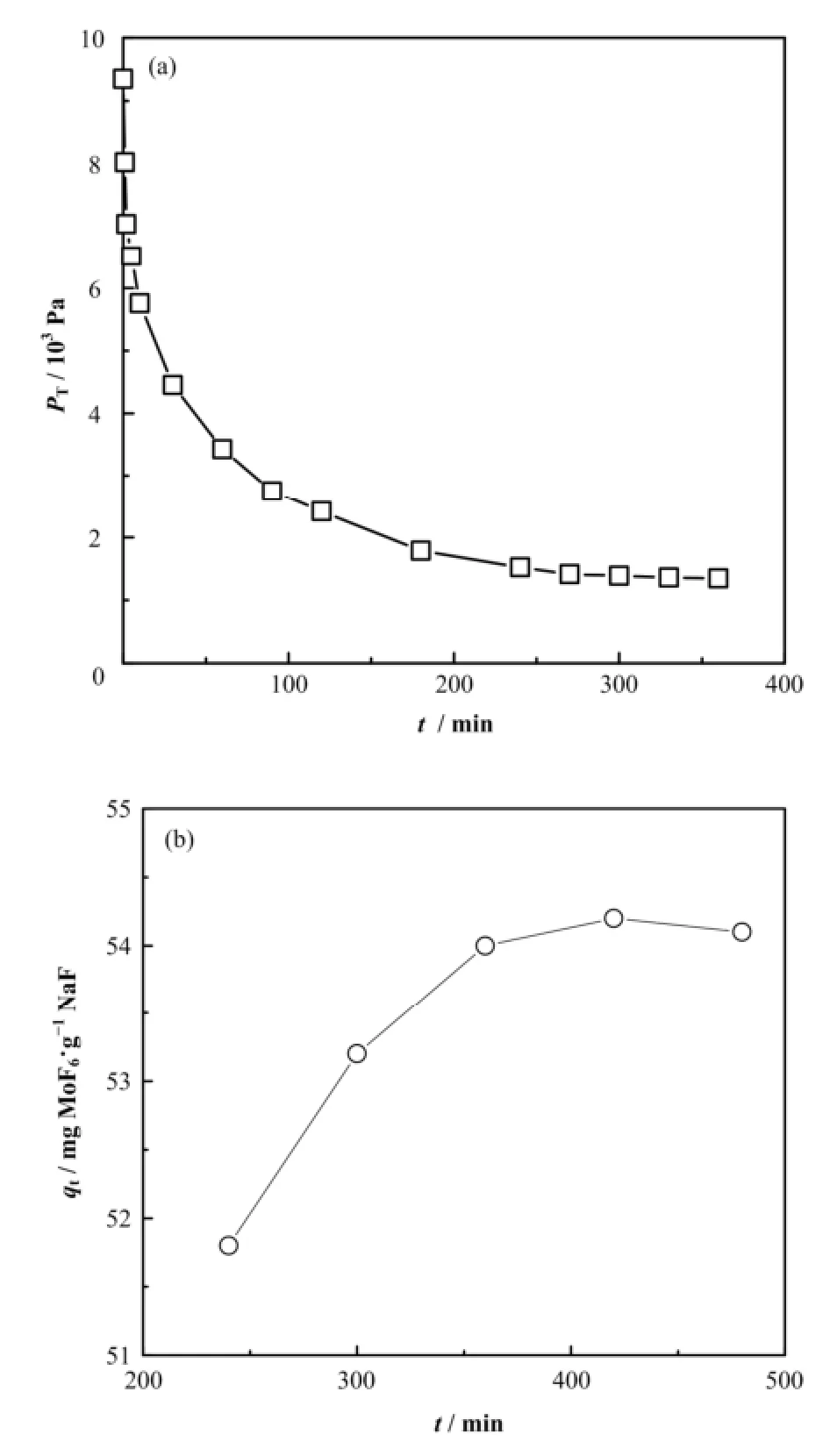
图2 吸附单元压力(a)和NaF吸附量(b)随时间的变化曲线Fig.2 Curve of pressure in adsorption unit (a) and adsorption amount of NaF (b) vs. time.
3.2 初始压力对吸附平衡的影响
系统研究了100 ºC下Po对NaF颗粒吸附平衡的影响(图3),并获得了NaF对MoF6的吸附等温线(图4)。由图3可知,在100 ºC时,NaF对MoF6的平衡吸附量随Po而增加,当Po达到15.96 kPa时趋于饱和,平衡吸附量为115 mg MoF6·g−1NaF。

图3 初始压力对NaF颗粒吸附量的影响Fig.3 Effect of initial pressure on the adsorption amount of NaF adsorbent.
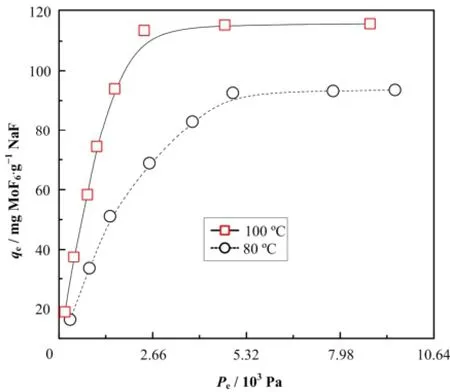
图4 NaF对MoF6的吸附等温线Fig.4 Adsorption isotherm for the sorption of MoF6onto NaF adsorbent.
将图4中的相关数据分别利用Langmuir (式1)和Freundlich (式2)线性方程进行拟合分析[11−12]:
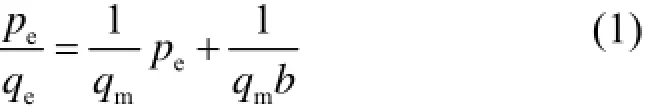
式中,qe为平衡吸附量,mg MoF6·g−1NaF;Pe为吸附达到平衡时的MoF6压力,Pa;qm为理论最大吸附量,mg MoF6·g−1NaF;b为吸附作用的平衡常数,Pa−1,其值大小与吸附剂、吸附质的本性及温度的高低有关,b值越大,则表示吸附能力越强。
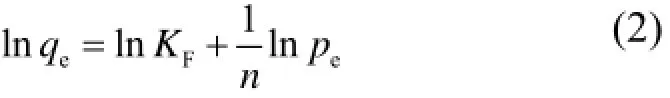
式中,KF代表吸附剂的单位吸附能力;n为等温吸附特征常数,通常1/n在0.1−0.5,则表示易于吸附,1/n>2时表示难以吸附。
通过计算得到相应的回归方程及其模型参数如表1所示,从表1中数据可以看出,Langmuir模型能更好描述NaF颗粒对MoF6的吸附过程,计算得到的理论最大吸附量(qm)与实验测定值比较接近。根据Langmuir模型假设条件,可推测MoF6在NaF颗粒上的吸附为单分子层吸附。
实验中还研究了80 ºC时Po对NaF颗粒吸附平衡影响(图3、4),由图3、4可知,80 ºC下NaF颗粒对MoF6的平衡吸附量同样随着Po而增加,变化趋势与100 ºC时类似。不同的是任何Po下,100 ºC时NaF颗粒对MoF6的平衡吸附量都比80 ºC时的量值高。这结果表明温度对吸附过程有重要影响,有关温度对吸附平衡的影响将在§3.3详细阐述。
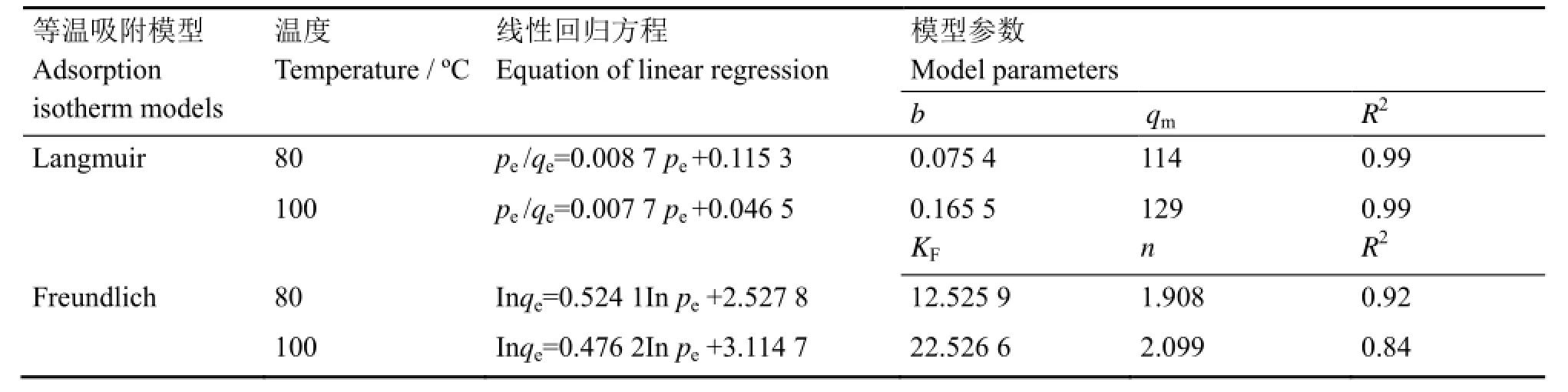
表1 不同吸附温度下等温吸附模型拟合参数Table 1 Fitting results of adsorption isotherm model at different temperature.
3.3 温度对平衡吸附量和吸附速率的影响
考察了Po为13.3 kPa下,温度对平衡吸附量和吸附速率的影响。从图5可知,在温度为50−100 ºC范围内,NaF颗粒对MoF6的平衡吸附量随温度而升高,100 ºC时平衡吸附量为97 mg MoF6·g−1NaF。当吸附温度升至120 ºC时,其平衡吸附量较100 ºC时有所减小,在温度继续升高至150 ºC时,NaF颗粒吸附量继续下降,约为100 ºC时的60%。
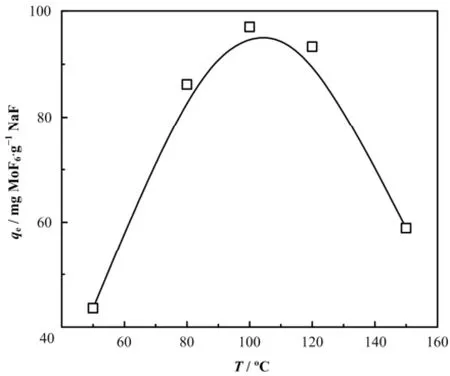
图5 温度对NaF平衡吸附量的曲线Fig.5 Curve of temperature vs. equilibrium adsorption capacity.
为阐明温度对于NaF吸附过程的影响,分别采用准一级和准二级动力学模型对不同温度下的吸附动力学数据进行分析,详见图6(a)−(c)。从表2结果可知,准一级动力学方程的相关系数R2为0.92−0.96,能较好描述吸附过程的初始阶段,但随着吸附过程的进行,实验数据逐渐偏离拟合数据。相比而言,准二级动力学方程拟合的相关系数为0.95−0.99,表明准二级动力学模型能够更好描述NaF对MoF6的整个吸附过程,包括气体分子在吸附剂颗粒的表面扩散、颗粒内扩散以及位点吸附等。另外从表2中模型参数结果可知,初始吸附速率(ho)在50−120 ºC范围内随着温度而增加,而在150 ºC时有所下降。
因准一级和准二级动力学方程不适用于解释扩散机理,又采用颗粒内扩散模型对吸附过程中的扩散现象进行了解释,结果如图6(d)所示。图6(d)中第二段线性斜率表明的是颗粒内扩散速率[13],在50−100 ºC范围内随着温度升高颗粒内扩散速率常数(Kp)增加,而在100 ºC以后随着温度继续升高颗粒内扩散速率常数逐渐减小,其变化趋势与吸附量变化趋势一致,说明NaF颗粒对MoF6的吸附过程受颗粒内扩散控制。在较低温度(50 ºC)下,NaF颗粒对MoF6的吸附过程主要受到颗粒内扩散阻力的影响,进入颗粒内部的MoF6分子有限,大部分的吸附位点并未发生吸附反应,从而导致NaF颗粒对MoF6的吸附量较低。随着吸附温度继续升高,MoF6分子在NaF颗粒内的扩散加快,逐渐克服内扩散阻力的影响,进入颗粒内部的MoF6分子逐渐增加,吸附速率和吸附量明显增加。需要指出的是,当温
度为150 ºC时,MoF6分子在NaF颗粒内扩散变的更快,但吸附量反而减少,这是因为温度升高MoF6在NaF颗粒表面的蒸汽压增加,导致吸附量减少。同时从图6(d)可知,拟合曲线为多段线性关系,说明颗粒内扩散控制并不是唯一的速率控制步骤,吸附速率同时还受吸附剂颗粒的表面吸附和气膜扩散的控制,整个吸附过程是受到多种动力学机理共同作用的结果。
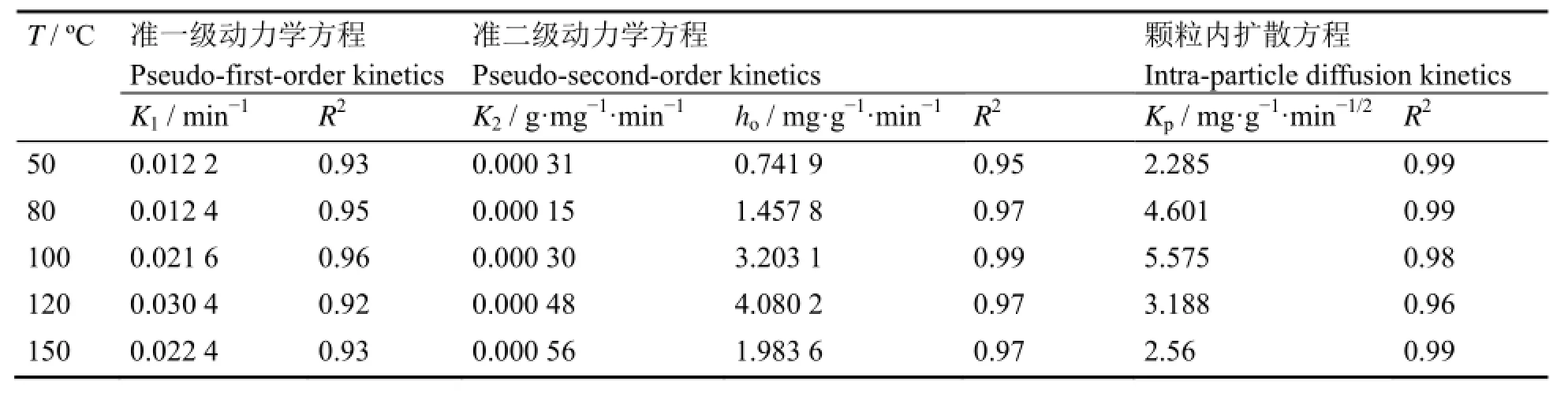
表2 不同温度下吸附动力学方程拟合参数Table 2 Fitting results of adsorption kinetics model under different temperature.
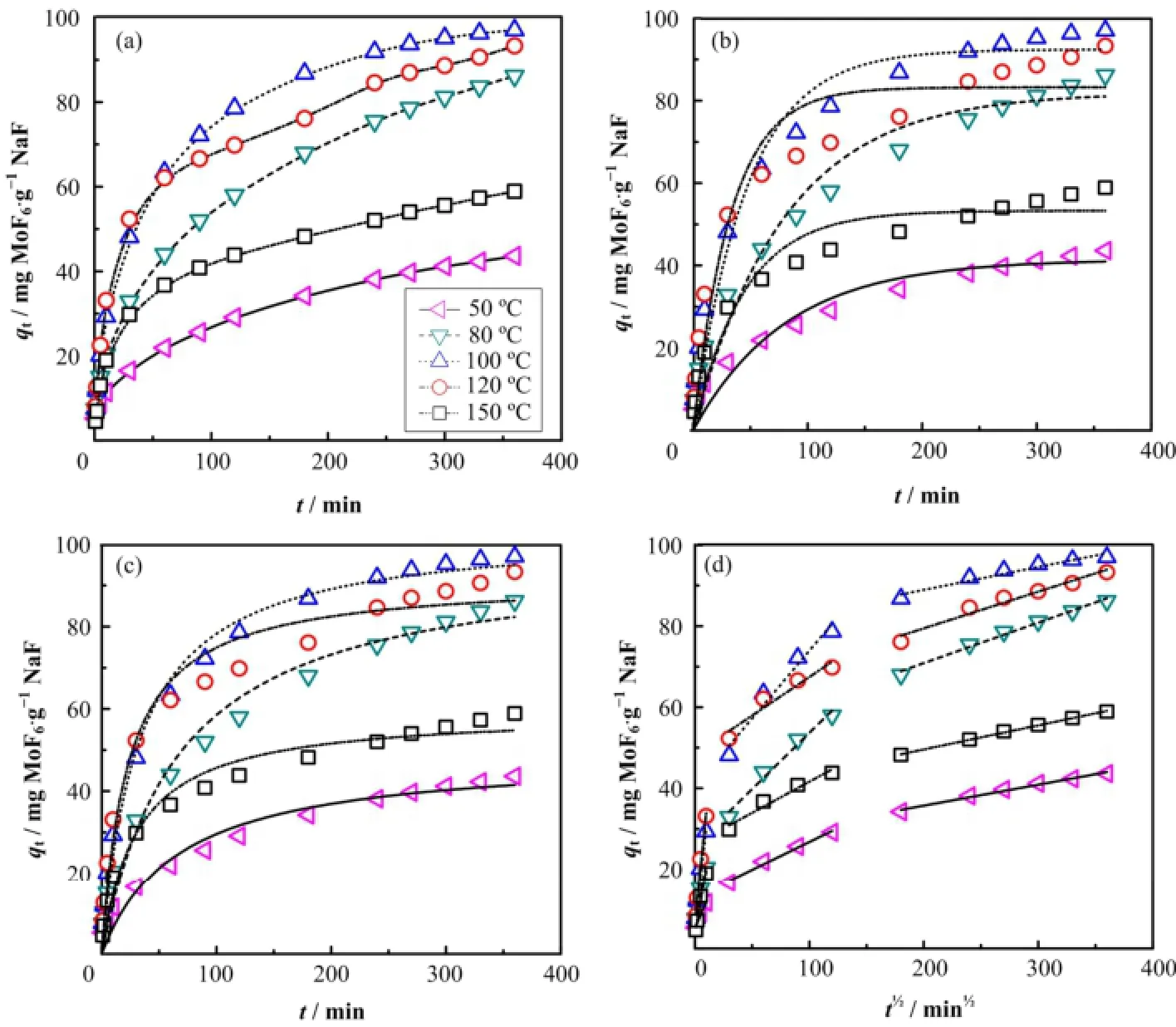
图6 不同温度(a)、准一级(b)、准二级(c)和颗粒内扩散(d)吸附动力学曲线Fig.6 Adsorption kinetics curves at different temperature (a), pseudo-first-order kinetics (b), pseudo-second-order kinetics (c) and intra-particle diffusion kinetics (d) for the adsorption.
UF6和MoF6在NaF颗粒表面蒸汽压方程为logPMoF6=10.21−3630/T和logPUF6=10.88−5090/T[6],通过计算可知,在100 ºC时UF6和MoF6在NaF颗粒表面蒸汽压分别为0.266和399 Pa。与MoF6相比,在100 ºC时,UF6在NaF吸附剂上有更快的吸附速率和吸附量。结合本实验结果,表明在此温度条件下根本无法通过特异吸附实现两者的分离。再计算150 ºC时UF6和MoF6的蒸汽压分别为9.31 Pa和5.65×103Pa,本实验结果也表明150 ºC时NaF吸附剂对MoF6吸附能力减弱,而此时NaF对UF6仍保持强有力的吸附能力,因此可以通过升温使MoF6脱附,从而实现两者的分离。
4 结语
本文采用静态吸附法研究了不同实验条件下NaF颗粒对MoF6的吸附平衡以及吸附动力学行为,实验结果表明,吸附温度对吸附过程的影响较大,在50−100 ºC范围内随着温度升高,NaF颗粒对MoF6的吸附量和吸附速率逐渐增加,当温度超过100 ºC时,NaF颗粒对MoF6的吸附作用减弱,吸附量减小。Langmuir等温吸附模型分析指出,MoF6在NaF颗粒上的吸附为单分子层吸附,NaF颗粒对MoF6的吸附动力学行为能够较好符合准二级动力学方程,同时吸附过程受到颗粒内扩散控制,但其并不是唯一速率控制步骤。本研究表明在用NaF吸附剂进行UF6和MoF6的吸附分离时,可以采用的工艺过程为共吸附和特异脱附,即在100 ºC下对UF6和MoF6同时吸附,然后利用高温下蒸汽压的差异,进行MoF6脱附从而实现两者的分离,最后通过继续升高温度进行UF6的脱附和冷凝收集。
致谢 感谢中国科学院上海应用物理研究所李文新研究员在实验过程中的指导。
1 刘学刚. 乏燃料干法后处理技术研究进展[J]. 核化学与放射化学, 2009, 31(增刊): 35−44 LIU Xuegang. Research on dry reprocessing technology of spent nuclear fuel[J]. Nuclear and Radiochemistry, 2009, 31(Suppl): 35−44
2 Yuko K, Akira S, Kuniyoshi H, et al. New reprocessing system for spent nuclear reactor fuel using fluoride volatility method[J]. Journal of Fluorine Chemistry, 2009, 130: 74−82. DOI: 10.1016/j.jfluchem.2008.07.006
3 Jan U, Martin M. Fluoride volatility method for reprocessing of LWR and FR fuels[J]. Journal of Fluorine Chemistry, 2009, 130: 89−93. DOI: 10.1016/j.jfluchem. 2008.07.002
4 Shatalov V V, Seregin M B. Gas-fluoride technology for processing spent oxide fuel[J]. Atomic Energy, 2001, 90(3): 224−234
5 Brater D C, Kaufman H L, Pashley J H, et al. Removal of impurities from uranium hexafluoride by selective sorption techniques[R]. K-1666, Oak Ridge, Tennessee, Oak Ridge Gaseous Diffusion Plant, Union Carbide Corporation, Nuclear Division, 1966
6 Culler F L, Ferguson D E, Blanco R E, et al. Chemical technology division annual progress report[R]. ORNL-3153, 1961
7 Cathers G I, Bennett M R, Jolley R L. UF6-3NaF complex formation and decomposition[J]. Industrial and Engineering Chemistry, 1958, 50(11): 1709−1710
8 Massoth F E, Hensel W E. Kinetics of the reaction between uranium hexafluoride and sodium fluoride I: sodium fluoride powder[J]. Journal of Physical Chemistry, 1958, 62(4): 479−481
9 Massoth F E, Hensel W E. Kinetics of the reaction between uranium hexafluoride and sodium fluoride II: sodium fluoride pellets and crushed pellets[J]. Journal of Physical Chemistry, 1959, 63(5): 697−702
10 李杨娟, 程治强, 张焕琦, 等. 一种多孔型NaF吸附剂的制备及其对MoF6吸附的初步研究[J]. 核技术, 2014, 37(8): 080601. DOI: 10.11889/j.0253-3219.2014.hjs.37. 080601 LI Yangjuan, CHENG Zhiqiang, ZHANG Huanqi, et al. A novel technique for preparation of the porous adsorbent NaF and a preliminary study on its adsorption capacity for MoF6[J]. Nuclear Techniques, 2014, 37(8): 080601. DOI: 10.11889/j.0253-3219.2014.hjs.37.080601
11 Liu R Q, Wang X P, Ning S Y, et al. Adsorption behavior of241Am(III) and Eu(III) by silica/polymer-based isoHex-BTP adsorbent from nitric acid solution[J]. Nuclear Science and Techniques, 2015, 26(1): S10301. DOI: 10.13538/j.1001-8042/nst.26.S10301
12 Wu H, Wu Y, Chen Z, et al. Adsorption behaviors of iodide anion on silver loaded macroporous silicas[J]. Nuclear Science and Techniques, 2015, 26(3): 030301. DOI: 10.13538/j.1001-8042/nst.26.030301
13 Hardiljeet K B, Meera J, Denis M O. Kinetics and thermodynamics of cadmium ion removal by adsorption onto nano zero valent iron particles[J]. Journal of Hazardous Materials, 2011, 186(1): 458−465. DOI: 10. 1016/j.jhazmat.2010.11.029
Adsorption equilibrium and kinetics of molybdenum hexafluoride on sodium fluoride adsorbent
CHENG Zhiqiang1,2LI Yangjuan1,2ZHANG Guoxin1,2ZHANG Huanqi1,2LI Sasa3DOU Qiang1,2LONG Dewu1,2WU Guozhong1,2LI Qingnuan1,2
1(Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Jiading Campus, Shanghai 201800, China) 2(Key Laboratory of Nuclear Radiation and Nuclear Technology, Chinese Academy of Sciences, Shanghai 201800, China) 3(Shanghai University, Shanghai 201800, China)
Background: The fluoride volatility process has been developed to recover uranium from spent nuclear fuel. And the fluoride adsorption and desorption technique is usually applied to the purification of UF6in the fluoride volatility process. Purpose: This study aims to investigate the adsorption mechanism of MoF6on NaF adsorbent. Methods: The adsorption equilibrium and kinetics of MoF6on NaF adsorbent at different temperatures and initial MoF6pressure were experimentally studied by using statistic adsorption equipment. Langmuir adsorption model and adsorption kinetics model were applied to analyse experimental data. Results: The adsorption rate and equilibrium adsorption capacity of MoF6on NaF adsorbent increased with the temperature increasing from 50 ºC to 100 ºC, and the adsorption capacity was 115 mg MoF6·g−1NaF at 100 ºC.The experimental data were fitted by pseudo-second-order kinetics as well as Langmuir adsorption model. Conclusion: The adsorption of MoF6on NaF adsorbent was monolayer adsorption according to Langmuir adsorption model, and was controlled by diffusion of MoF6inside NaF adsorbent which was not the unique rate-determining step, though.
NaF adsorbent, Gaseous fluoride, Adsorption isotherm, Adsorption kinetics, Intra-particle diffusion
TL99
10.11889/j.0253-3219.2015.hjs.38.110301
中国科学院战略性先导科技专项项目(No.XDA02030000)资助
程治强,男,1985年出生,2011年于南华大学获硕士学位,主要从事铀氟化挥发产物的吸附净化研究
窦强,E-mail: douqiang@sinap.ac.cn
2015-07-24,
2015-09-14
CLC TL99

