鳗弧菌感染对斑节对虾免疫相关指标的影响
段亚飞, 董宏标, 王 芸, 刘青松, 李 华, 张家松
(中国水产科学研究院 南海水产研究所 农业部南海渔业资源开发利用重点实验室, 广东 广州 510300)
斑节对虾(Penaeus monodon)俗称草虾、虎虾等,隶属于甲壳纲(Crustacea)、十足目(Decapoda)、对虾科(Penaeidae)、对虾属(Penaeus), 是世界三大养殖对虾之一。因其个体大、食性杂、肉质鲜美和生长速度快等特点, 已成为中国沿海地区重要的经济养殖虾类[1-2]。近年来, 由弧菌(Vibriospp.)引起的虾类疾病频发, 给虾类养殖业带来严重的经济损失, 制约了其产业的健康发展[3-4]。因此, 虾类弧菌病及其免疫机制的研究显得尤为重要。
鳗弧菌(Vibrio anguillarum)属于革兰氏阴性菌,是一种常见的水产动物致病菌, 其能引起鱼类体表溃烂出血、肠黏膜脱落和肝脏坏死等症状[5-6], 还会导致虾类黄鳃病的发生[7], 且具有对虾发病率和死亡率高、传播范围广、危害大等特点, 与以往报道的弧菌引起的病害有所不同。对虾缺乏获得性免疫系统, 其依靠各种类型的非特异性免疫因子来识别异己, 抵抗各种病原的感染[8]。总抗氧化能力(T-AOC)是衡量机体抗氧化防御系统功能状况的综合性指标[9]。溶菌酶(LSZ)是甲壳动物体内重要的抗菌蛋白, 其活性的变化可以作为衡量机体免疫功能状态的重要指标[10]。一氧化氮(NO)是一种新型免疫调节分子, 参与机体多种重要的生理病理过程; 诱导型一氧化氮合酶(iNOS)可以催化 L-精氨酸与 O2反应产生 NO,其活性可由测定的 NO合成量来决定[11-12], 因此两者配合使用对疾病的深入研究具有重要意义。
然而, 目前关于鳗弧菌感染引起斑节对虾免疫指标变化特征的研究相对较少, 而对虾弧菌病监测指标的筛选对其疾病及免疫机制的研究具有重要意义。本研究通过对斑节对虾进行鳗弧菌注射感染, 测定不同时间点免疫指标 T-AOC、LSZ和 iNOS活性以及 NO含量的变化, 初步探讨鳗弧菌感染对斑节对虾免疫指标的影响, 并筛选虾类弧菌病的监测指标, 以期为斑节对虾应答弧菌感染的免疫机制研究提供基本的理论参考。
1 材料与方法
1.1 材料
本研究所用斑节对虾取自中山衍生水产养殖有限公司, 体质健康活泼, 平均体长(10.81±0.45)cm,体质量(5.65±0.34) g; 于 PVC 桶(200 L)中暂养 1 周,每桶30尾。实验期间, 水温25 ℃, 盐度15, pH 8.5,不间断充气, 每天换水1/3, 并投喂对虾配合饲料。
实验用鳗弧菌为中国水产科学研究院黄海水产研究所育种室所赠。感染实验前1 d, 2611E平板上活化菌种; 然后利用液体培养基进行扩大培养, 4 ℃2 000 r/min离心取沉淀, 用0.86%无菌生理盐水稀释至1×108cfu/mL的菌悬液, 4 ℃保存备用。
1.2 鳗弧菌感染实验
将暂养1周的斑节对虾随机分为两组, 即: 对照组和感染组, 每组3个平行, 每个平行30尾。感染组对虾平均每尾注射鳗弧菌菌悬液20 μL (约2×106cfu), 对照组注射0.86%无菌生理盐水20 μL, 注射部位均为对虾第2腹节。分别于注射后0、1.5、3、6、12、24和48 h, 取濒临死亡或活力较弱个体的肝胰腺和鳃组织, 用于酶活性的测定。同一时间点每个平行组分别取2尾虾, 将组织混合, 作为一组样品, 即每个时间点感染组或对照组共有3组样品。
另取60尾对虾分为两组, 分别注射等体积鳗弧菌菌悬液和 0.86%无菌生理盐水, 用于统计对虾累计存活率, 整个过程不取样。注射剂量和方法如上所述。
1.3 样品制备
使用预冷的 0.86%生理盐水对所取的肝胰腺和鳃组织进行漂洗, 去除组织液, 滤纸拭干, 称重后置于离心管中。按照1∶10 (W/V)加入预冷的0.86%生理盐水进行超声粉碎。将制备好的 10%组织匀浆液于4 ℃ 2000 r/min离心10 min, 取上清液于-80 ℃保存备用, 用于免疫指标的测定。
1.4 免疫指标的测定
使用南京建成生物工程研究所试剂盒分别测定T-AOC、LSZ和iNOS活性以及NO与组织蛋白含量,相关操作按说明书进行, 未做任何调整。各项指标测定所用试剂盒均为同批次试剂。
37℃时, 每分钟每毫克组织蛋白, 使反应体系的吸光度(OD)值每增加0.01时, 定义为1个T-AOC单位; LSZ活性测定采用比浊法; NO含量测定采用硝酸还原法, 利用硝酸盐显色剂生成红色偶氮化合物来间接测定; iNOS活性主要利用其催化L-精氨酸与O2反应生成NO, NO与亲核性物质作用生成有色化合物从而通过测定530 nm吸光度进行定量; 组织蛋白含量测定采用考马斯亮蓝法。
1.5 数据分析
实验所得数据以平均值±标准差表示, 用 SPSS 11.0软件进行单因素方差分析,P<0.05表示差异显著。
2 结果
2.1 鳗弧菌感染对斑节对虾存活的影响
与对照组相比, 感染组斑节对虾于3 h出现死亡,6 h时死亡率明显升高, 累积存活率为88.3%(图1)。感染鳗弧菌后, 对虾摄食量明显减少, 活动不频繁; 濒临死亡时, 对虾肌肉乳白状, 尾肢和胃部轻微发红。而对照组对虾实验全程无死亡, 摄食、活动等无异常现象。

图1 斑节对虾感染鳗弧菌后的累积存活率Fig. 1 Cumulative survival of P. monodon after V. anguillarum challenge
2.2 鳗弧菌感染对斑节对虾T-AOC活性的影响
与对照组相比, 斑节对虾感染鳗弧菌后6 h, 肝胰腺中 T-AOC活性显著上升至最大值, 为对照组的3.80倍(P<0.05); 随后 T-AOC 活性逐渐下降, 但 12和24 h活性仍高于对照组(P<0.05), 最后于48 h降至对照组水平(图 2a)。鳃中 T-AOC活性于感染后 3 h上升至较高值; 感染后 6 h, T-AOC活性有所下降,但于 12 h再次达到最大值, 为对照组的 3.71倍(P<0.05); 随后T-AOC活性逐渐下降, 并于48 h显著低于对照组(P<0.05)(图 2b)。
2.3 鳗弧菌感染对斑节对虾LSZ活性的影响
与对照组相比, 斑节对虾肝胰腺和鳃中 LSZ活性于感染鳗弧菌后3 h显著上升, 并分别于6和12 h达到最大值, 为对照组的4.90和2.91倍(P<0.05); 随后LSZ活性均于24 h显著下降至最小值, 分别为对照组的0.42和0.53倍(P<0.05)。感染鳗弧菌后48 h,肝胰腺和鳃中 LSZ活性虽低于对照组, 但差异不显著(P>0.05)(图 3)。
2.4 鳗弧菌感染对斑节对虾 NO含量的影响
与对照组相比, 感染鳗弧菌后 3 h, 肝胰腺中NO含量显著上升, 并于6 h达到最大值, 为对照组的2.75倍(P<0.05); 随后NO含量逐渐下降, 并于24 h显著低于对照组(P<0.05)(图 4a)。感染组对虾鳃中NO含量于3 h逐渐上升至最大值, 为对照组的1.71倍(P<0.05), 随后NO含量逐渐下降, 于48 h显著低于对照组(P<0.05); 而6和24 h的NO含量仍显著高于对照组(图4b)。
2.5 鳗弧菌感染对斑节对虾 iNOS活性的影响

图2 斑节对虾感染鳗弧菌后肝胰腺(a)和鳃(b)中总抗氧化能力(T-AOC)的活性变化Fig. 2 Activity of T-AOC in P. monodon hepatopancreas (a) and gills (b) after V. anguillarum challenge

图3 斑节对虾感染鳗弧菌后肝胰腺(a)和鳃(b)中溶菌酶(LSZ)的活性变化Fig. 3 Activity of LSZ in P. monodon hepatopancreas (a) and gills (b) after V. anguillarum challenge

图4 斑节对虾感染鳗弧菌后肝胰腺(a)和鳃(b)中一氧化氮(NO)的含量变化Fig. 4 Concentration of NO in P. monodon hepatopancreas (a) and gills (b) after V. anguillarum challenge
与对照组相比, 斑节对虾感染鳗弧菌后3 h, 肝胰腺中 iNOS活性逐渐上升至最大值, 为对照组的3.27倍(P<0.05); 随后活性逐渐下降, 于24 h显著低于对照组, 为对照组的0.53倍(P<0.05)(图5a)。鳃中iNOS活性于感染后6 h开始显著上升, 12 h时达到最大值, 为对照组的 3.80倍(P<0.05); 随后 iNOS活性逐渐降低, 并于48 h显著低于对照组(P<0.05)(图5b)。
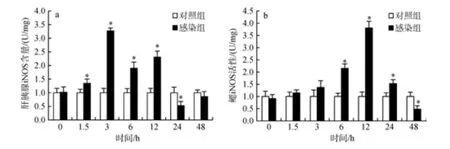
图5 斑节对虾感染鳗弧菌后肝胰腺(a)和鳃(b)中诱导型一氧化氮合酶(iNOS)的活性变化Fig. 5 Activity of iNOS in P. monodon hepatopancreas (a) and gills (b) after V. anguillarum challenge
3 讨论
3.1 鳗弧菌对斑节对虾T-AOC活性的影响
弧菌是虾类养殖中危害严重的传染性病原, 其能导致患病虾类机体生理功能紊乱, 出现大量死亡[13]。外界病原入侵动物机体时, 会诱发机体免疫反应产生大量活性氧(ROS), 如超氧阴离子自由基、羟自由基和过氧化氢等, 用于杀灭病原; 但过量的 ROS会破坏宿主细胞, 造成机体抗氧化系统功能紊乱, 从而导致生理机能和免疫功能受损[14]。在长期进化过程中, 动物机体形成了一套抗氧化酶防御系统, 主要包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)等, 可以有效地将机体多余的活性氧清除, 保护机体免受氧化损伤[15]。T-AOC是评价机体抗氧化酶系统和非酶促系统功能的综合性指标[16], 可以代表和反映机体抗氧化防御系统的状态。
研究表明, 副溶血弧菌(Vibrio parahemolyticus)感染导致斑节对虾组织T-AOC活性呈先升高后下降的变化趋势[8]; 感染鳗弧菌后的中国对虾(Fenneropenaeus chinensis)血淋巴SOD酶活性于1 h显著升高至最大值, 随后呈先升高再降低的趋势[17]。陈萍等[18]用溶藻弧菌(Vibrio alginolyticus)对三疣梭子蟹(Portunus trituberculatus)进行感染, 发现其机体内升高的脂质过氧化物水平导致其抗氧化酶活性降低, 抗氧化防御能力显著下降。本研究中, 感染鳗弧菌初期, 斑节对虾肝胰腺和鳃中 T-AOC活性呈上升趋势, 表明鳗弧菌感染诱导对虾机体免疫反应产生ROS以杀灭病原菌, 从而激活机体抗氧化酶系统, 使得 T-AOC酶活性显著升高; 感染鳗弧菌后期, 肝胰腺和鳃中T-AOC活性逐渐下降, 可能弧菌的大量繁殖抑制了机体抗氧化酶活性, 机体因累积大量 ROS而导致组织细胞受损, 抗氧化防御系统下降。此外有研究表明,ROS在机体过度积累可能会导致细胞呼吸障碍, 引发细胞凋亡或坏死[15]。但本研究中鳗弧菌感染是否会造成斑节对虾组织细胞凋亡或坏死, 可能需要通过组织切片以及细胞凋亡相关基因如 Caspase等的表达变化进行分析。
3.2 鳗弧菌对斑节对虾LSZ活性的影响
LSZ能够水解细菌细胞壁肽聚糖中N-乙酰葡萄糖胺与N-乙酰胞壁酸之间的 β-1, 4-糖苷键, 从而杀灭病原菌[19-20]。王雷等[21]对中国对虾血淋巴溶菌活力的研究表明, 溶菌活力可以作为衡量对虾机体的免疫功能状态的监测指标。陈萍等[13]研究表明, 三疣梭子蟹感染溶藻弧菌24h, 其血淋巴和肝胰腺中LSZ活性显著高于对照组, 48和72 h活性显著下降。此外, 弧菌还可显著诱导 LSZ基因的表达。斑节对虾感染哈维弧菌(Vibrio harvyi)后, 其血细胞中LSZ基因表达量于12和24 h显著升高[22]。罗词兴等[23]用不同剂量的溶藻弧菌感染凡纳滨对虾(Litopenaeus vannamei), 发现高剂量组对虾鳃中LSZ基因表达上调时间较早, 且表达量显著高于低剂量组。
本研究中, 感染鳗弧菌后的斑节对虾肝胰腺和鳃中LSZ活性分别于6和12 h上升至最大值, 可能是鳗弧菌感染诱导对虾非特异性免疫反应合成大量抗菌蛋白和溶菌蛋白, 用于清除侵入机体的鳗弧菌,使得溶菌酶活性升高, 表明 LSZ活性升高是对虾机体应对病原菌侵染的一种防御机制。但是, 感染鳗弧菌后24 h, 斑节对虾肝胰腺和鳃中LSZ活性均显著低于对照组, 可能是该时期对虾处于感染后的恢复期, 而弧菌大量繁殖导致机体细胞受到损伤, 抑制了 LSZ活性。因而推测, 适量的低剂量鳗弧菌灭活或减毒疫苗可以提高对虾的抗弧菌感染能力, 但仍需进一步的验证。
3.3 鳗弧菌对斑节对虾NO含量和iNOS活性的影响
NO是一种生物自由基, 其主要由一氧化氮合酶(NOS)催化产生, 具有抑制脂质过氧化、清除氧自由基的作用[24]。NO能够通过抑制代谢酶活性或使其失活、与氧自由基结合生成强氧化剂等方式杀死病原体[25]。根据免疫克隆和对钙离子的依赖性, NOS主要包括 3种: 神经型(nNOS)、结构型(cNOS)和诱导型(iNOS)。iNOS主要存在于吞噬细胞中, 可以被多种细胞因子(干扰素、白介素和肿瘤坏死因子等)、病原体(细菌和病毒等)及免疫刺激物(脂多糖)等激活, 催化L-精氨酸产生NO以及不同类型的活性氮中间体,起到免疫防御作用[11]。
研究表明, NO与iNOS在虾类免疫反应中具有重要作用。姜建国等[26-27]证明对虾血细胞中存在NOS活性, 并利用 WSSV对中国对虾进行感染, 发现其能显著诱导中国对虾血细胞iNOS活性升高, 随着WSSV在机体内的大量增殖导致iNOS活性显著降低, 对虾趋于死亡, 由此认为iNOS可以作为对虾健康状况的监测指标。冀培丰[25]研究表明, 凡纳滨对虾感染副溶血弧菌和WSSV后, 其组织NOS的基因表达量和酶活性均显著降低, 表明NOS可能在对虾抵抗病原入侵的免疫防御中发挥重要作用。本研究中, 斑节对虾肝胰腺和鳃中NO含量与iNOS活性于感染鳗弧菌后12 h显著升高, 表明鳗弧菌感染诱导iNOS活性提高, 产生大量NO以抵抗鳗弧菌对机体的感染; 感染后期 NO含量与 iNOS活性显著降低,可能与机体免疫系统受损有关。此外, 有相关报道表明, NO和iNOS的作用发挥不具有特异性, 可以与超氧阴离子生成强氧化剂, 长时间的高含量会对机体自身产生毒害作用[28-29]。本研究中, 鳗弧菌感染后期T-AOC活性的降低可能与机体活性氧不能及时完全清除有关, 而 NO是否与机体活性氧一起加速损坏斑节对虾免疫系统, 有待更深入的研究进行阐明。
综上所述, 鳗弧菌感染对斑节对虾免疫相关指标T-AOC、LSZ和iNOS活性和NO含量的影响显著;斑节对虾T-AOC、LSZ、iNOS和NO对鳗弧菌感染反应较为敏感, 可以作为斑节对虾弧菌病诱发的监测指标; 不同免疫指标对鳗弧菌感染的应答反应有所差异, 主要与其功能有关。本研究可以为对虾应答弧菌感染的免疫机制研究提供重要的理论参考。
[1] 杨其彬, 姜松, 黄建华, 等.斑节对虾的饥饿试验和补偿生长[J].南方水产科学, 2013, 9(5): 25-31.
[2] 杨其彬, 温为庚, 黄建华, 等.斑节对虾4个不同群体建立家系的生长及成活[J].南方水产, 2010, 6(3): 36-40.
[3] Panakorn S. Opinion article: more on early mortality syndrome in shrimp[J]. Aquaculture Asia Pacific, 2012,8(1): 8-10.
[4] Joshi J, Srisala J, Truong V H, et al. Variation inVibrio parahaemolyticusisolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND)[J]. Aquaculture, 2014, 428:297-302.
[5] Duan Y F, Liu P, Li J T, et al. Expression profiles of selenium dependent glutathione peroxidase and glutathione S-transferase fromExopalaemon carinicaudain response toVibrio anguillarumand WSSV challenge[J].Fish Shellfish Immunol, 2013, 35(3): 661-670.
[6] 葛端阳, 赵婷, 潘宝平.鳗弧菌(Vibrio anguillarum)对青蛤(Cyclina sinensis)的毒性及半致死浓度研究[J].海洋与湖沼, 2012, 43(6): 1192-1195.
[7] 苏永腾, 刘波, 周群兰, 等.大黄蒽醌提取物对罗氏沼虾抗鳗弧菌感染的研究[J].水产学报, 2008, 32(3):455-463.
[8] 段亚飞, 张家松, 董宏标, 等.副溶血弧菌对斑节对虾非特异性免疫酶活性的影响[J].水产学报, 2014,38(9): 1557-1564.
[9] Wu F J, Xue Y, Liu X F, et al. The protective effect of eicosapentaenoic acid-enriched phospholipids from sea cucumberCucumaria frondosaon oxidative stress in PC12 cells and SAMP8 mice[J]. Neurochemistry International, 2014, 64: 9-17.
[10] Xu S L, Wang D L, Jia C Y, et al. Effects ofVibrio alginolyticusinfection on immune-related enzyme activities and ultrastructure ofCharybdis japonicagills[J]. Aquaculture, 2013, 396: 82-88.
[11] Yao C L, Ji P F, Wang Z Y, et al. Molecular cloning and expression of NOS in shrimp,Litopenaeus Vannamei[J].Fish Shellfish Immunol, 2010, 28(3): 453-460.
[12] Chen T, Wong N K, Jiang X, et al. Nitric oxide as an antimic robial molecule againstVibrio harveyiinfection in the hepatopancreas of Pacific white shrimp,Litopenaeus vannamei[J]. Fish Shellfish Immunol,2015, 42(1): 114-120.
[13] 陈萍, 王清印, 李健, 等. 溶藻弧菌对三疣梭子蟹溶菌酶和磷酸酶活性的影响[J]. 渔业科学进展, 2009,30(2): 78-82.
[14] 丁金强, 刘萍, 李健, 等.不 同地理群体日本 蟳非特异性免疫及抗氧化酶活力的比较[J].水产学报, 2013,37(2): 275-280.
[15] 王芸, 李健, 李吉涛, 等.pH 胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响[J].中国水产科学,2011, 18(3): 556-564.
[16] Gilgun-Sherki Y, Rosenbaum Z, Melamed E, et al.Antioxidant therapy in acute central nervous system injury: current state[J]. Pharmacological Reviews, 2002,54: 271-284.
[17] 葛倩倩.鳗弧菌感染对 Imd免疫通路相关基因表达及非特异性免疫因子的影响[D].青岛: 中国海洋大学,2013.
[18] 陈萍, 李吉涛, 李健, 等.溶藻弧菌对三疣梭子蟹抗氧化酶系统的影响[J].海洋科学, 2009, 33(5): 59-63.
[19] Yao C L, Wu C G, Xiang J H, et al. The lysosome and lysozyme response in Chinese shrimpFenneropenaeus chinensistoVibrio anguillarumand laminarin stimulation[J]. J Experimental Marine Biol Ecol, 2008,363(1-2): 124-129.
[20] 姬南京, 杨芸菲, 丁君, 等.虾夷马粪海胆溶菌酶基因全长 cDNA的克隆与表达分析[J].中国水产科学,2013, 20(5): 950-957.
[21] 王雷, 李光友, 毛远兴.中国对虾血淋巴中的抗菌、溶菌活力与酚氧化酶活力的测定及其特性研究[J].海洋与湖沼, 1995, 26(2): 179-185.
[22] Supungul P, Rimphanitchayakit V, Aoki T, et al.Molecular characterization and expression analysis of a c-type and two novel muramidase-deficient i-type lysozymes fromPenaeus monodon[J]. Fish Shellfish Immunol, 2010, 28(3): 490-498.
[23] 罗词兴, 黄旭雄, 李桑, 等.溶藻弧菌感染后凡纳滨对虾鳃组织免疫相关基因的表达[J].中国水产科学,2014, 21(1): 189-196.
[24] 谢建军, 许文军, 施慧, 等.溶藻弧菌诱导对三疣梭子蟹血淋巴非特异性免疫水平的影响[J].水产学报,2011, 35(9): 1392-1398.
[25] 冀培丰.一氧化氮合酶及其相关因子在凡纳滨对虾免疫反应中特性的研究[D].厦门: 集美大学, 2010.
[26] 姜国建, 于仁诚, 王云峰, 等.对虾血细胞中一氧化氮合成酶鉴定与分析方法研究[J].中国水产科学,2004, 11(3): 177-184.
[27] 姜国建, 于仁诚, 王云峰, 等.中国明对虾血细胞中一氧化氮合成酶的鉴定及其在白斑综合症病毒感染过程中的变化[J].海洋与湖沼, 2004, 35(4): 342-350.
[28] Hillyer J F, Estévez-Lao T Y. Nitric oxide is an essential component of the hemocyte-mediated mosquito immune response against bacteria[J]. Dev Comp Immunol, 2010, 34(2): 141-149.
[29] 朱宏友, 余德光, 王广军, 等.副溶血弧菌、脂多糖和嗜酸小球菌对凡纳滨对虾血清一氧化氮合酶的影响[J].热带海洋学报, 2006, 25(1): 27-32.

