妊娠期肝内胆汁淤积症患者糖脂代谢特点及其围产结局的观察
李嘉蔚 牛建民 周 平 洪小山 郑 瑛 饶美兰
广东省妇幼保健院产科(广州,510010)
妊娠期肝内胆汁淤积症(ICP)为妊娠期特有的疾病,临床上主要表现为皮肤瘙痒和黄疸,该病对孕妇影响较小,主要影响胎儿,可造成胎儿宫内窘迫、早产、新生儿窒息,甚至死胎、死产。围产儿发病率及死亡率较高,属于高危妊娠之一[1]。目前研究认为,妊娠期ICP是由多种因素共同作用形成的,各因素相互依存、相互影响。有报道提示,在ICP患者中胆汁酸是造成胎儿窘迫、死胎及早产的主要原因[2]。国外研究发现,ICP孕妇血清中血糖、血脂浓度明显升高,认为该病与糖耐量减低及血脂代谢障碍有关[3]。ICP孕妇较正常孕妇更易出现胎膜早破、剖宫产、产后出血、子痫前期等[4-5],而妊娠期糖尿病同样也会引起这些并发症[6]。目前对于ICP患者的糖代谢情况国内少见报道。本文对于早发型和晚发型ICP的糖脂代谢特点及围产结局进行回顾性分析,报告如下。
1 资料与方法
1.1 临床资料
2014年4~12月本院正规产检分娩孕妇9826例,其中ICP患者183例(1.86%)。合并高血压、糖尿病、肝胆疾病等ICP患者86例,其中早发型30例(早发型组),晚发型56例(晚发型组)。选取同期在本院正规产检并分娩的健康孕妇60例为对照组。
1.2 ICP诊断标准
参考中华医学会妇产科分会产科学组2015年颁布的诊断指南。临床症状:①出现其他原因无法解释的皮肤瘙痒:瘙痒涉及手掌和脚掌,瘙痒严重导致皮肤抓痕,需与其他妊娠期皮肤疾病鉴别。② 空腹血总胆汁酸水平≥10μmol/L或血甘胆酸水平升高≥5.61μmol/L。③胆汁酸水平正常有其他原因无法解释的肝功能异常,主要是血清丙氨酸转氨酶和天冬氨酸转氨酶水平轻、中度升高,谷氨酰转肽酶水平也可升高,可伴血清胆红素水平升高,以直接胆红素为主。④皮肤瘙痒和肝功能异常在产后恢复正常,皮肤瘙痒多在产后24~48h消退,肝功能在分娩后4~6周恢复正常[7]。发病孕周<28周为早发型ICP,≥28周为晚发型ICP[8]。
1.3 观察指标及方法
收集纳入对象28孕周门诊产检时空腹血糖(FPG)、空 腹 胰 岛 素 (FINS)、糖 化 血 红 蛋 白(HbA1c)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、载脂蛋白A(ApoA)和载脂蛋白B(ApoB)检测结果。其中FINS和HbA1c采用化学发光法检测,血脂和空腹血糖采用比浊法检测。围产结局指标包括分娩孕周、早产、剖宫产、羊水II度以上污染、产后出血量、新生儿窒息、新生儿出生体重、胎死宫内等。
1.4 统计学分析
采用SPSS17.0统计包软件进行数据统计和处理。计量资料以均数±标准差表示,采用单因素方差分析;组间比较使用SNK法检验,计数资料比较采用卡方检验,P<0.05为有统计学意义。
2 结果
2.1 一般资料
3组孕妇在年龄、产次、民族、地域等方面差异无统计学意义(P>0.05)。见表1。
2.2 血清糖脂水平比较
3组血清糖脂水平除HbA1c外,其他各值差异均有统计学意义(P<0.05)。进一步两两比较,ICP各组血清FPG、FINS、TG、TC、LDL-C、ApoB水平均高于对照组,HDL-C、ApoA和ApoA/ApoB均低于对照组,差异均有统计学意义(P<0.05);早发型组FPG、FINS、TG、TC、LDL-C和ApoB水平均高于晚发型组,而HDL-C和ApoA/ApoB均低于晚发型组,差异有均有统计学意义(P<0.05)。见表2。
2.3 围产结局比较
所有ICP孕妇经降胆汁酸、护肝等治疗,根据孕周和病情选择合适的分娩时机和分娩方式终止妊娠。早发型组和晚发型组剖宫产率、早产率、羊水污染率、产后出血量、新生儿窒息率均高于对照组(P<0.05),分娩孕周及新生儿出生体重均低于对照组(P<0.05)。早发型组早产率、羊水污染率、新生儿窒息率均高于晚发型组(P<0.05),新生儿出生体重则低于晚发型组(P<0.05)。所有孕妇均未出现胎死宫内情况。见表3。
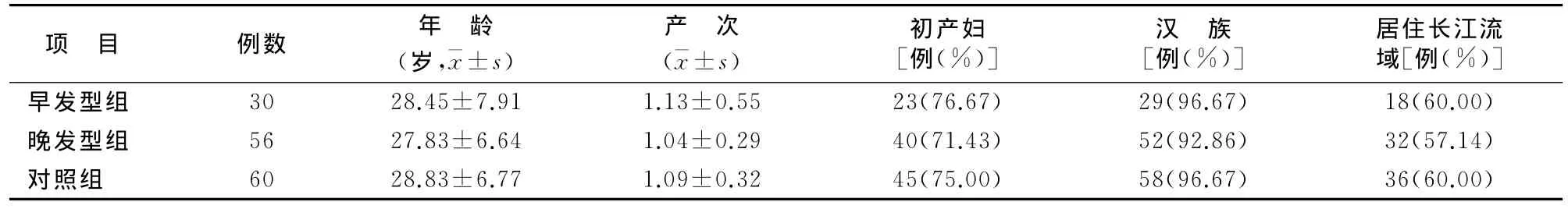
表1 3组孕妇一般资料比较
表2 3组孕妇血清糖脂水平比较(±s)
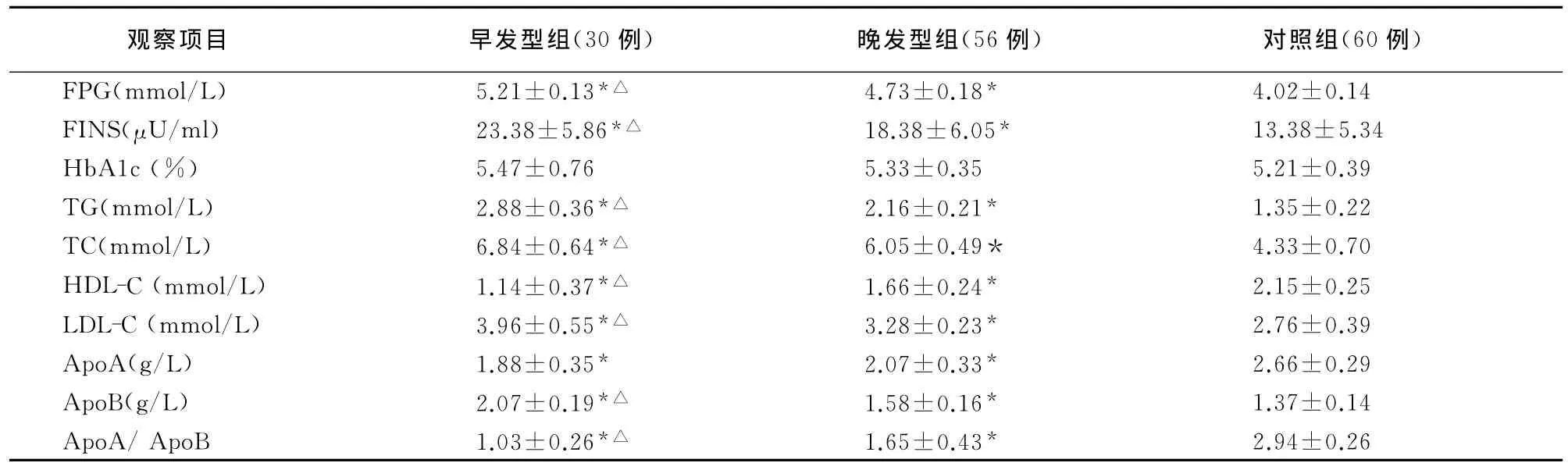
表2 3组孕妇血清糖脂水平比较(±s)
*与对照组相比P <0.05△与晚发型组相比P<0.05
观察项目 早发型组(30例) 晚发型组(56例) 对照组(60例)FPG(mmol/L) 5.21±0.13*△4.73±0.18*4.02±0.14 FINS(μU/ml) 23.38±5.86*△18.38±6.05*13.38±5.34 HbA1c(%) 5.47±0.76 5.33±0.35 5.21±0.39 TG(mmol/L) 2.88±0.36*△2.16±0.21*1.35±0.22 TC(mmol/L) 6.84±0.64*△6.05±0.49* 4.33±0.70 HDL-C(mmol/L) 1.14±0.37*△1.66±0.24*2.15±0.25 LDL-C(mmol/L) 3.96±0.55*△3.28±0.23*2.76±0.39 ApoA(g/L) 1.88±0.35*2.07±0.33*2.66±0.29 ApoB(g/L) 2.07±0.19*△1.58±0.16*1.37±0.14 ApoA/ApoB 1.03±0.26*△1.65±0.43*2.94±0.26

表3 3组孕妇围产结局比较
3 讨论
3.1 ICP分型的意义
ICP是妊娠期特有的高危疾病之一,其发病机制尚未完全阐明,目前认为与雌激素水平、地域差异、遗传等因素有关。该病常伴有肝功能损伤,出现的胆汁酸升高对胎儿可造成胎儿宫内猝死[9]。国内学者率先提出将ICP进行分型研究,认为早发型ICP孕妇病情严重,更易出现不良围产结局[8]。迄今为止,国内外关于早发型ICP的报道尚少,可能因早发型ICP临床症状不典型,易与其他肝脏疾病混淆有关。本研究发现,早发型组和晚发型组剖宫产率、早产率、羊水污染率、产后出血量、新生儿窒息率均显著高于对照组,分娩孕周及新生儿出生体重均低于对照组。早发型组早产率、羊水污染率、新生儿窒息率明显高于晚发型组,新生儿出生体重则低于晚发型组。可能发病孕周越早,胎儿处于高胆汁酸的环境越久,围产结局越易不良[10]。因此对ICP患者早发现,早治疗,及时终止妊娠,对减少不良围产结局有重要意义。
3.2 ICP孕妇糖代谢特点
研究认为ICP与妊娠期糖尿病有相关性,ICP孕妇比正常孕妇更易患妊娠期糖尿病[11]。Katsuma等[12]发现胆汁酸可促使肠内分泌细胞分泌胰岛素生长因子-1(GLP-1)。GLP-1能促进胰腺β细胞分泌胰岛素,从而降低血糖。但是ICP患者胆汁酸不能进入肝肠循环发挥其作用而导致糖代谢异常。本研究发现,ICP孕妇FPG和FINS水平明显高于对照组,且早发型组FPG和FINS水平高于晚发型组。由于妊娠中晚期孕妇体内拮抗胰岛素样物质增加,孕妇对胰岛素敏感性下降,出现胰岛素抵抗,血糖升高,胰岛素需求增加,胰腺细胞努力分泌更多胰岛素,但分泌量跟不上血糖的升高水平[13]。本文结果提示早发型ICP更易出现血糖代谢异常。同时,本研究发现各组孕妇血中HbA1c值无明显差异。由于HbA1c反映是近8~12周血糖控制情况,而本研究纳入者已排除糖尿病,孕妇一但血糖升高,经饮食调节、运动、注射胰岛素等措施有效控制血糖的结果。
3.3 ICP孕妇脂代谢特点
ICP常合并脂代谢异常,TC、TG、LDL、VLDL均明显高于相同妊娠周期的正常孕妇,而HDL则低于正常孕妇。目前认为ICP脂代谢紊乱的可能机制有3种:①高水平的胆酸对细胞膜有破坏作用,可致肝细胞损伤。肝脏是脂代谢的重要器官,其损伤可能导致脂代谢异常。②ICP患者雌激素水平增高或对雌激素过度敏感导致血脂增高。③胆汁酸增高可刺激前列腺素释放,引起内皮细胞功能紊乱,脂质代谢障碍[14]。ICP孕妇血脂异常可引起或加重胎盘血流灌注量不足,胎儿易发生缺氧,导致羊水污染、胎儿窘迫及新生儿并发症增多,围生儿死亡率增高,出现不良围产结局[15]。本研究结果显示,ICP孕妇血清TG、TC、LDL-C和ApoB水平高于正常孕妇,HDL-C、ApoA和ApoA/ApoB水平则低于正常孕妇,与胡超峰等[16]研究结果相似。本研究还发现早发型组TG、TC、LDL-C和ApoB水平明显高于晚发型组,HDL-C和ApoA/ApoB水平则低于晚发型组。提示早发型ICP病情较晚发型脂代谢异常更为严重。
3.4 ICP围产结局
对围产结局进行分析发现,ICP组剖宫产率、早产率、羊水污染发生率、产后出血量、新生儿窒息率均高于正常妊娠组,分娩孕周及新生儿出生体重均低于正常妊娠组,可能与ICP孕妇的糖脂代谢异常引起胎盘血管病变,胎盘功能减退,从而出现羊水污染、胎儿生长迟缓等,导致早产率、剖宫产率、新生儿窒息率及产后出血量增加。此外,对比分析两组ICP孕妇,发现早发型组早产率、羊水污染率、新生儿窒息率明显高于晚发型组,新生儿出生体重则低于晚发型组。其原因可能与早发型组的胎儿因暴露于高胆汁酸环境时间更久有关,而且为尽早让胎儿脱离母体高胆汁酸环境,在积极治疗及确定胎肺成熟的情况下,通常治疗性终止妊娠,导致早产率增加,新生儿出生体重降低。早发型ICP,更易出现糖脂代谢异常,发生不良围产结局,应引起围产医生的关注。
[1]Medina Lcraeli JM,Medina Castro N.Intrahepatic cholestasis of pre gnancy,an unpredictable fetal risk:report of a case and review of the literantre[J].Gineool Obstet Mex,2000,(68):486-488.
[2]漆洪波,邵勇,吴味辛,等.妊娠肝内胆汁淤积症分度诊断和处理的临床意义[J].中华妇产科杂志,2010,39(1):14-17.
[3]Martineau MG,Raker C,Dixon PH,et al.The Metabolic Profile of Intrahepatic Cholestasis of Pregnancy Is Associated With Impaired Glucose Tolerance,Dyslipidemia,and Increased Fetal Growth[J].Diabetes Care,in press,2014,Doi:10.2337/dc14-2143.
[4]Wikstrom SE,Marschall HU,Ludvigsson JF,et al.Intrahepatic cholestasis of pregnancy and associated adverse pregnancy and fetal outcomes:a 12-year population-based cohort study[J].BJOG,2013,120(6):717-723.
[5]Baliutaviciene D,Zubruviene N,Zalinkevicius R.Pregnancy outcomein cases of intrahepatic cholestasis of pregnancy [J].Int J Gynaecol Obstet,2011,112(3):250-251.
[6]Bener A,Al-Nufal M,Vachhani P J,et al.Maternal complications and neonatal outcome in Arab women of a fast developing country[J].J Family Community Med,2013,20(1):27-34.
[7]中华医学会妇产科分会产科学组.妊娠期肝内胆汁淤积症诊疗指南(2015)[J].中华妇产科杂志,2015,50(7):481-485.
[8]周兰,漆洪波,罗欣.早发型妊娠期肝内胆汁淤积症患者的临床生化特点及围产结局分析[J].中华妇产科杂志,2013,48(1):20-24.
[9]Khurana S1,Raufman JP,Pallone TL.Bile acids regulate cardiovascular function[J].Clin Transl Sc,2011,4(3):210-218.
[10]Yayi H,Danqing W,Shuyun L.Immunologic abnormality of intrahepatic cholestasis of pregnancy[J].AJRI,2010,63(4):267-273.
[11]Martineau M,Raker C,Powrie R,et al.Intrahepatic cholestasis of pregnancy is associated with an increased risk of gestational diabetes[J].Eur J Obstet Gynecol Reprod Biol,2014,5(176):80-85.
[12]Katsuma S,Hirasawa A,Tsujimoto G.Bile acida promoteglucagon-like peptide-1,secretionthrough TGR5in a murineenteroen-docrine cell line STC-1[J].Biochem Biophys Res Commun,2005,329(1):386-390.
[13]谢幸,够文丽.妇产科学[M]第8版.北京:人民卫生出版社,2013:75,77.
[14]徐艳,杨慧霞.妊娠期脂代谢异常及其营养治疗[J].中国实用妇科与产科杂志,2007,4(23):259-260.
[15]Dann AT,Kenyon AP,Wierzbicki AS,et al.Plasma lipid profiles of women with intrahepatic cholestasis of pregnancy[J].Obstet Gynecol,2006,107(1):106-114.
[16]胡超峰,张素英,王海娜,等.妊娠期肝内胆汁淤积及其临床意义[J].现代实用医学,2007,19(12):971-972.

