TaqMan探针熔解曲线技术检测GJB2基因突变
高慧刘晶晶沈姗姗梁少明危林耿李芳芳王沙燕
1暨南大学第二临床医学院,深圳市人民医院(深圳518020)
2亚能生物技术(深圳)有限公司(深圳518133)
·基础研究·
TaqMan探针熔解曲线技术检测GJB2基因突变
高慧1刘晶晶2沈姗姗1梁少明2危林耿2李芳芳1王沙燕1
1暨南大学第二临床医学院,深圳市人民医院(深圳518020)
2亚能生物技术(深圳)有限公司(深圳518133)
目的 建立快速可靠的TaqMan探针熔解曲线技术,分析非综合征型遗传性耳聋患者的GJB2基因及探讨TaqMan探针熔解曲线技术。方法制备标准品,利用TaqMan探针基于荧光PCR熔解曲线平台建立熔解曲线分析技术;收集138例正常人群、113例非综合征型遗传性耳聋患者及2个非综合征型遗传性耳聋家系,应用TaqMan探针熔解曲线技术分析GJB2基因最常见的35delG,176_191del16,235delC,299_ 300delAT的4个突变位点;结果利用直接测序技术加以验证。结果138例正常人群中检出2例GJB2基因突变,113例非综合征型遗传性耳聋患者中检出22例GJB2基因突变,2个耳聋家系先证者均为GJB2基因突变患者;所有检测结果均与测序结果一致。结论利用TaqMan探针建立了一种快速可靠的探针熔解曲线技术,经测序验证能准确的检测GJB2基因常见的4种突变。
遗传性耳聋;TaqMan探针;熔解曲线;GJB2基因
GJB2基因为非综合征型耳聋最常见的基因[1],先天性重度或极重度常染色体隐性遗传性非综合征型耳聋有50%以上是由GJB2基因突变引起[2],也是首个发现的常染色体隐性遗传性致聋基因,在1997年由Kelsell等[3]报道,定位于13q11-12,命名为DFNB1。目前已报道上百种突变(http://www.deafnessvariationdata⁃base.org),其 中 35delG,176_191del16,235delC,299-300delAT四个致病突变在我国最常见[4]。GJB2基因突变常常导致感音神经性耳聋,在双耳极重度耳聋中检出率最高,单耳聋少见[5]。目前,高通量测序技术已经逐渐应用于耳聋基因突变筛查[6],但临床上仍需要简单、快速、准确的基因检测方法。现收集到我国138例正常人群、113例非综合征型遗传性耳聋患者及2个非综合征型遗传性耳聋家系,利用TaqMan探针建立熔解曲线技术快速分析其GJB2基因最常见的四个突变。
1 方法的建立
1.1引物及探针设计
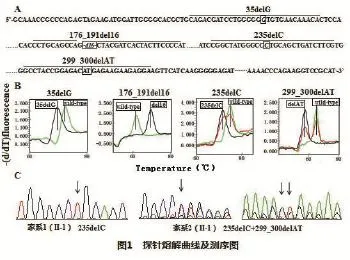
根据突变位点的位置,选择Primer5.0设计一对PCR扩增产物为404bp的引物,囊括四个突变位点;利用Oligo7.0在具体的突变位点处设计TaqMan探针,尽量使突变位置靠近探针中部,有利于探针结合及基因分型。(图1A)
1.2PCR反应体系及优化条件
根据实验要求[7],选择不对称PCR,富集探针结合的DNA单链。反应体系:1×buffer,2.5U Taq酶,2.5U Taq Antibody,3.0mmol/μl MgCl2,200μmol/μl dNTPs,上游引物0.4μmol/μl,下游引物0.04μmol/μl,各TaqMan探针0.4μmol/μl,20ng DNA(50000 copies质粒),加蒸馏水补至25μl。优化条件:第一步PCR扩增:95℃预变性5min;94℃30s,58℃30s,72℃30s,40个循环;第二步熔解曲线:95℃1min,40℃1min,以0.01℃/S的升温速率从40℃升至85℃并每升高1℃收集 10次荧光。仪器选择:Roche LightCy⁃cler480-Ⅱ。
1.3标准品制备及绘制标准曲线
35delG,176_191del16,235delC,299_300delAT均位于GJB2基因的exon2上,按照文献所述选择优化好的引物及PCR反应程序对GJB2基因exon2部分扩增[8],送至上海旭冠生物科技发展有限公司进行克隆及构建突变位点,并测序验证质粒构建的准确性。应用探针熔解曲线技术分析野生型及突变型质粒,并绘制标准曲线。
2 方法的验证与家系分析
2.1临床资料
收集来自深圳市人民医院就诊的138例听力正常人群、113例已确诊为非综合征型遗传性耳聋患者及2个非综合征型遗传性耳聋家系(图2)。其中家系1共4人;先证者,女,3岁,在1岁时发现听力下降,现佩戴助听器补偿听力损失;其妹妹在6个月听力检测出现异常;家系2共3人,先证者,男,9个月发现对声音反应差。2个家系均无家族病史及氨基糖苷类抗生素使用史,父母均无听力障碍。

2.2家系耳科检查
对2个非综合征型遗传性耳聋家系7位成员进行纯音听阈测试。不能进行纯音听力检查的婴幼儿,选择多频稳态反应(ASSR)进行检测。按照世界卫生组织(WHO-1997)听力残疾分级标准进行听力损失的严重程度分级:轻度(26-40dB HL),中度(41-60dB HL),重度(61-80dBHL),极重度(≥81dBHL)[9]。
2.3DNA提取
选用EDTA-K2真空抗凝管采集所有受试者的外周血2-3m l,按照QIAamp DNA(德国QIAGEN公司)抽提试剂盒的操作步骤说明书提取DNA。利用Nanodrop 2000对提取的DNA进行纯度及浓度检测,并稀释备用。
2.4方法验证
利用已建立的探针熔解曲线技术及绘制的标准曲线,分析所有受试者的GJB2基因常见的四种突变;并运用ABI3130DNA全自动测序仪,按照文献报道方法[8]对GJB2基因进行直接测序,所得结果与探针熔解曲线技术分析结果进行比对验证。
3 结果
3.1方法验证的结果
建立了GJB2基因4个突变位点的标准熔解曲线,利用Tm值的不同,成功的完成基因突变筛查(图1B)。138例正常人群中检出2例携带235delC杂合突变。113例非综合征型遗传性耳聋患者中检出22例突变,其中1例176_191del16突变,16例235delC突变,3例299_300delAT突变及2例235delC与299_ 300delAT复合杂合突变。家系1与家系2均检测出GJB2基因突变(表1)。利用直接测序技术对所有受试者进行复检,结果与探针熔解曲线技术所得结果均一致(图1C)。
3.2家系分析的结果
家系1先证者(II-1)检出235delC纯合突变(表1),双耳听力损失均在80dBHL以上。按照世界卫生组织(WHO-1997)听力残疾分级标准[9]可知,听力损失≥81dBHL属于极重度耳聋,家系1先证者(II-1)佩戴助听器后显示左耳平均助听听阈约54dB,右耳平均助听听阈约48dB(图3);其妹妹(II-2)同为235delC纯合突变,也表现为双耳极重度感音神经性耳聋;其父母均为235delC杂合突变,临床表型正常。家系2先证者(II-1)为235delC/299_300delAT双重杂合突变,双耳听力损失在90dBHL以上,为极重度感音神经性耳聋;其父母临床表型正常,分别携带235delC杂合突变与299_300delAT杂合突变(表1)。

4 讨论
耳聋是人类生活中常见的致残性疾病,约60%由遗传因素导致[1],其中GJB2基因突变最常见,我国GJB2基因的突变率可达约20%[5]。本研究中GJB2基因在非综合征型遗传性耳聋患者中检出率为19.4%。目前我国 GJB2基因有 35delG,176_ 191del16,235delC及299_300delAT四种常见的突变,其中235delC最常见[1,4],常常导致双耳极重度感音神经性耳聋[5];两个家系I-1与I-2均为235delC或者299_300delAT单纯杂合突变,其临床表型正常;而先证者为纯合突变或复合杂合突变,听力检测均为双耳极重度耳聋。GJB2基因单纯杂合突变一般不致病但能增加致聋风险。Abe等[10]2001年报道在23个mtD⁃NA 12SrRNA的1555A>G突变的迟发型渐进性日本耳聋家系中发现8个家系携带GJB2基因突变,提出GJB2基因突变是除氨基糖苷类抗生素外,另一个促进听力损失的重要因素,可见对耳聋患者的GJB2基因筛查是十分重要的。本研究家系1先证者(II-1)在1岁时发现听力受损选择佩戴助听器补偿听力,左耳平均听阈约由93dB补偿为54dB,右耳平均听阈约由90dB补偿为48dB;听力由最初的极重度转为中度听力受损(图3),使患者能够听到部分语音,一定程度帮助患者语言学习,减小听力损失对语言发育及心智成长的影响。由于助听器对极重度耳聋治疗效果较差,对于该类患者国内外首选人工耳蜗植入治疗,尤其是GJB2基因突变[11,12]。Green等研究美国92例接受人工耳蜗植入及与GJB2基因相关的先天性聋儿,认为GJB2基因突变致聋进行人工耳蜗植入康复效果优于其他先天性耳聋及非接受人工耳蜗植入治疗的患者[11]。我国学者也提出GJB2基因相关性耳聋人工耳蜗植入效果优于非GJB2基因相关性耳聋,其平均助听听阈可达30.1±4.2 dB[12],能够使患者获得较好的听力补偿。
本研究利用普通的TaqMan探针基于荧光PCR平台成功建立了探针熔解曲线技术,并快速准确的分析GJB2基因4个突变位点,结果与测序分析一致。熔解曲线分析技术早在上个世纪70年代已被提出[13],其利用染料或者探针分析不同双链DNA的解链温度(Tm),从而快速准确的获得基因分型[7]。染料熔解曲线法是选用SYBRGreen I或者LCGreen Plus荧光染料进行已知或者未知基因筛查[14];其中SYBR Green I为传统的不饱和染料,在DNA双链解链过程中易发生重排造成结果失真;并且分辨率较低,只能检测小片段的变异[14,15];相反,LCGreen Plus等饱和染料为高分辨率染料,能分辨相差1bp的纯合子与杂合子[14]。染料能与所有双链DNA结合,无特异性,不能精确定位基因变化位置;然而探针熔解曲线法将染料改为荧光探针,探针能与DNA序列特异性结合,加上不同荧光染料标记,即可充分利用荧光PCR仪的通道实现多基因多突变的定性检测[7]。近几年探针熔解曲线法已逐渐应用于临床疾病的检测中,现已能利用荧光PCR所有通道快速检测G6PD基因16个突变位点[16],β-地中海的24个突变位点[17]等等。Sanger测序技术是基因诊断的金标准,但由于其仪器昂贵,耗时长,需经过2次PCR反应2次纯化等繁琐的步骤,一直难以在临床普及,特别是基层医院。本研究利用普通的荧光PCR仪器,成本较低,且只需一次PCR反应,3h内即可完成结果分析。经实验验证,该技术分析结果与Sanger测序技术分析结果基本一致,但比测序技术更省钱,省时,省力,更易于在临床普及,是一种快速准确的基因筛查及基因分型技术。
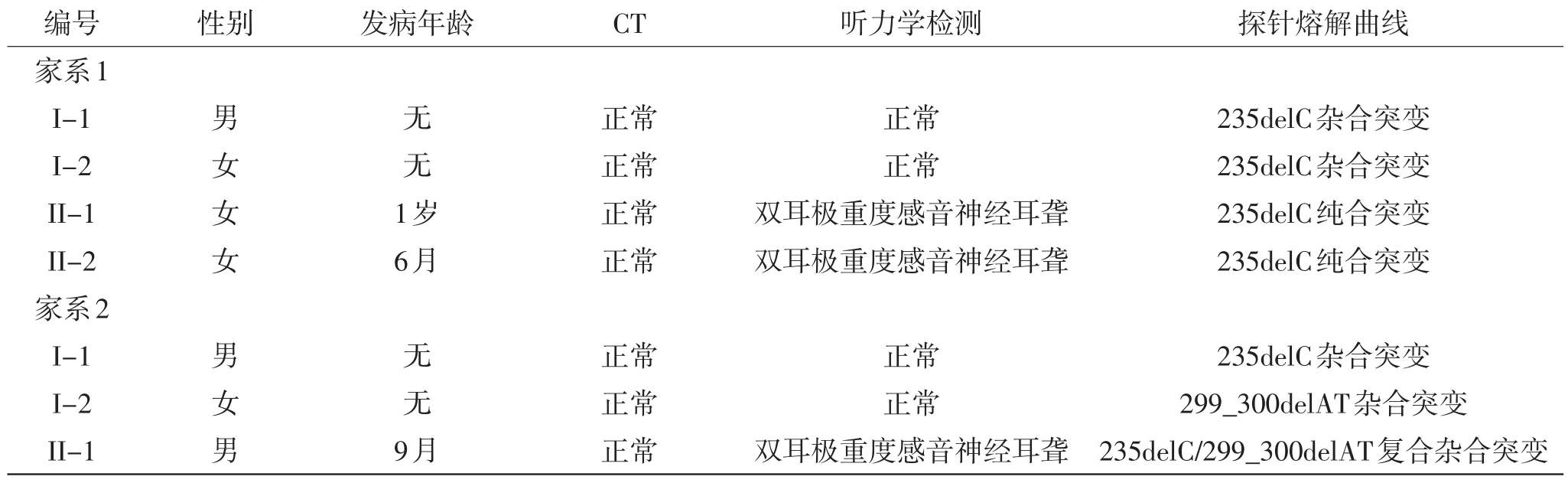
表1 非综合征型遗传性耳聋家系分析
1Dai P,Yu F,Han B,etal.The prevalence of the 235delCGJB2mu⁃tation in a Chinese deaf population.[J].Genet Med,2007,9(5): 283-289.
2Maeda Y,Fukushima K,Nishizaki K,etal.In vitro and in vivo sup⁃pression ofGJB2 expression by RNA interference.[J].Hum MolGen⁃et,2005,14(12):1641-1650.
3Kelsell D P,Dunlop J,Stevens H P,et al.Connexin 26mutations in hereditary non-syndromic sensorineural deafness.[J].Nature,1997, 387(6628):80-83.
4Dai P,Yu F,Han B,et al.GJB2 mutation spectrum in 2,063 Chi⁃nese patients with nonsyndromic hearing impairment.[J].J Transl Med,2009,7:26.
5代志瑶,孙宝春,黄莎莎,等.GJB2基因听力学表型与基因型关系分析[J].中华耳科学杂志,2014,12(1):34-36.
6Shearer A E,Deluca A P,Hildebrand M S,etal.Comprehensive ge⁃netic testing for hereditary hearing loss usingmassively parallel se⁃quencing.[J].Proc Natl Acad SciUSA,2010,107(49):21104-21109.
7Huang Q,Liu Z,Liao Y,etal.Multiplex fluorescencemelting curve analysis for mutation detection with dual-labeled,self-quenched probes.[J].PLoSOne,2011,6(4):e19206.
8项延包,沈姗姗,林一,等.常染色体隐性遗传耳聋家系的诊断和产前诊断[J].中华耳科学杂志,2012,10(3):360-363.
9孙喜斌.第二次全国残疾人抽样调查听力残疾标准的制定[J].中国听力语言康复科学杂志,2007(1):10-13.
10 Abe S,Kelley PM,KimberlingW J,et al.Connexin 26 gene(GJB2) mutation modulates the severity of hearing loss associated with the 1555A>G mitochondrialmutation.[J].Am JMed Genet,2001,103 (4):334-338.
11Green G E,Scott D A,Mcdonald JM,etal.Performance of cochlear implant recipientswith GJB2-related deafness.[J].Am JMed Genet, 2002,109(3):167-170.
12蔡超婵,黄莎莎,高雪,等.GJB2相关非综合征性感音神经性聋人工耳蜗植入后的疗效观察[J].临床耳鼻咽喉头颈外科杂志, 2014,28(13):972-974.
13Guttmann T,Vitek A,Pivec L.High resolution thermal denaturation ofmammalian DNAs.[J].Nucleic Acids Res,1977,4(2):285-297.
14 Montgomery J,Wittwer C T,Palais R,et al.Simultaneousmutation scanning and genotyping by high-resolution DNA melting analysis. [J].NatProtoc,2007,2(1):59-66.
15 Herrmann M G,Durtschi JD,Bromley L K,et al.Amplicon DNA melting analysis formutation scanning and genotyping:cross-plat⁃form comparison of instruments and dyes.[J].Clin Chem,2006,52 (3):494-503.
16严提珍,钟青燕,唐宁,等.多色探针荧光PCR熔解曲线法在G6PD基因突变检测中的临床应用评价[J].中华医学遗传学杂志,2014,31(2):156-162.
17 Xiong F,Huang Q,Chen X,et al.A melting curve analysis--based PCR assay for one-step genotyping of beta-thalassemiamutations a multicenter validation.[J].JMolDiagn,2011,13(4):427-435.
Diagnosisof hereditary deafessw ith GJB2 genemutationsbased on TaqM an probemelting curve technology
GAOHui1,LIU Jingjing2,SHENShanshan1,LIANGShaoming2,WEILingeng2,LIFangfang1,WANGShayan1
1Second clinicalmedical collegeof Jinan University,Shenzhen People'sHospital,Shenzhen 518020,China
2Yaneng Bioscience(Shenzhen)Co.ltd.Shenzhen 518133,China
Corresponding author:WANGShayan.E-mail:shayanw@yahoo.com
Objective To establish a quick and reliable TaqMan probe melting curve technology to be used for analyzing the GJB2 gene in patientsw ith non-syndrom ic hearing impairment(NSHⅠ).M ethods Standard sampleswere prepared to establish the TaqMan probemelting curve technology based on qPCR.Samples were then collected from 138 normal individuals,113 patients and 2 fam iliesw ith NSHⅠto test 35delG,176_ 191del16,235delC,299_300delATmutationsof the GJB2 gene using the TaqMan probemelting curve technology.Test resultswere verified by direct DNA sequencing.Result Two of the 138 normal individuals,22 of the 113NSHⅠpatientsand both NSHⅠfamilieswere shown to carry GJB2 genemutations.All resultswere consistentw ith those by directDNA sequencing.Conclusion A quick and reliable TaqMan probemelting curve technology hasbeen established and shown to be capableof detecting 4mutationsof theGJB2 gene.
hereditary deafness;TaqMan probe;melting curve;GJB2 gene
R394.34
A
1672-2922(2015)03-541-04
10.3969/j.issn.1672-2922.2015.03.037
2013年深圳市战略新兴产业发展专项资金(CXZZ20130517143111780)
高慧,硕士研究生,研究方向:医学遗传学。
王沙燕,E-mail:shayanw@yahoo.com
2015-5-6 审核人:郭维维)

