Micro-CT 评价Runx2 基因修饰的骨髓间充质干细胞静脉移植促进缺血性股骨头坏死兔坏死股骨头修复效果
许海甲,李章华,侯煜东,方卫军,唐欢
武汉大学 人民医院,湖北 武汉 430060
缺血性股骨头坏死(ascular necrosis of femoral head,ANFH)是临床上的常见多发病,主要见于中青年患者,其致残率高,远期预后较差[1]。目前临床上有多种治疗ANFH的方法,包括物理治疗、髓芯减压、旋转截骨、带或不带血管蒂的骨移植、介入治疗等[2],但上述方法的治疗效果有限,最终难以避免股骨头塌陷,须行髋关节置换术。近年来骨髓间充质干细胞(mesenchymal stem cells,MSCs)移植治疗ANFH的研究被广泛开展,甚至用于临床治疗,取得了一定的治疗效果[3],然而在评价股骨头坏死后病灶改变及治疗修复程度上缺少成熟有效的方法,普通CT、MRI 检测仅能观察较大范围的骨形态及骨性质改变,常用的Harris 评分和目测类比评分等方法容易受主观因素影响且无法用于实验动物。Micro-CT作为一种新的影像学检测技术,分辨率可达微米级,能清晰显示出骨骼中骨小梁等微观结构,对ANFH标本骨小梁等微结构变化具有极高的敏感性[4]。在本研究中,我们通过Micro-CT 来评价Runx2基因修饰MSCs 静脉移植促进ANFH 的修复效果,为应用Micro-CT观察股骨头坏死修复过程提供实验基础。
1 材料和方法
1.1 材料
雄性大耳白兔24只,体重(1.5±0.25)kg,由军事医学科学院实验动物中心提供(SCXK(京)2007-0003),单笼饲养,自由饮水。24 只大耳白兔ANFH造模后随机分为4 组,A 组为AdEasy/Runx2修饰的MSCs静脉植入组,B组为Runx2siRNA修饰的MSCs静脉植入组,C组为单纯MSCs静脉植入组,D组为生理盐水植入组。
兔MSCs 由军事医学科学院基础医学研究所化学与分子生物学实验室提供;AdEasy/Runx2由前期实验构建成功[5];Western印迹检测用anti-Cbfa1多克隆抗体(LifeSpan BioSciences 公司),anti-GAPDH 多克隆抗体、羊抗兔二抗(康为世纪公司);Real-time PCR 检测试剂盒(Kapa 公司);TRIzol 裂解液(Sigma公司);蛋白抽提试剂(Fermentas 公司);低糖型DMEM 培养基(L-DMEM)、胎牛血清(Gibico 公司);青霉素、链霉素(华北制药股份有限公司);胰蛋白酶(Amresco 公司);乌拉坦(国药集团化学试剂有限公司);兔Runx2反义核苷酸siRNA(上海吉玛公司,正义链5'-CACGCUAUUAAAUCCAAAUTT-3',反义链5'-AUUUGGAUUUAAUAGCGUGTT-3');PCR 引 物(北京生工公司)。
二氧化碳培养箱(Thermo Scientific 公司);超净工作台(北京长城公司);台式高速离心机(Eppebdorf 公司);实时荧光定量PCR 仪(Stratagene 公司);免疫酶联仪(Lab System公司);蛋白电泳仪(BioRad公司);紫外分光光度计(Pharmacia公司);Micro-CT(Siemens公司)。
1.2 兔ANFH模型的建立
参考崔西龙等[6]的方法建立ANFH模型。用5%乌拉坦按1 mg/kg 的剂量行腹腔注射麻醉,先取俯卧位髋部外侧切口,以大转子处为中心切开皮肤约4 cm,分离臀部肌肉,显露髋关节,切开关节囊,用液氮冷冻至股骨头表面关节软骨呈石膏色,冷冻结束后立即用37℃的生理盐水将股骨头复温3 min,逐层缝合伤口,缝合皮下组织及皮肤。再取仰卧位,沿腹股沟做切口约2 cm,显露旋股内外侧动脉,分离并结扎旋股内外侧动脉,缝合伤口。术后每天用碘酒消毒手术切口2 次,注射青霉素40 万U/d,连续5 d。
1.3 MSCs体外Runx2基因修饰
取MSCs于25 mL细胞培养瓶中传代扩增,至一定数量后,将细胞分为3 组:①转染AdEasy/Runx2组;②转染Runx2siRNA组;③单纯细胞组。待细胞生长融合至70%~80%时,弃培养液,换为无血清LDMEM 培养液,第①组细胞转入6×106IU AdEasy/Runx2,第②组细胞转入250 pmolRunx2siRNA,第③组细胞不做处理,所有细胞在5% CO2、37℃孵箱中培养24 h后换完全培养液。
1.4 Western 印迹检测基因修饰后Runx2 蛋白的表达水平
收集细胞于EP管,用80 μL蛋白提取液提取约1×106细胞总蛋白,冰浴裂解30 min,4℃、12 000 r/min离心15 min,取上清用BCA法定量蛋白,加蛋白上样缓冲液煮沸5 min,取40 μg 蛋白行蛋白电泳,浓缩胶80 V 电压、分离胶120 V 电压,100 V 电压60 min 电转蛋白至PVDF 膜,用5%脱脂奶封闭60 min,加一抗1∶1000 稀释后孵育60 min,用TBST 洗膜5 min×3 次,加二抗1∶8000 稀释后孵育60 min,用TBST洗膜5 min×3次,化学发光成像系统成像。
1.5 Real-time PCR 检测基因修饰后Runx2 mRNA的表达水平
收集细胞于EP 管,约1×106个细胞加1 mL TRIzol 裂解液,按Sigma 公司提供的说明书提取总RNA,紫外分光光度计定量RNA,取1 μg总RNA 逆转录为cDNA,按PCR 试剂盒说明书进行实验。GAPDH 上游引物为5'-TGGAATCCACTGGCGTCTT C-3',下游引物为5'-GGTTCACGCCCATCACAAAC-3';Runx2上游引物为5'-GACTGTGGTTACCGTCAT GGC-3',下游引物为5'-ACTTGGTTTTTCATAACA GCGGA-3'。反应体系:2×Kapa SYBR Fast qPCR Mix 10 μL,上、下游引物各400 nmol/L,cDNA 约50 ng,加ddH2O至总体积20 μL。反应条件:95℃预变性3 min,95℃变性10 s,60℃退火15 s,72℃延伸10 s,40个循环。
1.6 MSCs收集及静脉注射
兔ANFH 造模4 周后,收集体外Runx2修饰的MSCs,计数后用生理盐水将细胞终浓度调至5×106/mL。于耳缘静脉注射细胞悬液,A组每只兔注入1×107个AdEasy/Runx2转染的MSCs,B 组兔注入1×107个Runx2siRNA 转染的MSCs,C 组兔注入1×107个未处理组MSCs,D 组作为对照组,注入等体积生理盐水。
1.7 股骨头标本采集及Micro-CT扫描
细胞植入后分别于2、4、6、8周后取出各组股骨头标本,浸泡在福尔马林液里密封保存。于中国医学科学院医学实验动物研究所完成Micro-CT 扫描,扫描部位取家兔股骨标本近端股骨颈以上至股骨头末端,保持股骨长轴与扫描室切面垂直,设定扫描参数为扫描层面厚度20 μm、球管电压80 kV、电流500 μA。扫描完成后,选取股骨头区域进行分析、比较。观察比较各组兔股骨头形态、关节面有无变形塌陷,软骨下骨密度、骨小梁分布及形态等。
2 结果
2.1 AdEasy1/Runx2转染MSCs的效率及鉴定
AdEasy 载体携带GFP 标签,AdEasy1/Runx2转染MSCs 培养约48 h 后,荧光显微镜下可见细胞发出绿色荧光,当MOI 为80 时,约80%的细胞可发荧光,AdEasy1/Runx2可有效感染MSCs(图1)。一般情况下MSCs 表达的Runx2水平很低,但AdEasy1/Runx2转染后MSCs 中Runx2mRNA 的表达水平明显提高(图2),蛋白水平也显示Runx2的表达显著增加(图3),说明转入的外源性Runx2极大地增强了MSCs表达Runx2mRNA及Runx2蛋白的能力。
2.2 Runx2 siRNA转染MSCs效果鉴定
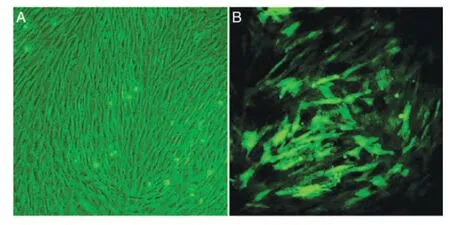
图1 MSCs形态观察

图2 Real-time PCR检测转染AdEasy1/Runx2后Runx2 mRNA表达
Runx2反义核苷酸序列siRNA 转染MSCs 后,对MSCs 的生长及形态无明显影响。以不加siRNA 细胞为对照组,含50 nmol/L siRNA 的培养液培养48 h 后可明显降低Runx2的mRNA 表达水平(图4),Runx2蛋白表达水平也明显被抑制(图5)。
2.3 Micro-CT扫描结果
第2周Micro-CT扫描结果显示各组股骨头均有坏死,表现为关节面边缘模糊,软骨面骨皮质厚度变薄,关节面下骨密度分布不均匀,软骨下出现囊性样改变,骨小梁稀疏、出现断裂不连续、结构紊乱,骨小梁间隙变宽,但各组间差异不明显。至第4周,A、B、C组骨坏死程度不再加剧,并出现轻度修复反应;而D组无改善,骨小梁进一步减少,骨小梁间隙进一步增加,皮质骨下部分区域出现骨缺损形成小空洞。第6周,A、B、C组出现更为明显的修复反应,骨皮质厚度增加,骨小梁数目及厚度增大,其中以A组表现较为明显,B 组相对较差;而D 组骨质进一步减少,骨皮质边缘不光滑,甚至有塌陷,皮质骨下空洞较之前更为扩大,骨小梁数目严重减少。至第8 周时各组表现出显著差异,A组股骨头关节面清晰、形态完整,软骨下骨质密度均匀,骨小梁致密,股骨头形态基本接近正常;B组股骨头形态较A组差,但较其第2 周时有明显改善;C 组修复情况介于两者之间;D组股骨头坏死严重,关节面有塌陷,关节面下出现较大骨缺损空洞,骨小梁变薄变稀疏,骨密度也严重下降(图6)。图7 为A、D 组股骨头在各时间点的Micro-CT扫描比较。
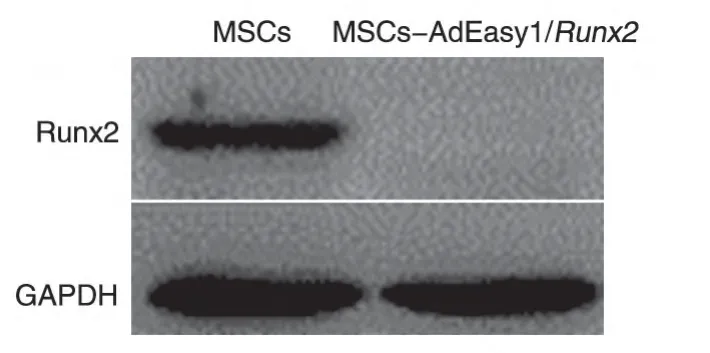
图3 Western印迹检测转染AdEasy1/Runx2后Runx2蛋白的表达

图4 Real-time PCR检测转染Runx2 siRNA后Runx2 mRNA的表达

图5 Western印迹检测转染Runx2 siRNA后Runx2蛋白的表达
3 讨论

图6 8周时股骨头Micro-CT检测结果
ANFH主要的骨形态改变表现为骨质连续性破坏和骨小梁形态异常,股骨头坏死的生物应力可改变骨小梁的立体结构及空间排列,使其力学强度减弱,最终难以承重导致塌陷[7]。ANFH 发生后,成骨细胞介导的新生骨生长和破骨细胞介导的坏死骨吸收同时出现[8]。随着两种作用的进展,骨内微观结构尤其是骨小梁形态会发生不断改变。检测和观察股骨头坏死病灶局部微观结构动态变化的过程,是判断病程进展、评价修复程度的重要方法,过去因缺少有效检测方法而难以评价。随着影像学检测技术的进步,应用Micro-CT 可对在体及离体骨组织微观结构进行高清成像,其分辨率可达微米级别,而不破坏内部结构,结合相关分析软件可以对骨小梁相关参数和骨密度等指标进行定量分析[9],此外结合血管灌注造影技术还可对股骨头血供进行立体观察[10],这提供了一种通过微观结构定性定量精确评价股骨头的有效方法。
MSCs 移植治疗ANFH 已被大量运用于科研实验及临床治疗之中,常见的方法包括髓芯钻孔减压联合MSCs 注射移植、介入加MSCs 移植、基因转染MSCs 静脉移植等,均有一定的治疗效果[11]。Runx2是一种成骨特异性转录因子,体内外研究均表明Runx2过表达可增强MSCs的成骨分化能力,促进修复骨缺损及骨坏死[12]。而将Runx2基因转染MSCs后静脉移植治疗ANFH,观察其修复股骨头坏死、预防股骨头塌陷的相关研究尚未见报道。
本研究对各处理组兔细胞移植后2、4、6、8周不同时段取股骨头标本行Micro-CT 检测,观察股骨头修复过程中微观形态结构变化及计量学参数对比,不仅可以比较组间修复差异,还能动态评价病灶修复进程。Micro-CT 检测结果显示MSCs 移植治疗组自第2周开始股骨头微观结构逐渐改善,至第8周时取得了较好的修复效果,股骨头形态完整,但又以Runx2修饰组修复效果最明显,Runx2抑制组修复效果相对较差。对照组自第2周起股骨头微观结构逐渐破坏,至8 周后骨小梁形态严重异常,股骨头塌陷,这可能与其力学强度丧失有关[7]。本研究肯定了MSCs 移植治疗兔ANFH 的效果,且证明Runx2基因修饰后能进一步提升MSCs移植后的治疗效果。
本实验虽然在腺病毒介导的Runx2转染MSCs移植治疗组取得了最佳疗效,但腺病毒载体的生物安全性还有待进一步检测[13]。MSCs 可大量归巢至骨坏死病灶,也有部分能归巢至其他部位[14],Runx2的高表达可能促成异位成骨或其他异常情况。实验中仅仅检测了短期修复效果,远期疗效有待评估。此外,我们选取兔作为造模对象,其主要靠后肢承重,但仍为四足动物,这与人的生理结构和承重机制仍有一定差异。总之,Runx2修饰MSCs后静脉移植可作为ANFH 的一种新的治疗方法,但将此方法应用于人体的安全因素及治疗效果仍须继续探索。
[1]Gagala J,Buraczynska M,Mazurkiewicz T,et al.Prevalence of genetic risk factors related with thrombuphilia and hypofibrinolysis in patients with osteonecrosis of the femoral head in Poland[J].BMC Muscuioskelet Disard,2013,14:264.
[2]Yan Z,Huang D,Guo C,et al.Fate of mesenchymal stem cells transplanted to osteonecrosis of femoral head[J].J Orthop Res,2009,27(4):442-446.
[3]Xie X H,Wang X L,He Y X,et al.Promotion of bone repair by implantation of cryopreserved bone marrow-derived mononuclear cells in a rabbit model of steroid-associated osteonecrosis[J].Arthritis Rheum,2012,64(5):1562-1571.
[4]Hambli R.Micro-CT finite element model and experimental validation of trabecular bone damage and fracture[J].Bone,2013,56(2):363-374.
[5]李章华,赵强,唐欢,等.成骨细胞特异性转录因子Cbfa1重组腺病毒质粒的构建与鉴定[J].生物技术通讯,2014,25(4):511-514.
[6]崔西龙,李章华,戴双武,等.改良型非创伤性股骨头缺血坏死动物模型的建立[J].武汉大学学报,2012,31(1):61-64,110.
[7]Sakai T,Sugano N,Nishii T,et al.Extent of osteonecrosis on MRI predicts humeral head collapse[J].Clin Orthop Relat Res,2008,466(5):1074-1080.
[8]王程,苟文隆,徐小龙,等.人股骨头坏死标本不同区域骨小梁的显微结构特征及病理学表现[J].解放军医学院学报,2014,35(5):463-465.
[9]Effendy N M,Khamis M F,Shuid A N.Micro-CT assessments of potential anti-osteoporotic agents[J].Curr Drug Targets,2013,14(13):1542-1551.
[10]谢巍,周小兵,李靓,等.股骨头血供的三维可视化建模及意义[J].解剖学杂志,2010,33(1):124-125.
[11]李瑞琦,张国平,任立中,等.骨髓间充质干细胞治疗股骨头坏死的评价[J].中国组织工程研究,2013,17(35):6327-6332.
[12]Zheng H,Guo Z,Ma Q,et al.Cbfa1/osf2 transduced bone marrow stromal cells facilitate bone formation in vitro and in vivo[J].Calcif Tissue Int,2004,74(2):194-203.
[13]Pathak A,Patnaik S,Gupta K C.Recent trends in non-viral vector-mediated gene delivery[J].Biotechnol J,2009,4(11):1559-1572.
[14]Li Z H,Liao W,Cui X L,et al.Intravenous transplantation of allogeneic bone marrow mesenchymal stem cells and its directional migration to the necrotic femoral head[J].Int J Med Sci,2011,8(1):74-83.

